в чем смысл реакции нейтрализации
Реакция нейтрализации – примеры, типы и применение
Взаимодействие кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно подобные реакции протекают с выделением тепла.
Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
HCl + NaOH → NaCl + H2O.
Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда).
Раствор двух активных соединений превратился в воду за счёт обмена натрием и хлором, поэтому ионное уравнение данной реакции выглядит следующим образом:
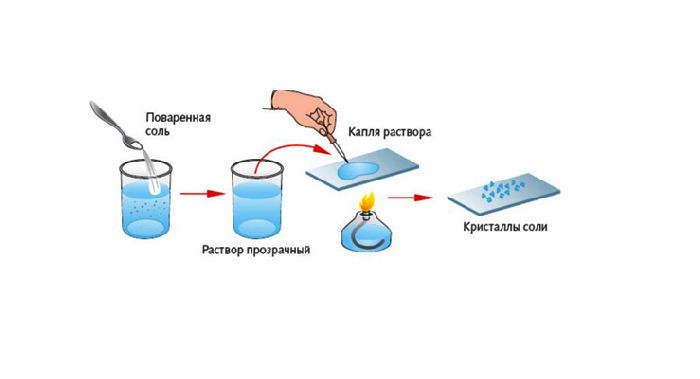
После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
Рис. 1. Образование соли после выпаривания.
В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Cu(OH)2 + 2HNO3 ↔ Cu(NO3)2 + 2H2O.
Рис. 2. Взаимодействие гидроокиси меди с кислотой.
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.
Кроме того, важно практическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция протекает с выделением тепла. Нейтрализация применяется в медицине и фармакологии.
Реакция нейтрализации

Всего получено оценок: 496.
Всего получено оценок: 496.
Взаимодействие кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно подобные реакции протекают с выделением тепла.
Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда).
После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.

Кроме того, важно практическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция протекает с выделением тепла. Нейтрализация применяется в медицине и фармакологии.
Урок 17. Реакция нейтрализации
В уроке 17 «Реакция нейтрализации» из курса «Химия для чайников» рассмотрим процесс нейтрализации, а также понятия химический эквивалент вещества и грамм-эквивалент; кроме того научимся вычислять нормальную концентрацию раствора. С реакцией нейтрализации тесно связаны понятия «кислота» и «основание», поэтому настоятельно рекомендую подробно изучить урок 16 «Кислоты и основания»
Нейтрализация
Важным свойством кислот и оснований является их способность образовывать в растворе ионы H+ и OH-, которые могут атаковать другие имеющиеся там молекулы и вызывать химические превращения, с трудом или медленно протекающие в их отсутствии. Когда кислоты и основания реагируют друг с другом, ионы H + и OH — соединяются, образуя молекулы воды. Этот процесс называется нейтрализацией:
Химический эквивалент
С реакцией нейтрализации тесно связано процедура кислотно-основного титрования. Грубо говоря, титрование — это способ определения имеющегося количества кислоты или основания в растворе, путем измерения количества основания или кислоты с заданной концентрацией необходимого для полной нейтрализации имеющегося реагента. При титровании пользуются понятием химический эквивалент.
Полная нейтрализация происходит в том случае, если в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания.
Грамм-эквивалент — это масса кислоты (или основания) в граммах, которая образует 1 моль ионов H + (или OH — )
В удобстве использования понятий химического эквивалента и грамм-эквивалента можно убедиться при рассмотрении нейтрализации фосфорной кислоты гидроксидом магния:
Рассмотрим решение конкретной задачи по химическим эквивалентам и грамм-эквивалентам:
Пример 1. Используя метод эквивалентов, найдите число граммов HNO3 необходимо для нейтрализации 100,0 г Ba(OH)2.
Первым делом выпишем молекулярные массы и грамм-эквиваленты для HNO 3 и Ba(OH) 2 :
| Реагент | Молекулярная масса, г/моль | Грамм-эквивалент, г/экв |
| Азотная кислота, HNO3 | 63,01 | 63,01 / 1 = 63,01 |
| Гидроксид бария, Ba(OH)2 | 171,34 | 171,34 / 2 = 85,67 |
Отлично! Теперь найдем сколько химических эквивалентов гидроксида бария содержится в 100,0 г:
В начале урока мы говорили, что полная нейтрализация получается, когда в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания. Поэтому для нейтрализации 1,167 экв Ba(OH)2 потребуется 1,167 экв HNO3:
Ответ получен! Кстати, данную задачу можно решить по другому, используя полное уравнение реакции :
Число моль Ba(OH)2, вступающего в реакцию, равно:
Из полного уравнения реакции следует, что в ней должно принять участие вдвое большее молярное количество азотной кислоты, чем гидроксида бария:
А в граммах это составит:
Ответы совпадают, т.е оба метода решения верны, однако метод эквивалентов позволяет обойтись без использования полного уравнения реакции.
Нормальная концентрация
Нормальная концентрация, или нормальность раствора (н.) показывает, сколько эквивалентов вещества содержится в 1 л его раствора. Например, по аналогии с молярной концентрацией, 1,00 М раствор H3PO4 имеет нормальность 3,00 н, а 0,010 М раствор Mg(OH)2 имеет нормальность 0,020 н.
Пример 2. Определите молярность и нормальность 500 мл раствора, полученного при растворении в воде 4,00 г NaOH.
По таблице Менделеева находим молекулярную массу гидроксида натрия, она равна 40,0 г/моль. В нашем распоряжении ровно 4,00 г NaOH, и в них содержится:
Нам уже известно, что молярная концентрация представляет собой отношение числа моль растворенного вещества на общий объем раствора, следовательно молярность раствора гидроксида натрия равна:
В данном случае молярность раствора совпадает с его нормальностью, поскольку каждый моль гидроксида натрия дает 1 эквивалент OH — ионов. Следовательно нормальность полученного раствора равна также 0,200 н.
Пример 3. В 750 мл раствора содержится 10,0 г серной кислоты H2SO4. Определите молярность и нормальность данного раствора.
Надеюсь урок 17 «Реакция нейтрализации» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 17. Реакция нейтрализации
В уроке 17 «Реакция нейтрализации» из курса «Химия для чайников» рассмотрим процесс нейтрализации, а также понятия химический эквивалент вещества и грамм-эквивалент; кроме того научимся вычислять нормальную концентрацию раствора. С реакцией нейтрализации тесно связаны понятия «кислота» и «основание», поэтому настоятельно рекомендую подробно изучить урок 16 «Кислоты и основания»
Нейтрализация
Важным свойством кислот и оснований является их способность образовывать в растворе ионы H+ и OH-, которые могут атаковать другие имеющиеся там молекулы и вызывать химические превращения, с трудом или медленно протекающие в их отсутствии. Когда кислоты и основания реагируют друг с другом, ионы H+ и OH— соединяются, образуя молекулы воды. Этот процесс называется нейтрализацией:
Химический эквивалент
С реакцией нейтрализации тесно связано процедура кислотно-основного титрования. Грубо говоря, титрование — это способ определения имеющегося количества кислоты или основания в растворе, путем измерения количества основания или кислоты с заданной концентрацией необходимого для полной нейтрализации имеющегося реагента. При титровании пользуются понятием химический эквивалент.
Полная нейтрализация происходит в том случае, если в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания.
Грамм-эквивалент — это масса кислоты (или основания) в граммах, которая образует 1 моль ионов H+ (или OH—)
Для кислот, способных высвобождать 1 ион H+ на молекулу, как, например, HCl или HNO3, химический эквивалент представляет собой то же самое количество вещества, что и моль, а 1 грамм-эквивалент — то же самое, что и молекулярная масса. Однако поскольку H2SO4 способна высвобождать два иона H+ на молекулу, 1 молю H2SO4 соответствуют два эквивалента, и поэтому в реакциях кислотно-основной нейтрализации грамм-эквивалент серной кислоты равен половине ее молекулярной массы. Грамм-эквивалент фосфорной кислоты H3PO4, т.е. такая ее масса в граммах, которая образует 1 моль ионов H+, равен 1/3 молекулярной массы этой кислоты. Точно так же для NaOH, KOH и NH3, молекулярные массы совпадают с грамм-эквивалентами этих веществ, но грамм-эквивалент Ca(OH)2 равен половине его молекулярной массы.
В удобстве использования понятий химического эквивалента и грамм-эквивалента можно убедиться при рассмотрении нейтрализации фосфорной кислоты гидроксидом магния:
Рассмотрим решение конкретной задачи по химическим эквивалентам и грамм-эквивалентам:
Пример 1. Используя метод эквивалентов, найдите число граммов HNO3 необходимо для нейтрализации 100,0 г Ba(OH)2.
Первым делом выпишем молекулярные массы и грамм-эквиваленты для HNO 3 и Ba(OH) 2 :
| Реагент | Молекулярная масса, г/моль | Грамм-эквивалент, г/экв |
| Азотная кислота, HNO3 | 63,01 | 63,01 / 1 = 63,01 |
| Гидроксид бария, Ba(OH)2 | 171,34 | 171,34 / 2 = 85,67 |
Отлично! Теперь найдем сколько химических эквивалентов гидроксида бария содержится в 100,0 г:
В начале урока мы говорили, что полная нейтрализация получается, когда в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания. Поэтому для нейтрализации 1,167 экв Ba(OH)2 потребуется 1,167 экв HNO3:
Ответ получен! Кстати, данную задачу можно решить по другому, используя полное уравнение реакции :
Число моль Ba(OH)2, вступающего в реакцию, равно:
Из полного уравнения реакции следует, что в ней должно принять участие вдвое большее молярное количество азотной кислоты, чем гидроксида бария:
А в граммах это составит:
Ответы совпадают, т.е оба метода решения верны, однако метод эквивалентов позволяет обойтись без использования полного уравнения реакции.
Нормальная концентрация
Нормальная концентрация, или нормальность раствора (н.) показывает, сколько эквивалентов вещества содержится в 1 л его раствора. Например, по аналогии с молярной концентрацией, 1,00 М раствор H3PO4 имеет нормальность 3,00 н, а 0,010 М раствор Mg(OH)2 имеет нормальность 0,020 н.
Пример 2. Определите молярность и нормальность 500 мл раствора, полученного при растворении в воде 4,00 г NaOH.
По таблице Менделеева находим молекулярную массу гидроксида натрия, она равна 40,0 г/моль. В нашем распоряжении ровно 4,00 г NaOH, и в них содержится:
Нам уже известно, что молярная концентрация представляет собой отношение числа моль растворенного вещества на общий объем раствора, следовательно молярность раствора гидроксида натрия равна:
В данном случае молярность раствора совпадает с его нормальностью, поскольку каждый моль гидроксида натрия дает 1 эквивалент OH — ионов. Следовательно нормальность полученного раствора равна также 0,200 н.
Пример 3. В 750 мл раствора содержится 10,0 г серной кислоты H2SO4. Определите молярность и нормальность данного раствора.
Поскольку каждый моль серной кислоты высвобождает 2 эквивалента ионов H+, полученный раствор серной кислоты имеет нормальность, равную 2·0,136=0,272 н., т.е. представляет собой 0,272 н. раствора H2SO4.
Надеюсь урок 17 «Реакция нейтрализации» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Общие принципы
Сущность реакции нейтрализации заключается в том, что кислота и основание вступают во взаимодействие. Они обмениваются активными компонентами. Происходит нейтрализация обоих составляющих. В итоге получается вода и соль, имеющие нейтральную реакцию среды.
Общий принцип взаимодействия выглядит следующим образом: кислота соединяется со щёлочью, обменивается активными компонентами, в результате чего получается нейтральная соль и вода.
Наиболее простым примером реакции нейтрализации может стать взаимодействие гидроксида натрия с соляной кислотой. Формула представлена так:
NaOH + HCl → NaCl + H2O.
Перед соединением этих веществ можно проверить их реакцию с помощью лакмусовой бумаги:
Если получившийся раствор нагреть, вода постепенно испарится. В колбе останется осадок — поваренная соль (хлорид натрия).
Чтобы лучше понять, что такое реакция нейтрализации в химии, важно помнить, что 2 сложных вещества обмениваются между собой частями. В итоге получается 2 новых сложных компонента. Таким образом, нейтрализация — это частный случай большой группы реакций обмена.
Некоторые основания не растворяются в воде, но хорошо растворяются в кислотах. В результате взаимодействия тоже образуется вода и соль. Примером может быть реакция между нерастворимым гидроксидом меди и серной кислотой. В итоге получается медный купорос и вода.
Виды реакции
Процесс химической нейтрализации может происходить между веществами с разной активностью: сильной кислотой и таким же основанием или между слабой кислотой и сильной щёлочью. В химии выделяют 2 типа реакции:
Реакции нейтрализации относятся к разряду экзотермичных. При взаимодействии выделяется много энергии в виде тепла. Количество выделенной энергии — относительный показатель, который получил название теплового эффекта химической реакции.
Мера энергии, накопленной веществом при образовании, называется энтальпией. В экзотермических реакциях значение энтальпии всегда бывает отрицательным.
Названия солей
Все международные химические названия солей, полученных в результате нейтрализации, строятся по единому принципу и состоят из двух слов. Первое слово — это наименование кислотного остатка. Оно является производным от латинского названия кислоты:
Второе слово в названии соли — это наименование металла. У некоторых элементов периодической таблицы валентность изменяется. В этом случае она указывается в скобках.
В качестве примера можно привести названия солей:
Это утверждение верно и для обратной ситуации — по названию соли можно определить её химическую формулу. Вначале записывается символ, которым металл обозначается в периодической таблице. Затем добавляется формула кислотного остатка.
Следующий шаг — определение валентности обеих частей. Теперь нужно найти для них наименьшее общее кратное и разделить его на валентность каждой части соли. Значит, в результате получается количество атомов металла в формуле и количество кислотных остатков.
Кислотный остаток может иметь сложную структуру и содержать в себе несколько разных атомов (азотная, серная, фосфорная кислоты и пр.). При составлении формулы соли кислотный остаток вписывается в скобки. За ними цифровым индексом обозначается количество остатков.
Титрование и химический эквивалент
Реакция нейтрализации связана с процедурой титрования. В химии так принято называть определение количества щёлочи или кислоты в растворе. Для этого берётся реагент с заданной заранее молярной концентрацией. Вычисляется, сколько его нужно для осаждения искомого вещества. При титровании используется понятие химической эквивалентности:
Если реагируют одинаковые химические эквиваленты, нейтрализация называется полной. В этом случае в растворе не останется кислоты или щёлочи, не вступившей в реакцию. Масса эквивалента кислоты или основания в граммах называется грамм-эквивалентом.
Все кислоты, которые выделяют из 1 молекулы 1 ион водорода, подчиняются следующей закономерности: их химический эквивалент равняется 1 молю вещества. Молекулярная масса таких соединений равна 1 грамм-эквиваленту.
Если вещество выделяет из 1 молекулы 2 иона водорода, его грамм-эквивалент равен половине молекулярной массы, а 1 моль соответствует 2 химическим эквивалентам.
С этим химическим процессом связано ещё одно понятие — нормальность или нормальная концентрация вещества. Этот фактор отражает, сколько эквивалентов содержит 1 литр раствора.
Применение на практике
Методы нейтрализации положены в основу титриметрического анализа. Титрование используется во многих сферах:
Нередко эта химическая реакция используется в быту. При проливе уксусной или другой кислоты на кожу может возникнуть ожог. В качестве первой помощи необходимо тщательно промыть место чистой водой, после чего обработать содовым раствором. Той же тактики придерживаются при ожоге едкой щёлочью. В качестве нейтрализатора используется лимонная или уксусная кислота в слабом разведении.