в чем сходство металлической и ионной связи
В чем сходство металлической и ионной связи
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
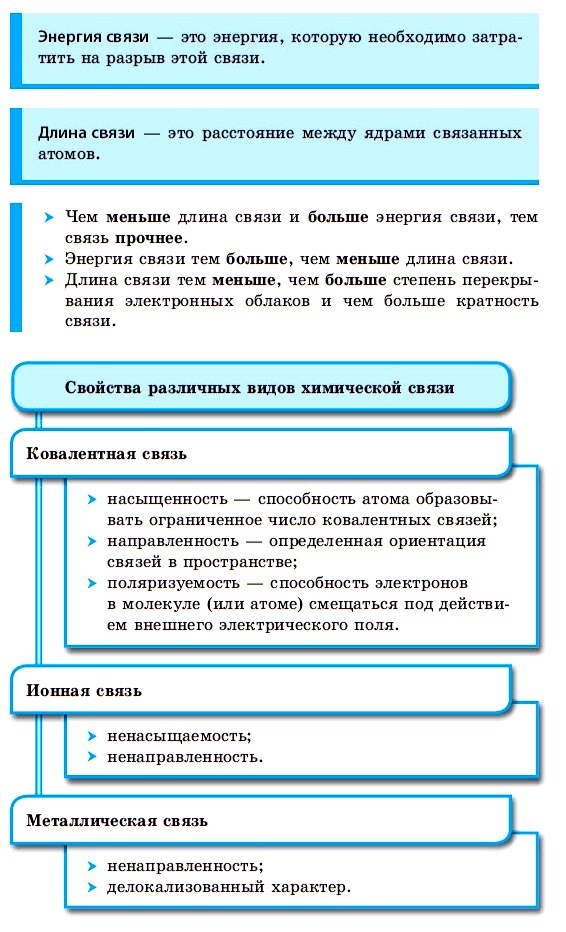
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:
Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:
На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
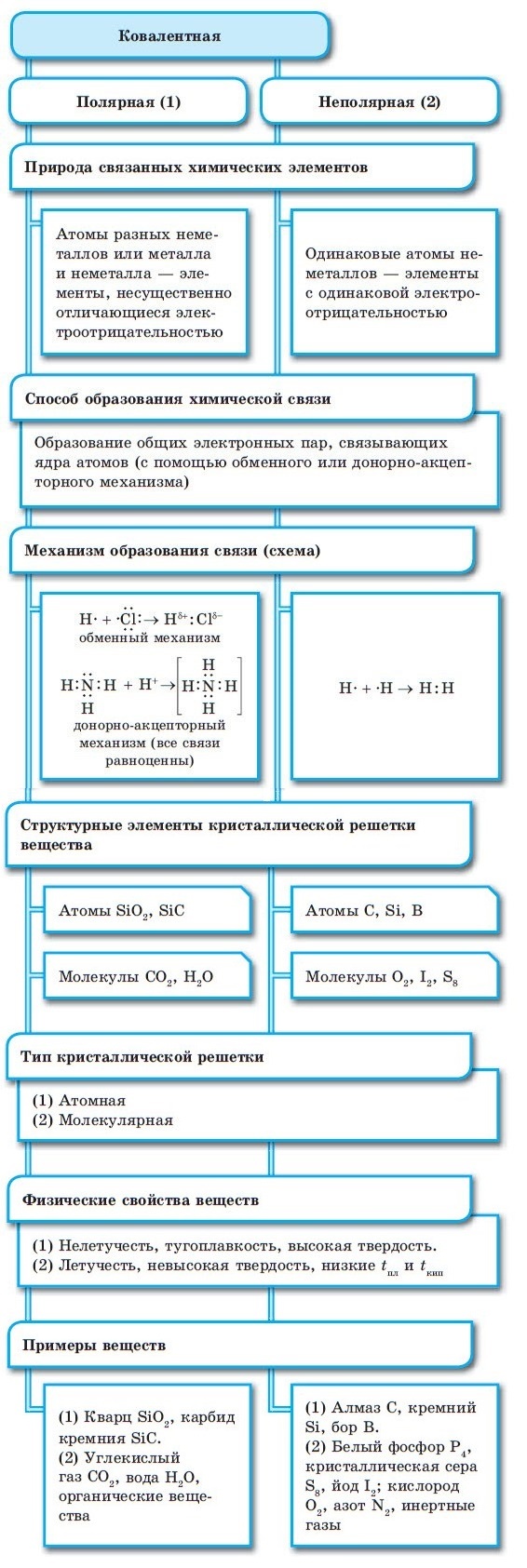
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Металлическая связь
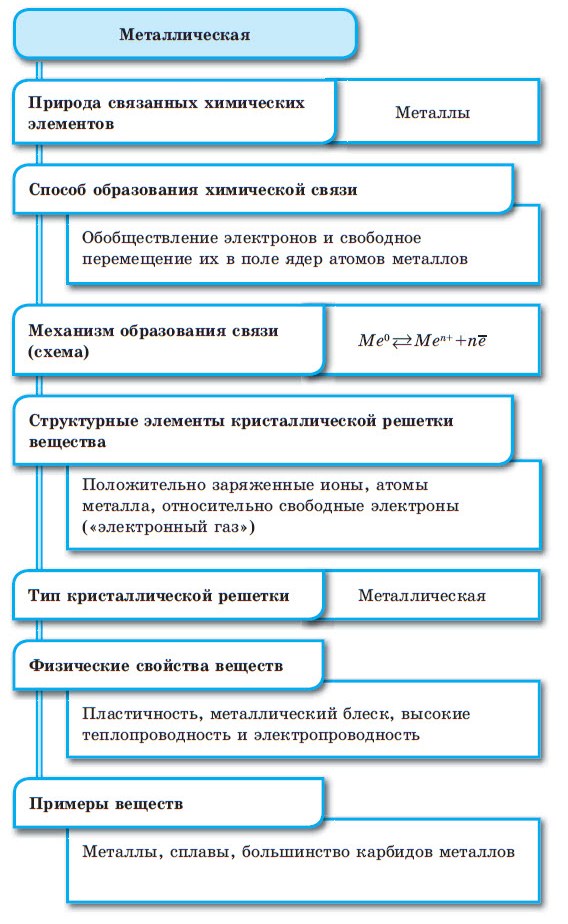
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:
Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
В чем сходство металлической и ионной связи?
Сера весьма активный неметалл и может взаимодействовать с большим количеством других веществ. Обычно для начала взаимодействия смесь необходимо нагреть.
Реагирует с большим количеством органические соединений при нагревании. Способна дегалогенировать галогенорганические соединения (эта способность предложена для нейтрализации токсичных хлорорганических веществ). С циклогексаном и его производными дает бензол и его производные.
Острый вкус и резкий запах чесноку придает содержащиеся в нем эфирные масла, называемые тиоэфирами. Аллицин, образующийся при механическом воздействии на клетки чеснока, представлен в наибольшей концентрации и определяет остроту, горечь и неприятный запах растения. В то же время он обладает отличными противомикробными свойствами.
Коэффициентом растворимости называется масса вещества, которая может расстворяться в 100 граммах воды при данной температуре, после чего образуется насыщенный раствор. Другими словами можно сказать, что- это максимальная масса вещества, которая смогла растворится в 100 граммах воды.
Коэффициент растворимости находится пропорцией. Измеряется в m (г) вещества на 100 г растворителя.
Обычно вот такой таблицей растворимости мы пользовались на уроках химии:
Химия
Именная карта банка для детей
с крутым дизайном, +200 бонусов
Закажи свою собственную карту банка и получи бонусы
План урока:
Словно компоненты конструктора, атомы соединяются между собой. И как бы, Вы не старались, но с единичным блоком можно соединить, только один блок. Деталь на 4 ячейки, может удержать не больше четырёх. Этот принцип сохраняется и в химии. За количество свободных ячеек отвечает валентность атомов элементов.
Результатом взаимодействия атомов является получение веществ. Виды химической связи атомов зависят от природы составляющих элементов.
Металлы отличаются малым количеством электронов на внешнем уровне сравнительно с неметаллами более низким значением электроотрицательности. Теперь наша задача вспомнить, как происходит изменение ЭО в таблице Менделеева или воспользоваться таблицей «Относительная электроотрицательность». Чем активнее неметалл, тем она выше и это говорит о том, что этот элемент, при образовании связи, будет забирать электроны.
Веществ насчитывается миллионы. Это могут быть простые вещества: металлы железо Fe, золото Au, ртуть Hg; неметаллы сера S, фосфор Р, азот N2. Так и сложные вещества: H2S, Ca3(PO4)2, (C6H10O5)n, молекулы белков и т.д.Комбинация элементов, входящих в состав веществ, определяет какие типы связей будут существовать между ними.
Ковалентная связь
Неметаллы из числа всех элементов находятся в меньшинстве. Но имея некоторые особенности в строении и способности иметь переменную валентность, число соединений, построенных этими элементами внушительное.
Чтобы иметь представление, по которому атомы соединяются, начнём с молекулы водорода Н2.
Давайте дадим волю фантазии, представим то, что нельзя увидеть. Допустим, что мы взяли в руки две одинаковые детали, имеющие такой вид:
Существует одна только комбинация их соединения, и между ними будет одно общее звено. Переместимся с нашего воображения к молекулам. Представим, что перед нами, два атома водорода и наша задача их соединить в молекулу. Покрутите мысленно детали, чтобы они объединились, необходимо их поставить друг на друга, связав их в определённом месте. Точки рядом означают, сколько электронов, располагающихся на наружном слое.
Атомы водорода, как детали, соединились одной связью, поэтому валентность в данном случае каждого из них будет равна I. Но степень окисления будет равна 0, так как вещество образовано элементом с одинаковым значением электроотрицательности.
Рассмотрим, как образуется молекула самого распространённого газа на нашей планете – азота N2.
Азот, имеет 3 неспаренных электрона. Это как взять две детали вида и соединить их.
Таким образом, азот трёхвалентен, а степень
Ковалентная связь в молекуле, состоящей из одного типа атомов, а именно неметаллов, носит название неполярная.
Во время построения молекулы, количество электронов стремится к завершению. Рассмотрим как образуется молекула О2. Каждому атому не хватает 2 электронов и они эту недостачу компенсируют общей электронной парой.
Также обращаем внимание, что степень окисления 0, ибо атомы равноправные партнёры, и их валентность равна II.
Ковалентная химическая связь образованная разными неметаллами называется полярная.
Возьмём два неметаллических элемента Водород и Хлор. Укажем электронные формулы внешнего слоя.
Такой вид образования соединений происходит по обменному механизму. Это значит, чтобы получить завершённую конфигурацию более электроотрицательные принимают электроны, менее – отдают, но при этом существует общая электронная пара.
Неметаллы образуют не только бинарные соединения, а возможно в состав будет входить три и более элемента. К примеру, молекула угольной кислоты H2СO3 состоит с 3 элементов. Как они между собой соединяться. Электроотрицательность возрастает в ряду ЭО (Н) + 2С +4 О −2 3. Это означает, что кислород будет притягивать на себя электроны углерода и водорода. Схематически это можно записать в следующем виде.
Чтобы построить структурную формулу, в центре записываем углерод. У него неспаренных 4 электрона. Поскольку атомов кислорода в количестве 3, каждый из них может принять 2 электрона. То путём не хитрых вычислений, видим что 4 электрона придёт от С и по одному от каждого Н. проверяем наш расчёт, учитывая нейтральность молекулы, считаем положительные и отрицательные заряды.
Н2 + С +4 О3 −2 (+1 ∙ 2) + (+4 ∙ 1) + (-2 ∙ 3) = 0
Существует ещё один механизм ковалентной связи, под названием донорно-акцепторный.
Чтобы понять этот принцип, опишем образование молекулы, имеющей не совсем приятный резкий, удушающий запах, аммиак NH3.
Незадействованные до этого «красные» электроны N «заселяются» в пустой s-орбитали, принадлежащей катиону водорода. Ион аммония имеет 3 связи, которые происходят по обменному механизму, а также одну, по донорно-акцепторному. Именно поэтому NH3 легко взаимодействует с кислотами и водой.
Ионная связь
Ионная химическая связь является пограничной ковалентной полярной. Отличаются тем, что для веществ, в которых локализуется ковалентная связь, характерно существование совместной электронной пары, тогда как для ионной связи свойственна полная отдача электронов. Следствием отдачи является образование заряженных частиц – ионов.
Определить тип связи помогут вычисления. Если разность значений электроотрицательностей больше 1,7, то для вещества характерна ионная связь. Если значение меньше 1,7, то свойственная полярная связь. Рассмотрим два вещества NaCl и СаС2. Оба они образованы металлом (Na и Са) и неметаллом (Clи С). Однако в одном случае связь будет ионная, во втором – ковалентная полярная.
Постулат физики гласит, что противоположности притягиваются. Т.е. положительные ионы притягивают отрицательные и наоборот.
Допустим, что необходимо получить вещество с атомов калия и фтора. Каждый атом стремится заполучить конфигурацию благородного газа. Достигнуть этого возможно двумя способами отдав или приняв электроны, образуя при этом ионы с желаемой конфигурацией.
Атому калия гораздо проще отдать 1 электрон, чем забрать у фтора 7. Принимая 1 электрон, F имеет завершённый уровень.
Аналогично калий, который с лёгкостью отдал свой электрон, его катион принял электронную формулу аргона.
Кальций двухвалентный металл, то для взаимодействия необходимо два атома фтора, поскольку он способен принять только один электрон. Схема образования ионной связи имеет вид.
Следует отметить, что ионная связь будет существовать между Naи О, а между С и О ковалентная полярная.
Металлическая связь
Металлы существуют в разных цветах: чёрные (железо), красные (медь), жёлтые (золото), серые (серебро), плавятся при разных температурах. Однако их всех объединяет наличие блеска, твёрдости, электропроводимости.
Металлическая связь имеет черты сходства с ковалентной неполярной. Металлы бедны электронами на внешнем уровне, поэтому при образовании связи, они не способны притягивать на себя их, для них свойственна отдача. Так как атомный радиус в металлах большой, это даёт возможность легко оторваться электронам, образовав катионы.
Электроны постоянно перемещаются от атома к иону и наоборот. Сами катионы можно сравнить с айсбергами, окружёнными отрицательными частицами.
Схема металлической связи
Водородная связь
Водородная химическая связь изображена …… пунктиром. Соединяясь между собою молекулы, играют и находят важную роль в живых организмах. С помощью водородной связи строится вторичная структура молекулы ДНК.
Типы кристаллических решёток
Чтобы получить вещество, а не просто набор молекул, необходимо частицы «запаковать» в своеобразный каркас – кристаллическую решётку.
Представьте перед собой геометрическую фигуру – куб, в вершинах будут находиться частицы, условно соединённые между собою.
Существует прямая зависимость между строением атома и типом кристаллической решётки.
Обратите внимание, что соединения с ковалентной неполярной связью образованные частицами-молекулами, которые запакованы в молекулярную кристаллическую решётку. Чаще всего это будут соединения по температурному режиму низкокипящие и летучие. Это известные вам вещества как кислород О2, хлор Cl2, бром Br2.
В узлах атомной кристаллической решётки находятся отдельные атомы, между которыми существует ковалентная неполярная связь. Атомная кристаллическая решётка свойственна алмазу. На данный момент это самое твёрдое вещество. Данный тип связи характерен для вещества, покрывающего значительную часть нашей планеты, это –SiO2 (песок) и карборунд SiC, имеющий похожие свойства с алмазом.
Ионная связь между атомами образует кристаллическую решётку, в узлах которой будут находиться катионы и анионы. Это строение объединяет между собой целый класс неорганических соединений солей, состоящих с катионов металлов и анионов кислотного остатка. Характерными особенностями этих веществ будут высокие температуры, при которых они плавятся и кипят.
Металлическая связь имеет металлическую кристаллическую решётку. В её строении можно провести параллель с ионной решёткой. В узлах будут размещаться атомы и ионы, а между ними электронный газ, состоящий из мигрирующих электронов от атома к электрону.
Обобщая данные сведения, можем сделать вывод, зная состав и строение, можем прогнозировать свойства и наоборот.
В чем сходство металлической и ионной связи
Основы строения вещества
Глава 12. Металлическая связь
Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому в кристаллической решетке металла эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. «Обобществленные» электроны передвигаются в пространстве между катионами и удерживают их вместе. Межатомные расстояния в металлах больше, чем в их соединениях с ковалентной связью. Такая связь существует не только в твердых кристаллах металлов, но и в расплавах и в аморфном состоянии. Она называется металлической.
Единая система электронов в металлических веществах называется электронным газом. Металл можно представить в виде остова из положительных ионов, погруженного в электронный газ, который компенсирует силы взаимного отталкивания положительных ионов. В свою очередь, электронный газ может свободно двигаться через решетку, состоящую из ионов металла. В кристаллах металлов атомы ионизированы не полностью, и часть валентных электронов остается связанной. В результате возможно появление частично ковалентных связей между соседними атомами. Вклады ионной и ковалентной составляющей обнаружены во многих металлах. Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связи.
Сравнение металлической связи с ионной и ковалентной
Важнейшим признаком металлов считают высокую электропроводность, которая уменьшается с ростом температуры. Электроны в металле беспорядочно движутся, переходя от одного атома к другому. А положительно заряженные ионы лишь слегка колеблются около своего положения в кристаллической решетке. Благодаря наличию свободных, не связанных с определенными атомами электронов, металлы хорошо проводят электрический ток и тепло. При нагревании металла колебания катионов усиливаются. Электронам труднее продвигаться между ними, поэтому электрическое сопротивление металла увеличивается.
Наличие свободных электронов обусловливают высокую теплопроводность металлов и характерный металлический блеск. Их высокая пластичность и ковкость связаны с возможностью взаимного смещения катионов в металлической кристаллической решетке без разрыва химической связи.
Физические свойства металлов, такие как высокую тепло- и электропроводность, пластичность и ковкость, характерный (металлический) блеск можно объяснить исходя из представлений об электронном газе. Однако количественные расчеты с использованием такой модели строения металлических кристаллов не всегда приводят к результатам, совпадающим с экспериментальными данными. Поэтому для более строгого описания состояния электронов в металле используют квантово-химические методы.