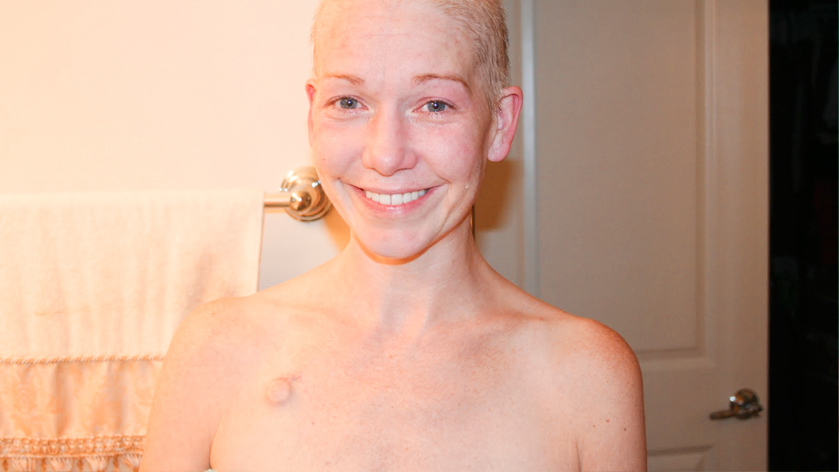в чем разница между инфузией и инъекцией
Поставьте мне капельницу!
Поделиться:
«Доктор, почему мне не прописали капельницы? Пичкаете таблетками, а не лечите». Подобные реплики со стороны пациентов — не редкость. Подавляющее большинство наших соотечественников, особенно среднего и пожилого возраста, беспрекословно верит в исцеляющую силу инфузий и с радостью предоставляет свои вены для травматичных манипуляций. В то же время на Западе инфузионная терапия используется лишь в исключительных случаях. Давайте разбираться, какая тактика оптимальна.
Тонкости введения
Капельница, или внутривенная капельная инфузия, — способ доставки различных растворов, как правило, внушительного объема (100–500 мл) прямо в кровь. Этот вид введения препаратов приобрел особую популярность в советской медицине во второй половине прошлого века, и на то были основания.
Читайте также:
Надо делать операцию
Во-первых, советские фармацевты и доктора были абсолютно уверены, что инфузионная терапия имеет существенные преимущества по сравнению с пероральной и внутримышечной. Считалось, что моментальное введение в кровоток и максимально высокая, 100%-ная биодоступность обеспечивают оптимальный лечебный эффект. А во-вторых, возможности отечественных врачей в те времена были значительно ограничены крепким железным занавесом, который практически исключал доступ к достижениям мировой медицины и фармакологии.
Однако последующее разрушение преград на пути к инновационным препаратам и современным знаниям не смогло сломать традиции, формировавшиеся десятилетиями. Приверженность многих врачей и подавляющего большинства пациентов капельницам оказалась нерушимой. Но если отвлечься от субъективных предпочтений, то сегодня очевидно, что инфузионная терапия имеет как положительные, так и отрицательные стороны, и последние зачастую перевешивают.
Преимущества капельниц
Преимущество, по сути, одно — высокая скорость доставки лекарственного вещества в кровь. Препарат проникает в кровоток моментально, а биодоступность препарата достигает 100 %.
Внимание — миф! Некоторые потребители считают, что инъекции действуют более щадяще на пищеварительный тракт, чем таблетки. Это заблуждение. Независимо от способа введения препараты, которые агрессивно влияют на слизистую оболочку ЖКТ (например, тот же диклофенак), всасываются в кровь и запускают цепочку биохимических реакций, которая снижает защитные возможности слизистой.
Недостатки капельниц
А вот недостатков чуть больше. Среди них:
В связи с последним инфузионная терапия не применяется при сердечной недостаточности, нарушении работы почек и некоторых других заболеваниях.
Тем не менее, несмотря на наличие отрицательных сторон, нельзя сказать, что капельницы — однозначно устаревший способ введения препаратов.
Когда капать?
В некоторых случаях внутривенное капельное введение препаратов действительно является терапией, не имеющей альтернативы. Так, капельницы необходимы:
В остальных случаях, к которым относятся большинство назначений инфузионной терапии, в капельницах нет необходимости. Современные пероральные препараты имеют высокую биодоступность и способны обеспечить необходимое содержание действующего вещества в крови.
А как же поддержать организм?
Поклонники капельниц, у которых отечественная медицина десятилетиями вырабатывала приверженность к травматичному и, увы, как правило, необоснованному лечению, ознакомившись с современным взглядом на инфузионную терапию, могут прийти в замешательство. Ведь они привыкли периодически ложиться в стационар, чтобы «поддержать» сосуды и сердце, а заодно печень и другие органы и системы. Более того — они получали реальный результат, в том числе в ситуациях, когда вводились препараты с недоказанной эффективностью.
Многие специалисты уверены, что в данных случаях можно смело говорить об эффекте плацебо, который может достигать внушительных показателей. Кроме того, нельзя забывать, что в стационаре больной, как правило, принимает и таблетки, причем дисциплинированно. И эффект лечения во многом обусловлен именно пероральной терапией.
Кстати, если «свежевыписавшийся» пациент прекращает прием выписанных таблеток, с огромной степенью вероятности его состояние вновь ухудшится — независимо от числа капельниц, полученных в стационаре.
Но вернемся к вопросу, как же тогда правильно поддерживать сердце, сосуды и организм в целом. Ответ на него настолько прост, что, возможно, любители «полечиться» разочаруются. Единственно эффективное средство, позволяющее улучшить работу сердечно-сосудистой системы и снизить вероятность развития множества заболеваний, — здоровый образ жизни.
Эти три слова, которые, возможно, у многих уже навязли на зубах — так часто об этом говорят в последние годы, подразумевают целый список подчас серьезных изменений в укладе жизни:
Не менее эффективными способами поддержать сердце остаются контроль уровня артериального давления, глюкозы в крови и холестерина, а при необходимости — корректировка этих показателей с помощью современных препаратов.
Несмотря на кажущуюся простоту перечисленных выше мер, совершенно очевидно: если каждый любитель «прокапаться» займется всерьез своим здоровьем, он непременно почувствует, что капельницы ему действительно не нужны.
Имплантируемые порт-системы – назначение и преимущества
СОДЕРЖАНИЕ:
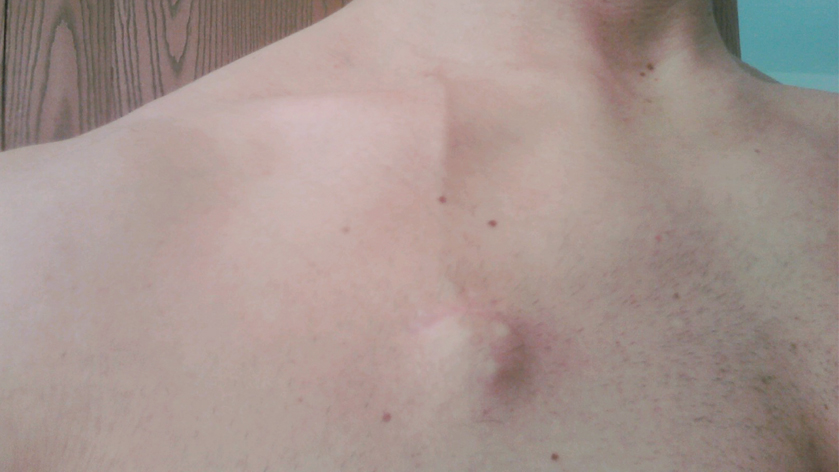
Что делать, если врач для успешного лечения считает необходимым постоянный доступ к вене, например, для введения лекарства? Неужели придется все время катать за собой капельницу на колесиках? К счастью, нет – именно для этих случаев существуют имплантируемые порт-системы. Благодаря им лечение проходит без осложнений, а пациент может вести практически тот же образ жизни, к которому привык. Но что же такое порт-системы, как они работают и в чем их преимущества перед другими методами лечения?
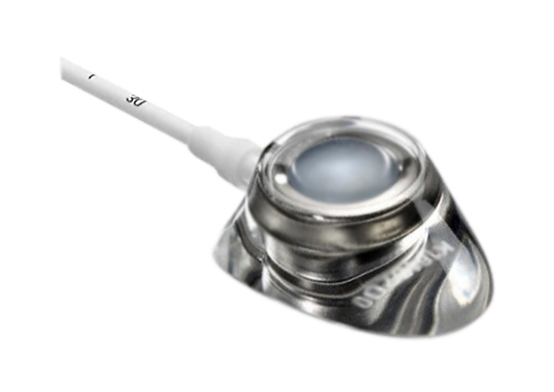
Имплантируемая порт-система – что это?
Несмотря на большое количество моделей от разных производителей, можно сказать, что в целом конструкция всех порт-систем одинакова:
Плюсы имплантируемых порт-систем
Установка и работа порт-системы
Порт-система устанавливается подкожно, под местной анестезией. Эта операция длится около 20-30 минут. Порт можно использовать по назначению после первых же минут по окончании имплантации.
Будет ли это лечение проходить одним этапом или курсами, которые разделены временными промежутками – неважно. Порт-система никак не будет беспокоить пациента.
4433842 Детская Порт-Система Celsite Epoxy (Babyport S)
Виды порт-систем
| Венозный доступ | |
  | |
| Показания | Место имплантация |
| Длительная химиотерапия | Верхняя часть груди |
| Длительная антибиотикотерапия | Внутренняя и внешняя яремная вена |
| Парентеральное питание | Подключичная вена |
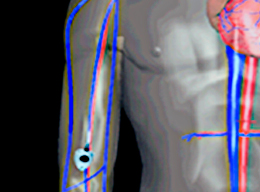
| Взятие проб крови на анализ | Плечо |
| Переливание крови | V. cephalica |
| V. basilica | |
| Нижняя часть тела | |
| Бедренная вена | |
| Артериальный доступ | |
 | |
| Показания | Место имплантация |
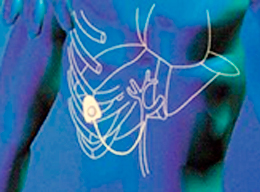
| Региональная химиотерапия опухолей печени | Нижняя часть груди |
| Печеночная артерия | |
| Перитонеальный и Плевральный доступы | |
 | |
| Показания | Место имплантация |
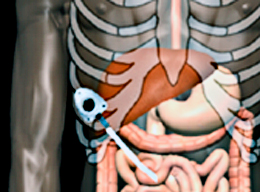
| Проведение региональной химиотерапии (например, при раке яичников) | Нижняя часть груди |
| Проведение дренирования злокачественных асцитов или плевритов | |
| Эпидуральный и Спинальный доступы | |
 | |
| Показания | Место имплантация |
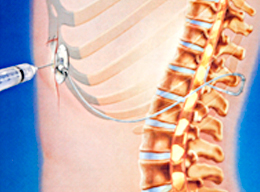
| Введение в спинальное или эпидуральное пространство обезболивающих препаратов | Нижняя часть груди |
Рекомендации по подбору порт-систем
| Показания | Возраст пациента | Модель порт-системы | ||||
| Химиотерапия Антибиотикотерапия | Взрослый | ST301 | ST301F | ST301P | ||
| ST201 | ST201F | ST201P | ||||
| Ребенок | ST305 | ST305P | ST205 | |||
| Парентеральное питание | Взрослый | ST301G | ST301H | ST201G | ST201H | |
| Ребенок | ST305H | ST305L | ||||
| Особые условия | Модель порт-системы | |||||
| Пациент: ребенок, истощенный взрослый | ST305 | ST205 | Babyport | |||
| Лучевая терапия в области груди | Brachial port | |||||
| Особые требования или пожелания врача к установке порта | Celsite Discreet | |||||
| Маленький ребенок | Babyport | ST205 | ||||
| Паллиативная помощь: болевой синдром | ST304 | |||||
| Паллиативная помощь: эвакуация жидкости при плевритах или асцитах | T203J | T203J-1 | ||||
| Регионарная химиотерапии артериальным доступом | T302 | Anthron | ||||
| Отсутствие Rg в операционной | Celsite ECG | |||||
В каких случаях применяются порт-системы?
Сфера их использования весьма широка:
Инструкция для медперсонала
Обязательные меры предосторожности, дабы избежать инфицирования:
Подготовка к использованию порт-системы:
Проверка работы порт-системы:
Тест на проходимость после установки иглы: к свободному концу иглы подсоединить шприц объемом 20 мл со стерильным физиологическим раствором. Затем потяните поршень на себя до появления в просвете шприца 1-2 мл венозной крови.
Важно! Если обратного тока крови нет, значит игла установлена неверно и ее следует заменить на новую.
При работе с порт-системой применяют только иглы Губера, т.к. обычные игры прокалывают мембрану, тогда как игла Губера лишь раздвигает ее поверхность без повреждений.
Если порт не используется более месяца, то рекомендуется регулярно его промывать: каждые 4-6 недель при использовании раствора гепарина.
Особенности работы с порт-системой при химиотерапии:
Выбор имплантируемой порт-системы
Подбирая порт-систему, лучше ориентироваться не на производителя, т.к. все они давно производят медицинскую технику и являются проверенными, надежными компаниями, а на рекомендации доктора. Кроме того, важно иметь в виду следующее:
Послеоперационное обезболивание. Часть 4. Современные средства обеспечения послеоперационной анальгезии
Основными задачами применения анальгетических средств в послеоперационном периоде являются: устранение страдания, причиняемого болью, создание психологического комфорта и повышение качества жизни пациентов в послеоперационном периоде; ускорение послеоперационной функциональной реабилитации; снижение частоты послеоперационных осложнений; сокращение сроков госпитализации и стоимости лечения.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека и осуществляется в соответствии с принятыми национальными и международными стандартами. В нашей стране во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Таблица 1. Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005).
Группа
Препараты
Дозы, путь введения
Неопиоидные анальгетики, НПВП
Диклофенак
Кетопрофен (Кетонал ®)
Кеторолак (Кеторол ®)
75 мг (150 мг суточная), в/м
50 мг (200 мг), в/м
30 мг (90 мг), в/м
Неопиоидные анальгетики, прочие
1 г (4 г), в/в инфузия в течение 15 минут
Опиоидные анальгетики, сильные
5-10 мг (50 мг), в/в, в/м
20 мг (160 мг), в/в, в/м
Опиоидные анальгетики, слабые
100 мг (400 мг), в/в, в/м
Лидокаин 2%
Бупивакаин (Маркаин®) 0, 25%, 0, 5%
Ропивакаин (Наропин®0, 2%, 0, 75%, 1%
(800 мг суточная) *
(400 мг суточная) *
(670 мг суточная) *
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в борьбе с ПБС:
— широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола; в различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%;
— ограничение использования опиоидных анальгетиков, особенно внутримышечного варианта их введения, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики;
— мультимодальный характер послеоперационного обезболивания, т. е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома.
Длительность проведения послеоперационного обезболивания является достаточно вариабельной величиной и зависит как от интенсивности болевой афферентации и, следовательно, от травматичности хирургического вмешателсьтва, так и от индивидуальной толерантности пациента к боли. Необходимость целенаправленного купирования ПБС возникает, как правило, в течение первых 4 суток послеоперационного периода (табл. 2).
Таблица 2. Потребность в обезболивании после различных по объему операций.
Хирургическое вмешательство
Продолжительность обезболивания, часы
Вмешательства на верхнем этаже брюшной полости и диафрагме
Вмешательства на нижнем этаже брюшной полости
Операции на тазобедренном суставе
Операции на конечностях
Лапароскопические операции среднего объема
Таблица 3. Методы и средства послеоперационного обезболивания.
1. Традиционное введение опиоидов: внутримышечные инъекции по требованию.
2. Опиоидные препараты агонисты/антагонисты:
а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия.
б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное
3. Неопиоидные анальгетики с системным введением:
а) нестероидные противоспалительные препараты
б) ацетаминофен (парацетамол)
4. Методы регионарной анестезии:
а) эпидуральное введение опиоидов;
б) нестероидные противовоспалительные препараты;
5. Нефармакологические методы:
6. Сочетанное использование представленных методов
Ниже приводятся основные используемые в современной хирургической клинике средства и методы обезболивания с позиций баланса их эффективности и безопасности.
Опиоидные анальгетики.
Данная группа лекарственных препаратов десятилетиями считалась средством выбора для купирования ПБС. Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
С точки зрения фармакодинамики опиоидные анальгетики являются агонистами или антагонистами различных видов опиоидных рецепторов ЦНС (мю-, дельта-, каппа-). Препараты опиоидной группы активируют эндогенную антиноцицептивную систему (центральная анальгезия), однако не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гиперальгезию. Попытки увеличения эффективности обезболивания и снижения частоты побочных эффектов опиоидных анальгетиков основаны на варьировании способов их введения (в том числе и у одного пациента): внутривенный, внутримышечный, эпидуральный, трансдермальный, сублингвальный, ректальный. Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Таблица 4. Опиоидные анальгетики при купировании послеоперационного болевого синдрома.
Препарат
Дозировка и пути введения
Относительная анальгетическая активность
Побочные эффекты
Возможны выраженные угнетение дыхания, тошнота, рвота, высокая степень привыкания и максимальный наркогенный потенциал
Угнетение дыхания, тошнота, рвота, высокая степень привыкания и наркогенный потенциал
Угнетение дыхания, тошнота, рвота, наличие привыкания и наркогенного потенциала
Необходимо отметить еще один важный аспект, ограничивающий применение опиоидных анальгетиков в отечественной клинической практике. Использование опиоидных анальгетиков для послеоперационного обезболивания в Российской Федерации строго регламентировано существующими приказами руководящих органов здравоозранения. Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов. По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Неопиоидные анальгетики.
Термином «неопиоидные анальгетики» обозначается группа различных по химическому строению, фармакодинамике и, соответственно, механизму обезболивания лекарственных препаратов, применяемых для купирования ПБС с парентеральным, реже пероральным путем введения. Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Таблица 5. Неопиоидные анальгетики для купирования послеоперационной боли.
Класс
Препараты
Особенности терапии
Побочные эффекты
Антагонисты NMDA-рецепторов
Применяется как адъювант при введении опиоидов.
Малые дозы кетамина характеризуются опиоидсберегающим эффектом, повышением качества обезболивания
При использовании в малых дозах – не выражены. Сохраняют побочные эффекты опиоидов.
Антиконвульсанты
Используется как адъювантный препарат в комплексной терапии острой послеоперационной боли. Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках.
Головокружение, сонливость, периферические отеки.
Ингибиторы протеаз
Ингибирование синтеза медиаторов боли на этапе трансдукции, используются как средство адъювантной терапии ПБС
Нерушения в системе гемостаза (гипокоагуляция) – послеоперационные кровотечения.
Центральные α-адреномиметики
Воздействие на трансмиссию и модуляцию боли. Адъювант при опиоидной анальгезии.
Гипотензия, брадикардия, психические нарушения.
Бензодиазепины
Комбинированная терапия с применением феназепама и тизанидина снижает выраженность фантомных болей.
Сонливость, головокружение, психические расстройства
Из приведенных данных становится очевидным, что перечисленные в таблице неопиоидные анальгетики используются лишь как возможное дополнение к базисной терапии опиоидами, использование данных препаратов для купирования ПБС в моноварианте не практикуется.
Формально к группе неопиоидных анальгетиков относятся также нестероидные противовоспалительные препараты (НПВП) и ацетаминофен (парацетамол). Однако вследствие значительной востребованности в современной хирургической клинике данные препараты рассматриваются сейчас как отдельные подклассы средств для купирования ПБС.
Парацетамол.
Несмотря на то, что ацетаминофен (парацетамол) имеет более чем полувековую историю применения в качестве анальгетика и антипиретика, точный механизм действия этого препарата до сих пор не известен. Предполагается наличие центрального механизма действия парацетамола, включающего: подавление активности циклооксигеназы 2 типа в ЦНС, с чем связана профилактика развития вторичной гиперальгезии; подавление активности циклооксигеназы 3 типа, существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу; усиление активности нисходящих тормозных серотонинергических путей на этапе модуляции боли.
Потенциально опасным побочным свойством парацетамола является гепатотоксическое и нефротоксическое действие, которое может проявляться при превышении дозы 4 г/сут, особенно при наличии у пациента исходного нарушения функции печени и почек. Ограничениями к применению парацетамола являются: печеночно-клеточная недостаточность с лабораторными проявлениями (повышение уровня трансаминаз), почечная недостаточность, алкоголизм, алиментарная недостаточность, дегидратация.
Местные анестетики.
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной и местной анальгезии. Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В ходе данной процедуры в эпидуральное пространство на уровне грудного или поясничного отделов позвоночника устанавливается катетер, через который болюсно или путем непрерывной инфузии вводятся местные анестетики. Эпидуральная анестезия является как средством обеспечения анальгезии в ходе операции (в том числе и в моноварианте), так и средством купирования ПБС. Многочисленными исследованиями была доказана принципиально более высокая эффективность продленной послеоперационной эпидуральной анальгезии по сравнению с системным введением опиоидных анальгетиков. Как указывалось выше сами опиоидные анальгетики также могут быть использованы для проведения эпидуральной анестезии. Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Помимо собственно анальгетического эффекта позитивное влияние прослеоперационной продленной эпидуральной анальгезии заключается в прерывании нисходящих симпатических эфферентных импульсов, следствием чего являются улучшение висцерального кровотока (активизация репаративных процессов в зоне вмешательства), повышение активности парасимпатической нервной системы (разрешение пареза пищеварительной трубки).
С точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005) преимущества продленной эпидуралной анальгезии включают: более высокое качество обезболивания в сравнении с парентеральным введением опиоидов; улучшение показателей газообмена и снижение частоты послеоперационных легочных осложнений по сравнению с опиоидной анальгезией; ускорение восстановления функции желудочно-кишечного тракта после абдоминальных операций и снижение частоты местных осложнений.
Тем не менее и у эпидуральной анестезии есть ряд существенных ограничений. Сама по себе эпидуральная анестезия является сложной инвазивной процедурой, потенциально опасной в плане развития как местных (инфекционный процесс, повреждение нервных корешков, сосудов паутинной оболочки, твердой мозговой оболочки), так и системных осложнений (депрессия дыхания, кардиотоксические эффекты, артериальная гипотензия). В этой связи проведение эпидуральной анестезии требует наличия специальных навыков у врача-анестезиолога и постоянного мониторинга состояния пациента в отделении интенсивной терапии, реже – в хирургическом отделении.
В последние годы все большую популярность получает методика длительной инфузии местных анестетиков в полость операционной раны. В ходе ряда исследований было показано, что длительная инфузия местных анестетиков в течение 24-48 часов через катетер, установленный в ране, способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках. Работами отечественных авторов показано, что пролонгированная местная анестезия операционной раны за счет резорбции местного анестетика и присутствия его в плазме в низких концентрациях способна оказывать системный противовоспалительный эффект. Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Мультимодальная периоперационная анальгезия.
Из приведенных выше характеристик и, что важнее, недостатков средств и методов купирования ПБС следует очевидное заключение о том, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Однако приблизиться к решению проблемы адекватности послеоперационного обезболивания вполне возможно, реализуя в клинике концепцию мультимодальной периоперационной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимизации побочных эффектов до, во время и после хирургического вмешательства (см. рис. ).
Таблица 6. Варианты схем мультимодальной периоперационной анальгезии, ориентированных на травматичность хирургических вмешательств.
 Читайте также:
Читайте также: