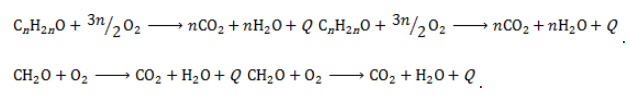в чем разница между альдегидами и кетонами
Х и м и я
Органическая химия
Альдегиды и кетоны.
Альдегиды и кетоны имеют схожее химическое строение. Поэтому рассказ о них объединён в одной главе.
В строении обоих соединений прсутствует двухвалентная карбонильная группа:
Отличие альдегидов и кетонов следующее. В альдегидах карбонильная группа связана с одним атомом водорода и с углеводородным радикалом, в то время как в кетонах она связана с двумя углеводородными радикалами.
Химические свойства альдегидов и кетонов.
Наличие и в альдегидах и в кетонах карбонильной группы обуславливает определённое сходство их свойств. Однако имеются и различия. Это различие объясняется присутствием в молекуле альдегида атома водорода, связанного с карбонильной группой. (В молекуле кетонов подобный атом отсутствует).
Карбонильная группа и связанный с ней атом водорода, выделены в отдельную функциональную группу. Эта группа получила название альдегидной функциональной группы.
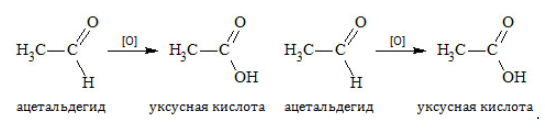
За счёт присутствия водорода в молекуле альдегида, последние легко окисляются (присоединяют кислород) и превращаются в карбоновые кислоты.
Например, при окислении уксусного альдегида образуется уксусная кислота:
Вследствии лёгкой окисляемости альдегиды являются энергичными восстановителями. Этим они существенно отличаются от кетонов, которые окисляются значительно труднее.
Получение альдегидов и кетонов.
Альдегиды и кетоны можно получить окислением соответствующих спиртов, имеющих тот же углеродный скелет и гидроксил при том же атоме углерода, который в получаемом альдегиде или кетоне образует карбонильную группу.
Если в качестве окисляемого спирта используется первичный спирт, то в результате окисления получится альдегид.
Муравьиный альдегид (формальдегид).
Формальдегид – это простейший альдегид с формулой:
Получают формальдегид из метилового спирта – простейшего из спиртов.
В формальдегиде в качестве радикала выступает атом водорода.
Формальдегид – это газ с резким неприятным запахом, хорошо растворимый в воде. Обладает антисептическими, а также дубящими свойствами.
Получают формальдегид из метилового спирта путём каталитического окисления его кислородом воздуха или путём дегидрирования (отщеплением водорода).
Водный раствор формальдегида (обычно 40%) называется формалином. Формалин широко прменяется для дизинфекции, консервирования анатомических препаратов. Значительные количества формальдегида используются для получения фенолформальдегидных смол.
Уксусный альдегид (ацетальдегид).
Это один из наиболее важных альдегидов. Он соответствует этиловому спирту и может быть получен его окислением.
Уксусный альдегид широко встречается в природе и производится в больших количествах индустриально. Он присутствует в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма.
Уксусный альдегид – легко кипящая бесцветная жидкость (температура кипения 21 градуса С). Имеет характерный запах прелых яблок, хорошо растворим в воде.
В прмышленности уксусный альдегид получается:
Применяют уксусный альдегид для получения уксусной кислоты, бутадиена, некоторых органических веществ, альдегидных полимеров.
Диметилкетон (ацетон).
Диметилкетон (ацетон) является простейшим кетоном. В его молекуле роль углеводородных радикалов выполняет метил СН3 (остаток метана).
Ацетон – бесцветная жидкость с характерным запахом.
Температура кипения 56,2 градуса С.
Ацетон смешивается с водой во всех соотношениях.
Является одним из метаболитов, производимых человеческим организмом.
Ацетон – очень хороший растворитель многих органических веществ. Широко применяется в лакокрасочной промышленности, в производстве некоторых видов искусственного волокна, небъющегося органического стекла, киноплёнки, бездымного пороха. Ацетон также используется как исходное вещество для синтеза ряда органических соединений.
Изомерия, строение и гомологический ряд альдегидов и кетонов
К кислородсодержащим производным углеводородов, содержащим в молекуле функциональную группу 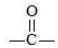
Строение альдегидов и кетонов
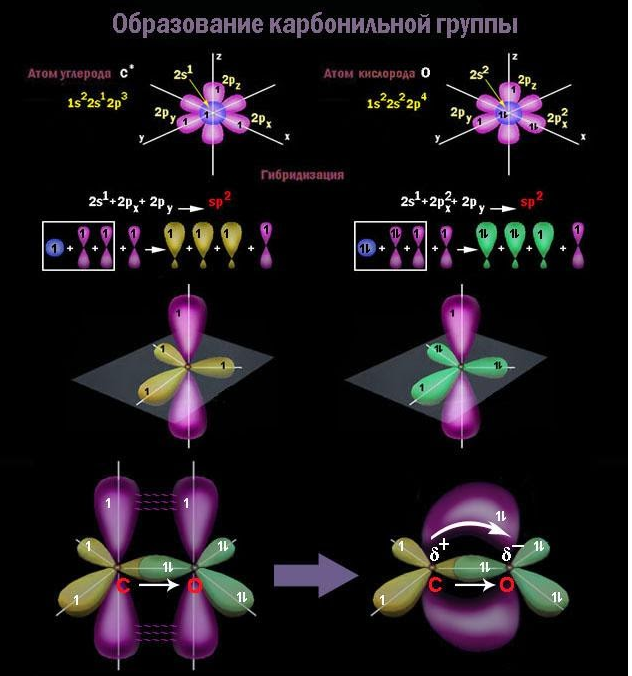
Определяющий элемент структуры производных углеводородов – функциональная группа атомов. Она служит критерием для отнесения соединения к тому или иному классу органических веществ.
Карбонильная группа
Группа 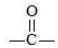
В карбонильной группе атом углерода затрачивает на 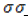

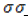

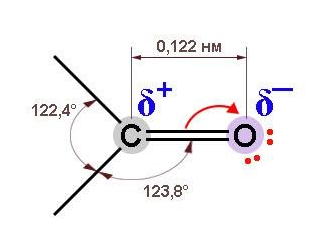
Благодаря высокой электроотрицательности кислород оттягивает в свою сторону электронную плотность по обоим компонентам двойной связи, и она оказывается сильно поляризованной. За счет 
На диполе C=O кислород обладает частичным отрицательным, а углерод – положительным зарядом. Это приводит к поляризации связей С-O у соседнего с карбонилом углеродного атома (отрицательный индуктивный, или I-эффект) и оказывает влияние на химические свойства.
Общая структура молекул альдегидов и кетонов
Состав карбонильных соединений описывается общей формулой 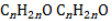
В альдегидах одна из свободных валентностей углерода группы 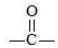
Номенклатура
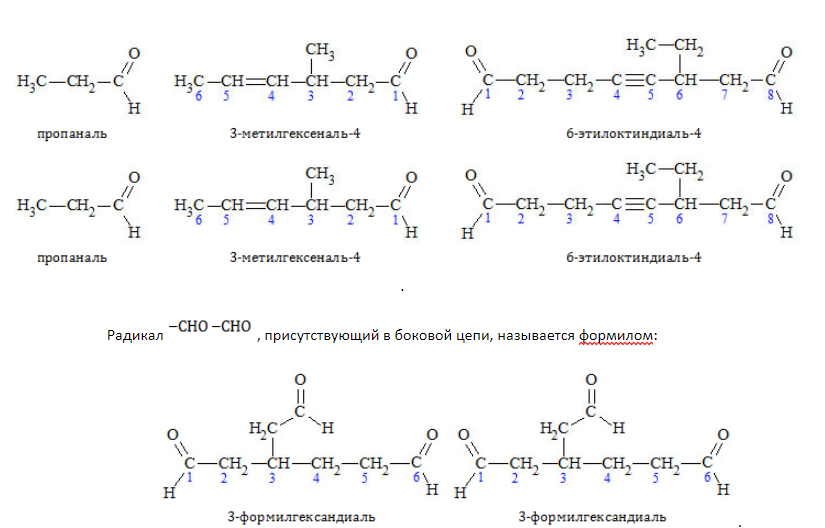
Наименования альдегидов строятся путем прибавления суффикса «-аль» либо «-диаль» к названию углеводорода, представляющего алкильный остаток. Нумерацию цепи начинают от углеродного атома, входящего в состав карбонила, но в наименовании локант «1» не указывается:
Наименования кетонов составляются путем добавления суффикса «-он» либо «-дион» к названию образующего главную цепочку углеводорода:
Гомологические ряды альдегидов и кетонов
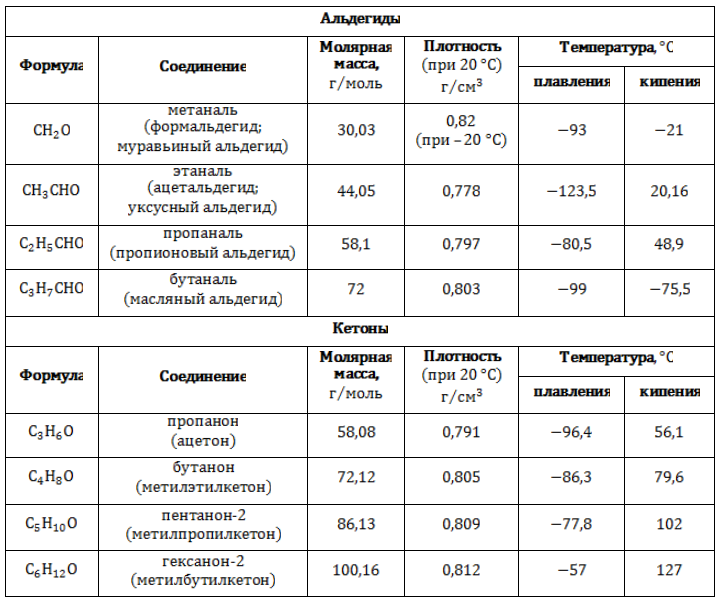
Ряды, образуемые насыщенными карбонильными соединениями, представлены в таблице:
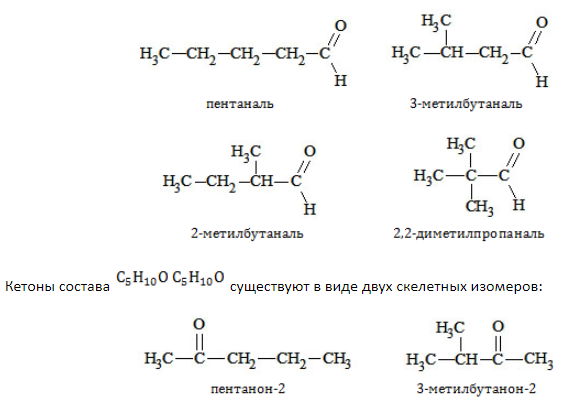
Изомерия кетонов и альдегидов
Соединения состава 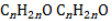
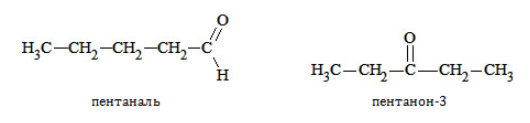
Позиция функциональной группы
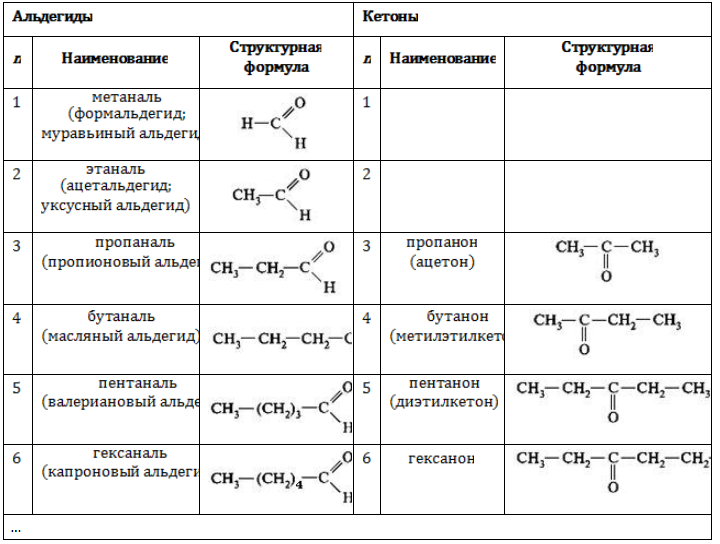
Изомерия данного типа свойственна кетонам с 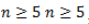
Строение углеродного скелета
Изомерия по отсутствию либо наличию и характеру ветвления углеродной цепи свойственна всем карбонильным соединениям: альдегидам с 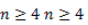
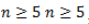
Например, альдегиды состава 
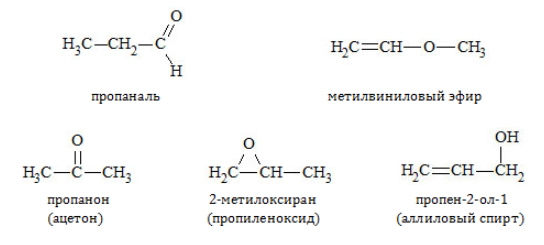
Межклассовая изомерия
Из единой для двух классов соединений общей формулы следует, что альдегиды и кетоны одинакового атомного состава – взаимные изомеры:
Кроме того, они обладают межклассовой изомерией с такими соединениями, как:
Физические свойства
Формальдегид и уксусный альдегид в стандартных условиях – токсичные газы с резким запахом. Альдегиды и кетоны с C3 по C12– жидкости.
Поскольку в группе 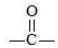
Химические свойства
Химические свойства альдегидов и кетонов определяются в первую очередь группой 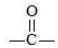
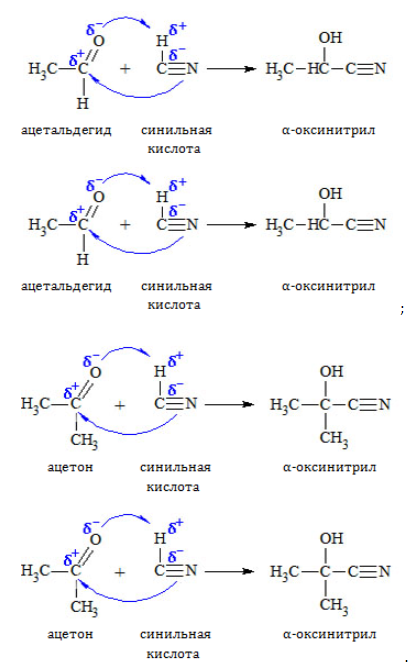
1. Присоединение к карбонилу по месту двойной связи
Синильная кислота присоединяются по нуклеофильному механизму:
Аналогично протекают реакции присоединения солей и спиртов.
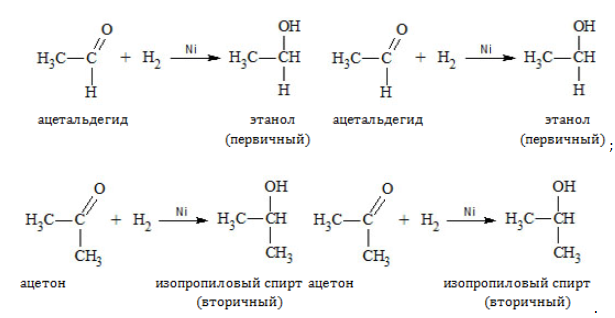
При восстановлении (гидрировании) присоединение водорода идет на катализаторе:
2. Окисление
К действию окислителей альдегиды и кетоны относятся различно. Альдегиды охотно вступают в реакцию и в мягких условиях благодаря наличию водорода при карбонильной группе, которая окисляется до карбоксильной. Продукт реакции – кислота:
Альдегиды дают качественные реакции при окислении свежеприготовленным гидроксидом меди или реактивом Толленса (оксид серебра в аммиачном растворе):
Кетоны ведут себя подобно третичным спиртам и не реагируют со слабыми окислителями. Под действием сильных окислителей происходит распад молекулы кетона.
Карбонильные соединения горят с выделением тепла по схеме:
3. Реакции в алкильном радикале
Карбонил оказывает влияние на реакционную активность углеводородного остатка, сообщая особую подвижность водородным атомам, стоящим при α-расположенном (соседнем с группой 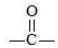
Получение альдегидов и кетонов
Применение карбонильных соединений
Благодаря высокой реакционной активности соединения, содержащие карбонил, широко используются в различных сферах.
Формальдегид лидирует по объемам мирового производства. Он применяется в фармацевтике, производстве полиуретанов, смол, взрывчатых веществ. Используется в качестве консерванта биопрепаратов и в сельском хозяйстве для обработки зерна.
Уксусный альдегид – основа для получения этанола, уксусной кислоты, бутадиена и других востребованных промышленностью веществ.
Альдегиды играют значительную роль в синтезе спиртов и карбоновых кислот, душистых веществ и антиоксидантов.
Ацетон – один из самых распространенных органических растворителей, компонент лаков, красок, клеев. Используется в производстве различных реактивов.
Бутанон (метилэтилкетон) и другие низшие кетоны также являются эффективными растворителями и находят применение в химической промышленности, например, в производстве полимерных материалов.
Разница между альдегидом и кетоном
Главное отличие
Основное различие между альдегидом и кетоном состоит в том, что карбонильная группа альдегида присоединена к алкильной группе с одной стороны и к атому H с другой стороны, тогда как карбонильная группа кетона присоединена к двум алкильным группам с обеих сторон.
Альдегид против кетона
Название альдегида ИЮПАК оканчивается суффиксом «аль»; с другой стороны, название кетона по ИЮПАК оканчивается суффиксом «один». Альдегид всегда присутствует на конце углеродной цепи; напротив, кетон обычно присутствует в середине цепи.
Альдегид естественным образом содержится в летучих соединениях, например ароматических соединениях; С другой стороны, кетон естественным образом содержится в сахаре. Альдегиды, которые присутствуют в сахарах, представляют собой альдегидные сахара и известны как альдозы; и наоборот, кетон, который присутствует в сахаре, в целом известен как кетоз.
Сравнительная таблица
| Альдегид | Кетон |
| Альдегид — это органическое соединение, карбонильная группа которого связана с алкильной группой с одной стороны и с водородом с другой стороны. | Кетон — это органическое соединение, карбонильная группа которого присоединена к двум алкильным группам с одной или с обеих сторон. |
| Химическая структура | |
| Содержит общую химическую формулу R-CHO | Содержит общую химическую формулу R-CO-R |
| Реактивность | |
| Более реакционноспособен по сравнению с кетонами | Менее реакционноспособен, чем альдегид |
| Окисление | |
| Происходит окисление с образованием карбоновых кислот. | нельзя окислить без разрыва углеродной цепи |
| Номенклатура ИЮПАК | |
| Название ИЮПАК оканчивается суффиксом «al». | Название ИЮПАК оканчивается суффиксом «один». |
| Расположение карбонильной группы | |
| Всегда присутствует в конце углеродной цепи | Обычно присутствует в середине цепочки |
| Естественное происхождение | |
| Естественно содержится в летучих соединениях, например, в ароматических соединениях. | Естественно содержится в сахаре |
| Альдозы / Кетоз | |
| В сахаре присутствуют альдегидные сахара, известные как альдозы. | Присутствующие в сахаре в целом известны как кетоз. |
Что такое альдегид?
Альдегидные группы находятся на конце углеродной цепи. Следовательно, если карбонильная группа присутствует на конце углеродной цепи, это означает, что это альдегид. Поскольку альдегиды образуют ацетальдегид и формальдегид, они являются чрезвычайно полезными химическими соединениями в промышленности.
Альдегид считается более реактивным, чем кетон, потому что он показывает разные результаты в сочетании с химическими реагентами. Альдегид подвергается окислению и дает карбоновую кислоту, которая может восстанавливаться с образованием спирта.
В зависимости от природы углеродной цепи, к которой присоединен альдегид, выполняются многие другие многочисленные функции. Согласно названиям IUPAC, при именовании альдегидов альдегиды всегда заканчиваются суффиксом «al». поэтому названия альдегидов соответствующей алкильной группы: бутаналь, пропаналь, гексаналь и т. д.
Альдегид можно отличить от кетона с помощью нескольких лабораторных тестов, таких как тест Шиффа, тест Толлена и тест Фелинга — один из самых известных тестов на альдегид. Например, во время теста Фелинга кетон не проявляет никакой реакции, в то время как альдегид образует красный осадок.
Альдегиды считают более электрофильными, потому что они не состоят из электрона, дающего эффект алкильной группы. Кроме того, альдегиды создают много проблем при их синтезе. Что касается их некислотного протона, альдегиды трудно удалить для замещения.
Что такое кетон?
Кетон можно объяснить его химической формулой R-CO-R ‘, в которой атом C присоединен к атому кислорода через двойную связь. Поскольку карбонильная группа кетонов окружена алкильными группами, которые могут быть алифатическими, олефиновыми или ароматическими с обеих сторон, или, возможно, один конец содержит бензольные кольца, кетон никогда не доступен на конце углеродной цепи.
Кетоны считаются менее реактивными, чем альдегиды, потому что они обычно не дают никакой реакции. Хотя кетоны в основном используются в качестве промышленных растворителей, таких как ацетон, кетоны не могут подвергаться дальнейшему окислению, потому что они уже присутствуют в самой высокой форме окисления, но они могут проходить реакции восстановления с образованием соответствующих спиртов.
Кетоны очень легко узнать по их названиям IUPAC, в которых кетон оканчивается суффиксом «один». Например, гексанон, пентанон, бутанон и т. Д. Кетоны содержат двойные связи повсюду в цепи, кроме конца, поэтому можно найти кетон в середине цепи, в котором двойная связь кислорода будет присоединяться к одному из атомов углерода. атомы.
Кетоны естественным образом содержатся в сахарах, в которых они известны как кетозы. Кетоны можно отличить с помощью некоторых лабораторных тестов, которые проводятся с использованием реактива Толлена, который изготовлен с использованием нитрата серебра и некоторого количества гидроксида натрия и небольшого количества разбавленного аммиака, которые действуют как окислитель.
Когда реагент Толлена добавить к кетону, результатов не найдешь. Но если тот же раствор добавить к альдегиду, он будет осаждаться из серебра, потому что альдегид окисляется до карбоновой кислоты, а кетон не может. Эта реакция кажется очень красивой, если все сделано правильно, потому что емкость превратится в серебристую.
Ключевые отличия
Заключение
Из приведенного выше обсуждения делается вывод, что и альдегид, и кетон содержат карбонильные группы. Разница между ними в том, что альдегид содержит алкил и атом водорода, а кетон содержит две алкильные группы с обеих сторон.