в чем растворяются электролиты
Что такое электролит
Вещества, в которых электрический ток обусловлен движением ионов, то есть ионной проводимостью, называются электролитами. Электролиты относятся к проводникам второго рода, поскольку ток в них связан с химическими процессами, а не просто с движением электронов, как например в металлах.
В зависимости от вида ионов, на которые распадается вещество при растворении в воде, можно выделить электролиты без ионов Н+ и ОН- (солевые электролиты), электролиты с обилием ионов Н+ (кислоты) и электролиты с преобладанием ионов ОН- (основания).
Если при диссоциации молекул электролита образуется равное число положительных и отрицательных ионов, такой электролит называется симметричным. Или же несимметричным, если количество положительных и отрицательных ионов в растворе не одинаково. Примеры симметричных электролитов — KCL-1,1-валентный электролит и CaSO4 – 2,2-валентный электролит. Представителем несимметричного электролита является, например, H2SO4 – 1,2-валентный электролит.
Все электролиты можно условно разделить на сильные и слабые, в зависимости от их способности к диссоциации. Сильные электролиты в разбавленных растворах почти полностью распадаются на ионы. К ним относится большое количество неорганических солей, некоторые кислоты и основания в водных растворах или растворителях с высокой диссоциирующей способностью, таких как спирты, кетоны или амиды.
Слабые электролиты распадаются лишь частично, и пребывают в динамическом равновесии с недиссоциированными молекулами. К ним относится большое количество органических кислот, а также многие основания в растворителях.
Степень диссоциации зависит от нескольких факторов: от температуры, от концентрации, от вида растворителя. Так, один и тот же электролит при разной температуре или при одинаковой температуре, но в разных растворителях, будет диссоциирован в разной степени.
Поскольку электролитическая диссоциация по определению порождает большее количество частиц в растворе, это приводит к значительным различиям в физических свойствах растворов электролитов и веществ иного рода: увеличивается осмотическое давление, изменяется температура замерзания по отношению к чистому растворителю и т. д.
Часто ионы электролита участвуют в электрохимических процессах и химических реакциях как самостоятельные кинетические единицы, независимо от других присутствующих в растворе ионов: на электродах, погруженных в электролит, при прохождении через электролит тока, протекают окислительно-восстановительные реакции, продукты которых добавляются в состав электролита.
Таким образом, электролиты — это сложные системы веществ, включающие в себя ионы, молекулы растворителя, недиссоциированные молекулы растворенного вещества, ионные пары и более крупные соединения. И свойства электролитов определяются поэтому целым рядом факторов: характером ион-молекулярных и ион-ионных взаимодействий, изменением структуры растворителя при наличии растворенных частиц и т. д.
Ионы и молекулы полярных электролитов очень активно взаимодействуют друг с другом, что приводит к формированию сольватных структур, роль которых становится значительнее с уменьшением размеров ионов и с ростом их валентностей. Энергия сольватации является мерой взаимодействия ионов электролита с молекулами растворителя.
Электролиты, в зависимости от их концентрации, бывают: разбавленными растворами, переходными и концентрированными. Разбавленные растворы близки по структуре к чистому растворителю, но присутствующие ионы нарушают эту структуру своим влиянием. Такие слабые растворы сильных электролитов отличаются от идеальных растворов по свойствам в силу электростатического взаимодействия между ионами.
Переходная область концентрации характеризуется значительным изменением структуры растворителя из-за влияния ионов. При еще более высокой концентрации большинство молекул растворителя участвуют в сольватационных структурах с ионами, создавая таким образом дефицит растворителя.
Концентрированный же раствор имеет структуру близкую к ионному расплаву или кристаллосольвату, отличающуюся высокой упорядоченностью и единообразием ионных структур. Такие ионные структуры связываются друг с другом и с молекулами воды в ходе сложных взаимодействий.
Для электролитов характерны высокотемпературная и низкотемпературная области их свойств, а также области высоких и нормальных давлений. С ростом давления или температуры снижается молярная упорядоченность растворителя, слабеет влияние ассоциативных и сольватационных эффектов на свойства раствора. А когда температура падает ниже температуры плавления — некоторые электролиты переходят в стеклообразное состояние. Примером такого электролита может служить водный раствор LiCl.
Сегодня электролиты играют особую важную роль в мире техники и биологии. В биологических процессах электролиты выступают средой неорганического и органического синтеза, а в технике — основой электрохимических производств.
Электролиз, электрокатализ, коррозия металлов, электрокристаллизация — данные явления занимают важные места во многих современных производствах, особенно применительно к энергетике и защите окружающей среды.
Электрохимия. Свойства электролитов. Электролиз
Свойства электролитов
Для объяснения этих особых свойств растворов электролитов в 1887 г. шведский химик С.Аррениус (1859-1927) предложил Теорию электролитической диссоциации. Ее основные положения.
1. При растворении в воде молекулы кислот, оснований и солей диссоциируют на ионы:
Причину, почему молекулы электролитов распадаются на ионы, С.Арренус не рассматривал.
2. Диссоциация молекул на ионы у слабых электролитов является неполной. Поэтому следует ввести понятие «степень диссоциации» (a) и определять его, как долю молекул, распавшихся на ионы. Тогда 1-a будет характеризовать долю молекул нераспавшихся на ионы. Рассмотрим диссоциацию уксусной кислоты:
На основании Закона действующих масс
Логарифм концентрации ионов водорода, взятый с обратным знаком, называется pH раствора:
Сила электролита определяется степенью его диссоциации на ионы:
если в 0.1 М растворе a > 30 %, то электролит называют сильным;
Если соль образована слабым основанием и сильной кислотой, то ее pH
ЭЛЕКТРОЛИТЫ
Полезное
Смотреть что такое «ЭЛЕКТРОЛИТЫ» в других словарях:
ЭЛЕКТРОЛИТЫ — в широком смысле жидкие или твёрдые в ва и системы, в к рых присутствуют в заметной концентрации ионы, обусловливающие прохождение по ним электрич. тока (ионную проводимость); в узком смысле в ва, распадающиеся в р ре на ионы. При растворении Э.… … Физическая энциклопедия
ЭЛЕКТРОЛИТЫ — ЭЛЕКТРОЛИТЫ, жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. В узком смысле химические соединения, которые в растворах распадаются на ионы вследствие электролитической диссоциации.… … Современная энциклопедия
ЭЛЕКТРОЛИТЫ — вещества, разлагающиеся под влиянием гальванич. тока. Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ЭЛЕКТРОЛИТЫ тело, разлагаемое химически на составные простые посредством электрического тока, т. е. над которым… … Словарь иностранных слов русского языка
Электролиты — ЭЛЕКТРОЛИТЫ, жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. В узком смысле химические соединения, которые в растворах распадаются на ионы вследствие электролитической диссоциации.… … Иллюстрированный энциклопедический словарь
ЭЛЕКТРОЛИТЫ — водные и другие растворы щелочей, кислот и солей, проводящие электр. ток. Э. наз. проводниками второго рода, т. к. они резко отличаются от металлов (проводников первого рода). Электр. ток, проходя по проводникам первого рода, не производит… … Технический железнодорожный словарь
электролиты — – системы, обладающие в жидком или твердом состоянии ионной проводимостью. Словарь по аналитической химии [3] … Химические термины
Электролиты — – соли и др. химические вещества, растворы которых проводят электрический ток из за наличия ионов, образующихся в результате электролитической диссоциации. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ … Энциклопедия терминов, определений и пояснений строительных материалов
Электролиты — Электролит химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты проводники второго рода,… … Википедия
Электролиты — [electrolytes] жидкие или твердые вещества, в которых в результате электролитической диссоциации образуются в сколько нибудь заметной концентрации ионы, обусловливающие прохождение постоянного электрического тока. Электролиты в растворах… … Энциклопедический словарь по металлургии
В чем растворяются электролиты
Данный урок посвящен изучению темы «Электролитическая диссоциация». В процессе изучения этой темы Вы поймете суть некоторых удивительных фактов: почему растворы кислот, солей и щелочей проводят электрический ток; почему температура кипения раствора электролита выше по сравнению с раствором неэлектролита.
I. Понятие электролитическая диссоциация
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
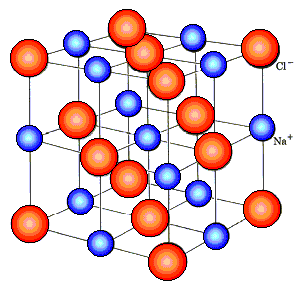
Рис. 1. Схема распада на ионы хлорида натрия
Пронаблюдайте за следующим экспериментом: “Изучение электрической проводимости веществ”
II. Сущность процесса электролитической диссоциации. Теория ЭД
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современные положения теории электролитической диссоциации
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
2. В растворах и расплавах электролиты проводят электрический ток.
Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток
Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток
Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания
Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью
В растворах и расплавах образуются ионы
В растворах и расплавах не образуются ионы
III. Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1. Молекула воды полярна и представляет собой диполь
Растворение в воде веществ с ионной химической связью
(на примере хлорида натрия – поваренной соли)
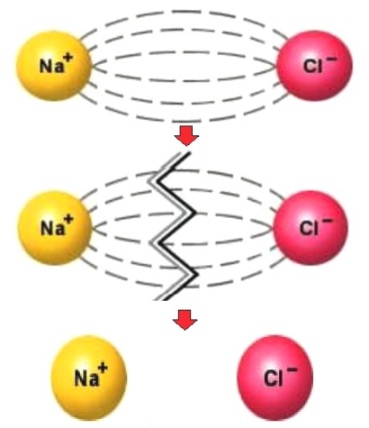
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде (рис. 2) состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na + и Сl – из кристалла в раствор происходит образование гидратов этих ионов.
Рис. 2. Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na + ; б – гидратация (окружение молекулами воды) ионов Na + и Сl –
Растворение в воде веществ с ковалентной сильнополярной химической связью
(на примере соляной кислоты)
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными (рис.3).
Рис. 3. Диссоциация молекул HCl на ионы в водном растворе
Основные положения:
Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении.
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов, обладающие положительным ( катионы ) или отрицательным ( анионы ) зарядом.
Ионы отличаются от атомов как по строению, так и по свойствам
Пример 1. Сравним свойства молекулярного водорода (состоит из двух нейтральных атомов водорода) со свойствами иона.
Пример 2. Сравним свойства атомарного и молекулярного хлора со свойствами иона.
+17Cl 0 1s 2 2s 2 2p 6 3s 2 3p 5
Атомы хлора имеют незавершённый внешний уровень, поэтому они химически очень активны, принимают электроны и восстанавливаются.
Именно поэтому газообразный хлор ядовит, при вдыхании его наступает отравление организма.
Ионы хлора имеют завершённый внешний уровень, поэтому они химически неактивны, находятся в устойчивом электронном состоянии.
Ионы хлора входят в состав поваренной соли, употребление в пищу которой не вызывает отравления организма.
1. Ионы отличаются от атомов и молекул по строению и свойствам;
2. Общий и характерный признак ионов – наличие электрических зарядов;
3. Растворы и расплавы электролитов проводят электрический ток из-за наличия в них ионов.
IV. Тренажеры
ЦОРы
Памятка (электролиты и неэлектролиты)
ЭЛЕКТРОЛИТЫ
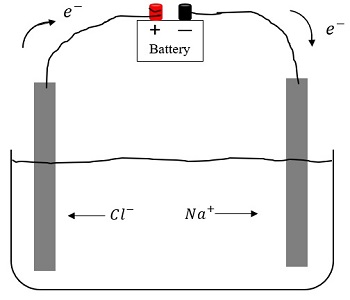
ЭЛЕКТРОЛИТЫ, вещества, обладающие ионной проводимостью; их называют проводниками второго рода – прохождение тока через них сопровождается переносом вещества. К электролитам относятся расплавы солей, оксидов или гидроксидов, а также (что встречается значительно чаще) растворы солей, кислот или оснований в полярных растворителях, например в воде. Известны и твердые электролиты. Чтобы пропустить электрический ток через раствор электролита, в него опускают две металлические или угольные пластины – электроды – и соединяют их с полюсами источника постоянного тока. Положительный электрод называют анодом, отрицательный – катодом. Прохождение тока через электролит сопровождается химическими реакциями на электродах. Так, на катоде, погруженном в расплав соли или оксида либо в раствор соли, обычно осаждается металл, входящий в состав электролита. На катоде, погруженном в водный раствор кислоты, основания либо соли щелочного или щелочноземельного металла, выделяется газообразный водород. На аноде, изготовленном из инертного материала, например платины или угля, в водном растворе выделяется газообразный кислород, а в концентрированных водных растворах хлоридов или в расплавленных хлоридах – хлор. Цинковые, медные или кадмиевые аноды под действием электрического тока сами постепенно растворяются; газ в этом случае не образуется.
ЭЛЕКТРОЛИЗ
Законы Фарадея.
Электролизом называют химические процессы, протекающие под действием электрического тока на электродах, погруженных в электролит. Количество образовавшегося вещества связано с количеством электричества, пропущенного через электролит (сила тока ґ время), законами Фарадея: 1) количество вещества, образовавшегося на электроде при пропускании через электролит постоянного электрического тока, прямо пропорционально количеству пропущенного электричества, т.е. силе тока и времени электролиза; 2) для разных электродных процессов при одинаковом количестве электричества, пропущенного через электролит, массы образовавшихся веществ пропорциональны их химическим эквивалентам. (Эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях, а эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с 1 экв. водорода или любого другого вещества. См. ЭКВИВАЛЕНТНАЯ МАССА.)
Законы Фарадея справедливы как для растворов, так и для расплавов и применимы к обоим электродам. Количество электричества, необходимое для образования 1 экв. любого вещества, одинаково для всех веществ; оно равно 96 485 Кл и называется числом Фарадея или постоянной Фарадея (фундаментальная физическая константа). Эта закономерность широко применяется на практике. Исходя из количества затраченного электричества, можно рассчитать массу или толщину металлического покрытия, образующегося при гальваностегии, и наоборот, задав толщину покрытия, можно оценить, какое количество электричества для этого потребуется. Законы Фарадея лежат в основе работы вольтметра и приборов, предназначенных для измерения силы постоянного тока. См. также ЭЛЕКТРИЧЕСКИЕ ИЗМЕРЕНИЯ; ЭЛЕКТРОХИМИЯ.
В 1833 М.Фарадей предположил, что ток через электролит переносят электрически заряженные частицы – ионы. Положительно заряженные ионы (например, ионы металлов и водорода), движущиеся через электролит по направлению к катоду, были названы катионами, а отрицательно заряженные, перемещающиеся к аноду, – анионами. Предполагалось, что на электродах ионы теряют заряд, при этом на катоде из катионов образуются атомы металла или водорода, а на аноде из анионов – галогены или кислород.
Эти представления – с незначительными изменениями – считаются справедливыми и сегодня. Положительным ионом (катионом) называют атом или группу атомов, утративших один или несколько электронов, а отрицательным ионом (анионом) – атом или группу атомов с одним или более избыточным электроном. На катоде катионы электролита приобретают недостающие электроны и нейтрализуют свой положительный заряд. Аналогично анионы отдают избыточные электроны, достигая анода. Если материал анода реакционноспособен, он может сам служить источником электронов, поскольку его атомы отдают электроны легче, чем анионы. Образующиеся катионы переходят при этом в раствор.
ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ
Теория Аррениуса.
Константа диссоциации.
ТЕОРИЯ МЕЖИОННОГО ВЗАИМОДЕЙСТВИЯ
Согласно современным представлениям, основанным на теории валентности и данных по рентгеноструктурному анализу кристаллов, большинство солей ионизировано уже в твердом состоянии; при этом положительные и отрицательные ионы удерживаются вместе электростатическими силами. Когда соль растворяется (например, в воде), ионы притягивают к себе молекулы растворителя – сольватируются (или гидратируются, если растворитель – вода). Выделяющейся в процессе сольватации энергии достаточно для преодоления электростатических сил притяжения ионов, так что ионы в растворе отделяются друг от друга, т.е. происходит электролитическая диссоциация. Сильные электролиты, в частности галогениды и нитраты щелочных и щелочноземельных металлов, полностью ионизированы в растворе при всех приемлемых концентрациях.
Противоположно заряженные ионы в растворе притягиваются друг к другу, причем степень притяжения возрастает с увеличением концентрации, поскольку расстояние между ионами уменьшается. Диссоциация, особенно при высоких концентрациях, никогда не бывает полной. Здесь нужно остановиться на различии между диссоциацией и ионизацией. Сильные электролиты (например, соль) в растворе полностью ионизированы фактически при всех концентрациях, но степень их диссоциации зависит от концентрации и становится достаточно высокой только в очень разбавленных растворах. Слабые электролиты, напротив, ионизированы лишь частично, и степень ионизации у них очень мало отличается от степени диссоциации; это и подтверждают измерения электропроводности.