в чем растворяется цинк
Цинк — общая характеристика элемента, химические свойства цинка и его соединений

Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
2Zn + O2 → 2ZnO.
При поджигании энергично реагирует с серой:
Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn + 2HCl → ZnCl2 + H2;
Zn + H2SO4 → ZnSO4 + H2.
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O;
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты:
Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH3 → Zn3N2 + 3H2;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO4 → Cu + ZnSO4;
Zn + CuO → Cu + ZnO.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl2 + H2O;
ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
Урок №56. Цинк
ЦИНК И ЕГО СОЕДИНЕНИЯ
СТРОЕНИЕ АТОМА
Цинк – элемент IIБ подгруппы четвертого периода. Цинк относится к семейству d-элементов, поскольку электронное строение цинка отражается конфигурацией.
Нахождение в природе
Цинковую обманку считают первичным минералом, из которого образовались другие минералы цинка:
§ каламин 2ZnO · SiO 2 · Н 2 O
В организме взрослого человека содержится в среднем около 2 г цинка, в виде его соединений, который концентрируется преимущественно в простате, мышцах, печени и поджелудочной железе.
Недостаток цинка в организме приводит к ряду расстройств — раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, снижение уровня инсулина, аллергические заболевания, анемия и др.
ЦИНК
СФАЛЕРИТ
Способы получения
Цинк получают из сульфидной руды. Сульфид цинка обжигают в печи кипящего слоя:
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
Получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу. При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
При дальнейшем добавлении избытка щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката :
Химические свойства
2. Цинк взаимодействует со сложными веществами:
§ с парами воды при температуре красного каления с образованием оксида цинка и водорода:
§ с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.).
§ Аналогично: при нагревании с азотной кислотой образуются различные продукты в зависимости о концентрации кислоты – N 2 O, N 2 и др. :
Цинк реагирует с расплавом щелочи с образованием цинката и водорода :
С газообразным аммиаком при 550–600°С образует нитрид цинка:
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Оксид цинка
Способы получения
1. Окислением цинка кислородом:
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка:
Химические свойства
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката :
3. Оксид цинка не взаимодействует с водой.
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Гидроксид цинка
Способы получения
Химические свойства
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами).
В расплаве образуются соли — цинкаты:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката :
4. Гидроксид цинка разлагается при нагревании:
Соли цинка
Нитрат и сульфат цинка
Комплексные соли цинка
§ с кислотными оксидами
§ Под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
§ Под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
§ Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
§ Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
§ цинкаты реагируют с кислотами с образованием солей цинка :
§ под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Свойства цинка и его взаимодействие с другими веществами
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Цинк относят к металлам, он обладает всеми их свойствами. Ему присущи блеск, твердость, пластичность, теплопроводность, электропроводность. Однако в определенных условиях цинк может проявлять свойства неметалла.
Характеристики цинка

Цинк имеет приятный серебристо-голубой цвет. В обычных температурных условиях он гибкий, иногда ломкий. Металл используют для того, чтобы раскатывать его в листы. Через некоторое время на листах возникает оксидный тонкий слой, поэтому цинк перестает взаимодействовать с воздухом. Со временем он начинает немного мутнеть, терять блеск.
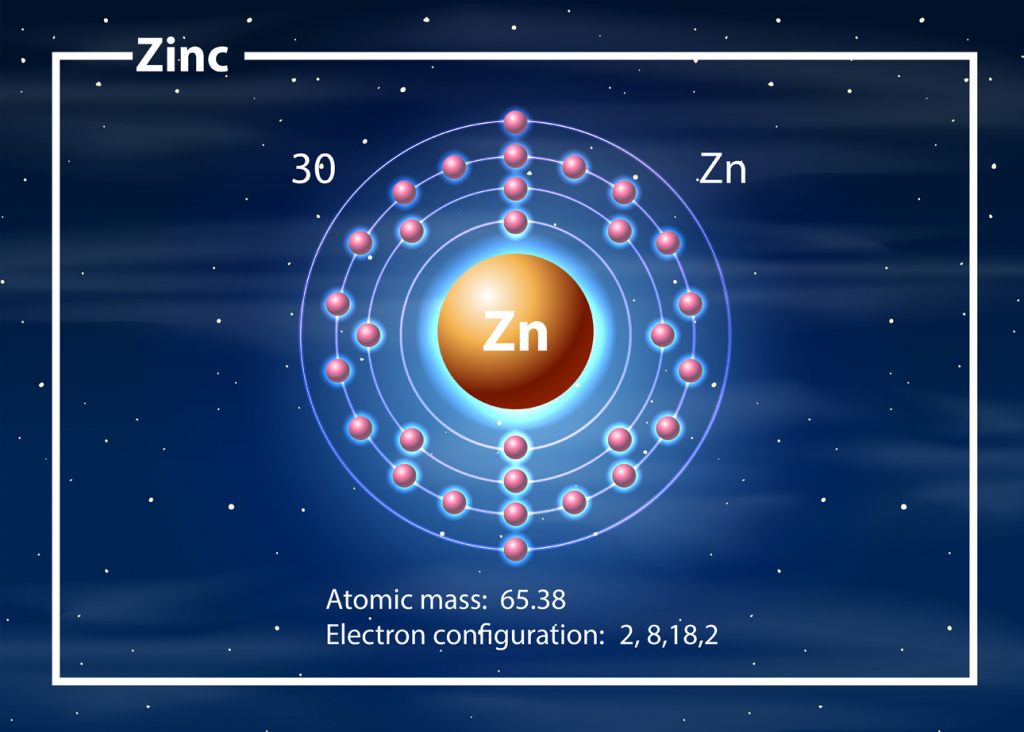
В таблице Менделеева химический элемент стоит под 30-м номером. Относится к группе переходных металлов. Обозначается элемент как Zn.
Где содержится цинк?
В 18 веке Уильяму Чемпиону удалось получить чистый цинк. До этого его использовали вместе с медью, называя конечный продукт соединения латунью.
Большое количество цинка содержится в земной коре. Для промышленных целей цинк добывается из термальных источников.
Роль цинка в жизни растений и животных очень велика. Это важный биогенный элемент.
Взаимодействие цинка с водой
Если вода нагрета до высоких температур, то при взаимодействии с ней цинка выделается оксид цинка.
Взаимодействие цинка с кислотами
Конечный продукт реакции цинка с кислотой будет зависеть от двух факторов. Значение имеют вид кислоты, которая участвует в реакции, а также ее концентрация. Обычно, вступая в реакцию с кислотами, цинк вытесняет из них водород.
Технический цинк легко растворяется в кислотах, так как в нем содержатся примеси других активных металлов. Если речь идет о чистом цинке, то он практически не поддается воздействию кислот. Для ускорения реакции в раствор добавляют медь или медные соли.
Взаимодействие цинка со щелочами
Если в реакции участвует щелочь, доведенная до высоких температур, то образуются гидроцинкаты.
Внимание! В сильной щелочной среде цинк начинает демонстрировать свойства восстановителя.
Где применяют цинк?
Цинк активно применяется в современной жизни:
Внимание! В организме цинк играет важную роль, так как поддерживает гомеостаз. Также он отвечает за формирование первичных половых признаков, поддерживает в норме обменные процессы.
Данный металл активно вступает во взаимодействие с кислородом, водой, кислотами и щелочами, водородом, используется в различных сферах человеческой жизни.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Подгруппа цинка
| Элемент | Символ | Атомный вес | Порядковый номер | Распределение электронов | по слоям | ||||
| Цинк | Zn | 65,38 | 30 | 2 | 8 | 18 | 2 | ||
| Кадмий | Cd | 112,41 | 48 | 2 | 8 | 18 | 18 | 2 | |
| Ртуть | Hg | 200,61 | 80 | 2 | 8 | 18 | 32 | 18 | 2 |
Элементы этой подгруппы — цинк, кадмий и ртуть — характеризуются наличием двух электронов в наружном слое атома и восемнадцати в предыдущем. Хотя они не обладают способностью к присоединению электронов, металлические свойства их выражены значительно слабее, чем у находящихся в четной подгруппе щелочноземельных металлов. Они менее активны, труднее окисляются, не взаимодействуют с водой при обыкновенной температуре. Гидроокиси их нерастворимы в воде и являются более слабыми основаниями, чем гидроокиси щелочноземельных металлов, а гидроокись цинка даже амфотерна.
Все элементы подгруппы цинка двухвалентны; ртуть, кроме того, образует ряд соединений, в которых она формально одновалентна.
Цинк (Zincum); ат. вес 65,38. Главные природные соединения цинка, из которых он добывается, — минералы галмей ZnCО3 и цинковая обманка ZnS. Общее содержание цинка в земной коре составляет 0,02% ее веса.
Большинство цинковых руд содержит небольшие количества цинка, поэтому их предварительно обогащают. Из полученного цинкового концентрата цинк извлекают либо дестилляционным, либо электролитическим методом.
Первый метод основа на отгонке цинка, получающегося при восстановлений предварительно обожженной цинковой руды углем при температуре 1300—1400°. Образующиеся пары цинка сгущаются в глиняных приемниках. Часть цинка осаждается на стенках приемника в виде металлической пыли, смешанной с окисью цинка («цинковая пыль»); большая же часть цинка собирается в расплавленном виде на дне приемника и оттуда выпускается в отливные формы.
Второй метод заключается в электролитическом выделении цинка из его сульфата. Последний получается путем обработки обожженных цинковых руд или концентратов серной кислотой. Электролитический метод дает более чистый продукт и более рентабелен, чем дестилляционный метод.
В СНГ месторождения цинка имеются в Казахстане, на Урале, Северном Кавказе, в Сибири и на Дальнем Востоке.
Цинк представляет собой синевато-белый металл уд. веса 7,14, плавящийся при 419,5°, а при 907° превращающийся в пар. При обыкновенной температуре цинк довольно хрупок, но при 100—110° он хорошо гнется и прокатывается в листы. На воздухе цинк покрывается тонким слоем окиси или основного карбоната, предохраняющим его от дальнейшего окисления. Вода почти не действует на цинк, хотя он и стоит в ряду напряжений значительно левее водорода. Это объясняется тем, что образующаяся на поверхности цинка при взаимодействии его с водой гидроокись практически нерастворима и препятствует дальнейшему течению реакции. В разбавленных же кислотах цинк легко растворяется с образованием соответствующих солей. Кроме того, цинк подобно бериллию и другим металлам, образующим амфотерные гидроокиси, растворяется в щелочах. Если нагреть цинк на воздухе до температуры кипения, то пары его воспламеняются и сгорают зеленовато-белым пламенем, образуя окись цинка.
Применение цинка очень разнообразно. Больше половины всего добываемого цинка идет на покрытие железа для предохранения его от ржавления (оцинкованное железо). Цинк расхо дуется также в больших количествах для приготовления гальванических элементов и входит в состав многих сплавов (например, латуни).
Выплавка цинка в капиталистических странах составила в 1957 г. 2,4 млн. т. В СССР к началу первой пятилетки выплавлялось лишь незначительное количество цинка (несколько тысяч тонн). За годы довоенных пятилеток выплавка цинка сильно возросла, особенно же большого развития она достигла в послевоенный период.
В 1955 г. выплавка цинка увеличилась по сравнению с выплавкой 1950 г. вдвое. Это было достигнуто как путем ввода в строй новых заводов, так и путем значительной интенсификации действующего оборудования. В 1959—1965 гг. выплавку цинка намечено значительно увеличить. Для успешного выполнения этой задачи большое значение имеет применение в производстве цинка метода обжига концентратов в «кипящем слое».
Обжиг в «кипящем слое». Метод обработки мелкораздробленных твердых материалов в так называемом «кипящем слое» получил в последнее время широкое распространение в различных отраслях промышленности. Этот метод заключается в следующем. Через слой порошкообразного материала, помещенного на решетке, продувают снизу воздух (или какой-либо газ) с такой скоростью, что его струи пронизывают и интенсивно перемешивают материал, приводя его как бы в кипящее состояние. Такое состояние твердого материала часто называют «псевдоожиженным», так как кипеть могут только вещества, находящиеся в жидком состоянии.
Благодаря тесному соприкосновению твердого материала с газом химические реакции в «кипящем слое» протекают с большой скоростью. На цинковых заводах применение обжига в «кипящем слое» дает повышение производительности обжиговых печей в 3—4 раза при более полном извлечении цинка из концентратов.
Метод весьма эффективен при обжиге сульфидных руд и концентратов, возгонке легко кипящих металлов, прокаливании, охлаждении, сушке и хлорировании различных веществ.
Окись цинка ZnO — рыхлый белый порошок, желтеющий при нагревании, но при охлаждении снова становящийся белым. Окись цинка применяется для изготовления белой масляной краски (цинковые белила); в медицине и косметике; для приготовления различных мазей; значительная часть получаемой окиси цинка потребляется резиновой промышленностью в качестве наполнителя резины.
Гидрат окиси цинка Zn(OH) 2 выпадает в виде белого осадка при действии щелочей на растворы цинковых солей:
Осадок легко растворяется в кислотах с образованием солей цинка (например, ZnCl2), но также и в щелочах с образованием солей цинковой кислоты, называемых цинкатами. Следовательно, гидроокись цинка является амфотерным соединением.
Раньше цинкатам приписывали состав, отвечающий формуле Na2ZnО2. В настоящее время их рассматривают как соли, содержащие комплексный ион [Zn(ОH)3]’ . Подобного рода соли называются гидроксисолями в отличие от солей, содержащих такие анионы, как SO4«, СO3«, NO3‘ и др., называемых оксосолями. Гидроксисоли получаются при действии избытка щелочи на соответствующие гидраты окислов вследствие реакции комплексообразования:
или в молекулярной форме
Аналогичные гидроксисоли образуются при действии щелочей и на некоторые другие амфотерные гидроокиси.
Растворение металлического цинка в щелочах тоже сопровождается образованием цинкатов. Обычно эту реакцию выражают уравнением
Однако в действительности реакция, вероятно, протекает несколько иначе. Как мы уже говорили, металлический цинк практически не взаимодействует с водой вследствие образования на его поверхности слоя Zn(OH)2, препятствующего дальнейшему течению реакции. Но в присутствии щелочи гидроокись цинка растворяется, образуя комплексный анион [Zn(OH)3]’, и цинк в соответствии со своим положением в ряду напряжений начинает вытеснять из воды водород. Таким образом, выделение водорода при действии раствора щелочи на цинк происходит вследствие взаимодействия цинка с водородными ионами воды, а не с гидроксильными ионами щелочи; роль же последних заключается в растворении образующейся гидроокиси цинка:
или в молекулярной форме:
Гидрат окиси цинка растворяется также в водном аммиаке вследствие образование комплексных ионов [Zn(NH3)4] •• :
Из солей цинка наиболее известны следующие: 1. Сульфат цинка, или сернокислый цинк,ZnSO4. Из водного раствора выделяется в виде кристаллогидрата, имеющего состав ZnSO4• 7Н2O, и в таком виде называется цинковым купоросом. Применяется при крашении и ситцепечатании, при получении металлического цинка электролитическим путем, в меди как вяжущее средство, а также является исходным веществом при получении других соединений цинка.
2. Хлорид цинка, или хлористый цинк, ZnCl2. Раствор его служит для пропитывания железнодорожных шпал, чтобы предохранить их от гниения. Хлористый цинк применяется также при паянии. Он очищает спаиваемые поверхности от окислов и препятствует окислению металла в момент пайки.
Некоторое количество хлористого цинка используется при производстве растительного пергамента. Непроклеенную бумагу обрабатывают концентрированным раствором хлористого цинка, что ведет к частичному разложению поверхностных слоев клетчатки и заполнению пор бумаги продуктами разложения. Затем бумагу тщательно промывают и обрабатывают раствором глицерина для придания ей мягкости и гибкости.
3. Сульфид цинка, или сернистый цинк, ZnS. Это соединение является одним из немногих сернистых металлов, имеющих белый цвет.
Сульфид цинка получается в виде белого осадка при действии сульфидов щелочных металлов на соли цинка:
Смесь сульфида цинка с сульфатом бария применяется в качестве белой краски под названием литопон.
Вы читаете, статья на тему Подгруппа цинка
Похожие страницы:
Понравилась статья поделись ей
В чем растворяется цинк

СТРУКТУРА
СВОЙСТВА

ЗАПАСЫ И ДОБЫЧА
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл»
Цинк добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах.
ПРОИСХОЖДЕНИЕ

ПРИМЕНЕНИЕ

Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах.
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.