в чем растворяется целлюлоза
Статья по теме: Целлюлоза растворяется
Предметная область: полимеры, синтетические волокна, каучук, резина
Целлюлоза растворяется в кислотах при более высокой их концентрации, чем гемицеллюлозы. У целлюлозы, даже если она растворяется в концентрированной кислоте, существует начальная гетерогенная реакция гидролитической деструкции. Основной же гидролиз происходит в гомогенной среде. Соотношение между скоростями растворения и гидролиза целлюлозы зависит от концентрации кислоты. При массовой доле H2SO4 в водном растворе 55. 62% наблюдается более высокая скорость гидролиза, чем растворения, а при массовой доле H2SO4 выше 62% скорость гидролиза меньше скорости растворения, т.е. в обычных условиях гидролиза древесины и целлюлозы концентрированной серной кислотой растворение опережает гидролиз.[2, С.294]
Целлюлоза растворяется в концентрированных серной (62. 78%-й) и фосфорной (с массовой долей НзРО4 в растворе 83% и более) и сверхконцентрированной (40. 42%-й) соляной кислотах. Однако в серной и соляной кислотах происходит ин-[2, С.559]
При приготовлении прядильного раствора целлюлоза растворяется, как уже указывалось, в результате ее взаимодействия с мед-ноаммиачным комплексным соединением Cu(NH3)m(OH)2. Этот процесс мало изучен, поэтому дать обоснованную схему протекающих реакций пока не представляется возможным. Наиболее вероятно, что гидроксид меди реагирует одновременно с двумя гидр-оксильными группами, находящимися в макромолекуле целлюлозы при втором и. третьем атомах углерода элементарного звена. При взаимодействии целлюлозы с медноаммиачным комплексом Cu(NH3)m(OH)2 значение m понижается (максимально т=4), и из комплекса частично выделяется аммиак.[6, С.217]
Получается взаимодействием целлюлозы с концентрированным раствором хлористого цинка (ZnCl.2), в котором целлюлоза растворяется при повышенной температуре. Фибру в известной мере можно уже назвать пластиком, но пластическими свойствами она обладает лишь до тех пор, пока содержит еще некоторое количество хлористого цинка или влаги. Собственно говоря, пластичность обусловлена наличием в ней влаги. Полностью высушенная, она теряет пластичность.[7, С.21]
Как уже отмечалось, гидролиз целлюлозы в концентрированных минеральных кислотах (серной, сверхконцентрированной соляной, фосфорной), являющихся растворителями целлюлозы, идет в гомогенной среде. Целлюлоза растворяется в минеральных кислотах более высоких концентраций (см. 17.2.2), чем нецеллюлозные полисахариды.[2, С.575]
Важнейшее место среди простых эфиров целлюлозы занимает эти л целлюлоза. Этилцеллюлозу можно получать гомогенным и гетерогенным способами, но промышленное применение в СССР получил лишь гомогенный способ, при котором получаем’ая этил-целлюлоза растворяется в этилируюшей смеси.[4, С.265]
Жесткие цепи не могут перемещаться по частям, поэтому для отделения двух жестких цепей друг от друга следует затратить большое количество энергии. При обычных температурах величина эйергии взаимодействия звеньев с молекулами растворителя недостаточна для полного отделения цепей. Аморфные линейные полимеры, жесткость цепей которых обусловлена присутствием полярных групп, хорошо набухают в силыюполярных жидкостях, но, как правило, не растворяются в них при обычных температурах. Для растворения очень жестких полимеров необходимо сильное взаимодействие между полимером и растворителем (например, целлюлоза растворяется в четвертичных аммониевых.основаниях, полиакрилоннтрил — в диметилформамиде),[1, С.323]
взаимодействие между полимером и растворителем (например, целлюлоза растворяется в четвертичных аммониевых. основаниях, полиакрилонптрил — в диметилформамиде).[5, С.323]
конц. H2SO4 в 5 мл уксусной кислоты. Смесь перемешивают стеклянной палочкой для равномерного увлажнения ‘целлюлозы. Бутыль закупоривают и оставляют на 1 ч при комнатной температуре. После этого к содержимому бутыли добавляют смесь 50 мл 95%-ного ацетангидрида и 20 мл ледяной уксусной кислоты и закрытую бутыль оставляют на водяной бане при 50 °С. Через 15 мин целлюлоза растворяется, и через 30 мин реакция завершается. Исходный раствор делят на две части, которые используют для получения триацетата к вторичного ацетата целлюлозы.[3, С.241]
Целлюлоза, свойства, получение и применение
Целлюлоза, свойства, получение и применение.
Целлюлоза – природное высокомолекулярное органическое соединение, углевод, полисахарид с формулой (C6H10O5)n.
Целлюлоза, формула, строение, вещество, характеристика:
Целлюлоза, клетчатка (фр. cellulose от лат. cellula – «клетка») – природное высокомолекулярное органическое соединение, углевод, полисахарид с формулой (C6H10O5)n.
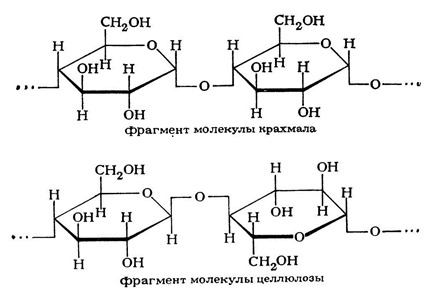
Молекулы целлюлозы представляют собой неразветвлённые цепочки из остатков β-D-глюкозы, соединённых гликозидными (водородными) связями β-(1→4).
Строение молекулы целлюлозы, структурная формула целлюлозы:
Молекула целлюлозы образована из множества (от нескольких сотен до десятков тысяч) остатков β-D-глюкозы, связанных между собой гликозидными ( водородными ) связями.
Молекула целлюлозы имеет линейное строение и склонна принимать вытянутую стержневую конформацию.
Так как макромолекула целлюлозы представляет собой смесь молекул (мономерных звеньев) с различной степенью полимеризации (т.е. числом мономерных звеньев в молекуле полимера ), то она неоднородна по молекулярной массе. Целлюлоза из древесины имеет типичную длину цепи от 300 до 1700 единиц мономерных звеньев C6H10O5, хлопок и другие растительные волокна, а также бактериальная целлюлоза имеют длину цепи от 800 до 10 000 единиц звеньев C6H10O5.
Молярная масса мономерного звена целлюлозы С6Н10О5 составляет 162,1406 г/моль
Целлюлоза – это растительный полисахарид, являющийся самым распространенным органическим веществом. Целлюлоза является главной составляющей частью и структурным материалом оболочки растительной клетки. Кроме целлюлозы в состав клеточных оболочек входят еще несколько других углеводов, известных под общим названием гемицеллюлозы (ксилан, маннан, галактан, арабан и др.).
Внешне целлюлоза в чистом виде представляет собой белое твердое волокнистое вещество, без вкуса и запаха.
Волокна целлюлозы обладают высокой механической прочностью.
Хорошо впитывает воду из-за наличия гидроксильных групп в своем составе.
Подвергается разложению при участии микроорганизмов и при действии ультрафиолетовых лучей.
Не разрушается при нагревании до 200 о С.
Нахождение целлюлозы в природе:
В чистом виде в природе не содержится.
В большом количестве целлюлоза содержится в волокнах хлопка – 95-98 %, льна – 60-85 %, в тканях древесины – 40-55 %, в растительных остатках, попадающих в почву (листьях, стеблях и пр.), – 40-90 %, в соломе – до 30 %.
Физические свойства целлюлозы:
| Наименование параметра: | Значение: |
| Цвет | белый |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), г/см 3 | 1,52-1,54 |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1520-1540 |
| Температура разложения, °C | 210 |
| Температура плавления, °C | 467 |
| Температура кипения, °C | — |
| Температура воспламенения, °C | 275 |
| Температура самовоспламенения, °C | 420 |
| Удельная теплота сгорания, МДж/кг | 16,40 |
| Молярная масса мономерного звена целлюлозы С6Н10О5, г/моль | 162,1406 |
Химические свойства целлюлозы. Химические реакции целлюлозы:
Из-за наличия трёх гидроксильных групп в каждом звене целлюлоза проявляет свойства многоатомных спиртов, поэтому для нее характерны все химические реакции, свойственные спиртам: образование простых и сложных эфиров органических и неорганических кислот, получение щелочной целлюлозы и др.
Основные химические реакции целлюлозы следующие:
1. гидролиз целлюлозы:
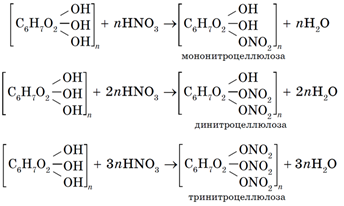
2. реакция нитрования целлюлозы (т.е. реакция целлюлозы с азотной кислотой).
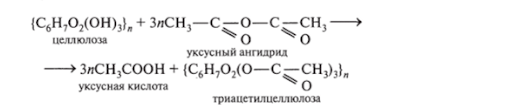
3. реакция этерификации целлюлозы с уксусной кислотой.
4. реакция пиролиза целлюлозы:
5. реакция горения целлюлозы:
В результате реакции происходит полное окисление целлюлозы до углекислого газа и воды.
Производство и получение целлюлозы:
Содержание целлюлозы в древесине составляет порядка 40-55 %. Остальное – гемицеллюлоза (ксилан, маннан, галактан, арабан и др.) и лигнин. Лигнин (от лат. lignum – дерево, древесина) – это вещество, характеризующее одеревеневшие стенки растительных клеток, и представляющее собой смесь ароматических полимеров родственного строения. На лигнин приходится от 18 до 24 % массы древесины лиственных пород и 23-50 % массы хвойных пород. Причем (лигнин) последний выполняет функцию связующего вещества между волокнами целлюлозы.
Если образно сравнить древесину с железобетоном, то получается, что волокна целлюлозы, обладающие высокой прочностью на растяжение, подобны арматуре в железобетоне, а лигнин, обладающий высокой прочностью на сжатие, – бетону.
Гемицеллюлоза в древесине выполняет функцию укрепления волокон целлюлозе. Она представляет собой растительные гомо- и гетерополисахариды с меньшей, чем у целлюлозы, молекулярной массой (10 000-40 000 г/моль), состоящие из остатков разных пентоз и гексоз.
Целлюлоза получается (выделяется) из древесины двумя методами: механическим и химическим. При любом методе получения целлюлозы древесина предварительно измельчается в щепу.
Механический метод получения целлюлозы:
При механическом методе получения целлюлозы древесную щепу, как правило, истирают или размалывают в водной среде в присутствии специальных реагентов. Под действием воды, тепла и специальных реагентов лигнин размягчается, и древесина распадается на отдельные волокна. Затем волокна очищаются. Однако полностью лигнин из полученных волокон не удаляется, а остается на поверхности и внутри них, что сказывается на качестве полученной целлюлозы и в будущем – на получаемых бумажных листах.
Выход «механической» древесной массы получается достаточно высоким.
Бумажные листы из «механической» древесной массы имеют низкую плотность, высокую твердость и жесткость, а также цвет исходной древесины.
Химический метод получения целлюлозы:
Химический метод получения целлюлозы заключается в том, что древесную щепу помещают в кипящий раствор, где варят в течении длительного времени.
По типу применяемых реагентов различают несколько способов варки древесной щепы:
– сульфитный. Варочный раствор содержит сернистую кислоту и её соль, например, гидросульфит натрия. Варка происходит при повышенной температуре и давлении. Этот способ варки применяется для получения целлюлозы из малосмолистых пород древесины: ели, пихты;
– сульфатный. Наиболее распространённый способ на сегодняшний день. В качестве реагента используют раствор, содержащий гидроксид и сульфид натрия. Данный способ пригоден для получения целлюлозы из любого вида растительного сырья.
В процессе варки получают техническую целлюлозу, которая выпадает в осадок, а лигнин взаимодействует с варочным раствором, в результате чего получаются различные химические вещества (кормовые дрожжи, сульфатный лигнин, сульфатное мыло, фитостерин, талловое масло, канифоль, сернистые соединения, метанол, скипидар и пр.).
Техническая целлюлоза для удаления гемицеллюлозы и облагораживания обрабатывается холодным или горячим раствором щелочи, а для удаления остаточного лигнина – хлором, озоном, кислородом, пероксидом водорода, после чего – щелочью. Процесс удаления лигнина также называется отбелкой целлюлозы и имеет цель придание ей белизны.
В отличие от целлюлозы, полученной механическим способом, целлюлоза, полученная химическим способом, имеет белый цвет, большую длину волокон, становится более гибкой.
Применение целлюлозы:
– для производства бумаги и картона,
– в качестве наполнителя в таблетках в фармацевтике,
– для получения искусственных волокон (вискозного, ацетатного, медно-аммиачного шёлка, искусственного меха),
– для изготовления тканей (хлопок, который большей частью состоит из целлюлозы – 95-98 %),
Целлюлоза: что такое, формула, получение, химические свойства
Содержание:
Целлюлоза, или клетчатка – это полисахарид, содержащийся в клеточных стенках растений. Ею богаты волокна хлопка, льна, конопли и др. Её содержание в растениях может достигать 95 % от общей массы. Например, древесина на 50 % состоит из клетчатки.
Строение целлюлозы
Молекулярная формула целлюлозы идентична формуле крахмала: (С6Н10О5)n, где n – степень полимеризации. Степень полимеризации у целлюлозы больше по сравнению с крахмалом. Макромолекула целлюлозы состоит из множества мономеров – остатков молекул β-глюкозы, а макромолекула крахмала – из α-глюкозы. Крахмал и целлюлоза – циклические соединения.
Структурные формулы целлюлозы и крахмала выглядят следующим образом:
| Характеристика | Крахмал | Целлюлоза |
| Остатки моносахаридов | α–глюкоза | β-глюкоза |
| Количество мономеров | Несколько тысяч | До 40 тысяч |
| Структура макромолекул | Свернуты компактно. Могут быть как разветвленными, так и неразветвленными | Имеют вид нитей. Могут быть только неразветвленными |
| Характер межмолекулярных взаимодействий | Водородные связи не образуются | Образуются прочные водородные связи |
Получение целлюлозы Клетчатку, как правило, синтезируют из древесины. В России популярен сульфитный метод синтеза целлюлозы.
В смеси технической целлюлозы, которая формируется после варки, также находятся лигнин и гемицеллюлоза. Если необходимо получить искусственные волокна, то целлюлозу облагораживают, т.е. обрабатывают щелочью для устранения гемицеллюлоз.
Чтобы удалить лигнин и придать целлюлозе белоснежный цвет, нужно провести отбелку. Например, хлорная отбелка состоит из двух стадий обработки:
Физические свойства целлюлозы
Целлюлоза не растворяется ни в воде, ни в органических растворителях. Единственное вещество, в котором растворяется клетчатка – аммиачный раствор гидроксида меди (II).
Химические свойства целлюлозы
В результате образуется глюкоза.
Реакция целлюлозы и азотной кислоты протекает при участии концентрированной серной кислоты. В результате формируются сложные эфиры.
Также целлюлоза реагирует с уксусным ангидридом при участии уксусной и серной кислот.
Целлюлоза в биологии
Целлюлоза в организме выполняет ряд функций:
Если в пище содержится клетчатка, то у человека быстрее наступает чувство сытости. Целлюлоза улучшает перистальтику кишечника.
Применение целлюлозы
Например, ацетатный шелк, негорючую пленку и органическое стекло производят из ацетилцеллюлозы. При производстве шелка ацетилцеллюлозу помещают в дихлорметан и этанол. Получившуюся смесь пропускают через колпачки с большим количеством отверстий. Порции раствора прогревают через нагретый воздух. Растворитель растворяется и триацетилцеллюлоза образует тонкие нити.
Динитроцеллюлозу применяют при производстве коллодия. Для получения коллодия динитроцеллюлозу растворяют в спирте и эфире. После испарения растворителей образуется толстая пленка – коллодий, который применяется в медицине. Динитроцеллюлоза также идет на производство целлулоида, который синтезируют путем ее сплавления с камфорой.
В чем растворяется целлюлоза
Использование целлюлозы как сырья для получения разнообразных продуктов современного производства и потребления — пластических масс, лаков, пленок, искусственных волокон и т. д. — связано обычно с процессами растворения. В текстильной промышленности, использующей в больших количествах природное волокно, имеют место процессы, тйк или иначе связанные с растворением, как например мерсеризация и набухание целлюлозных волокон.
В одном из наиболее развитых современных производств искусственных волокон — вискозном — важнейшей стадией процесса является растворение образовавшегося ксантогената целлюлозы в растворе щелочи. Само получение ксантогената в этом случае преследует главную цель — растворение целлюлозы.
Качество продуктов, получаемых при химической переработке целлюлозы, во многом зависит и от процесса растворения ее производных, и от свойств их растворов.
В предыдущих главах был подробно освещен вопрос о строении целлюлозы, ее физической тонкой структуре и химических свойствах. Относясь к числу высокополимерных соединений и благодаря этому обладая характерными общими свойствами этих веществ, целлюлоза имеет свои особенности весьма влияющие на способность ее к растворению. Среди этих особенностей следует обратить внимание на следующие.
1. Макромолекулы целлюлозы представляют собою длинные цепи, собранные в пучки (фибриллы). Степень упорядоченности ее макромолекул (даже в пределах длины одной и той, н! е макромолекулы) мошет быть весьма различной: от весьма высокой соответствующей ориентации в кристалле до самой низкой, соответствующей аморфному состоянию.
2. Макромолекулы целлюлозы построены из /)-глюкопиранозных остатков.
Так как мономерная единица макромолекулы целлюлозы представляет собою Л-глюкопиранозу и имеет 3 сводобных гидроксильных группы, а число мономеров в макромолекуле велико, то это обусловливает возможность образования многих водородных связей. Как следует из предыдущего изложения (глава III), энергия водородной связи типа: —О Н—О —
Довольна велика (до 10 ккал/моль) и, следовательно, обеспечивает очень большое взаимодействие между соседними макромолекулами целлюлозы.
Известно, что молекулярные силы обусловливают агрегацию отдельных молекул, обеспечивающую образование твердой или жидкой фазы. Сильное — межмолекулярное взаимодействие в целлюлозе и наличие регулярной структуры у ее макромолекул приводят к образованию упорядоченных областей с большой энергией кохезии.
Энергией кохезии назыьают ту полную энергию, которая необходима для удаления отдельной молекулы от других таких же молекул. Эта энергия, приблизительно пропорциональная теплоте парообразования или сублимации при постоянном объеме; она может быть подсчитана на основе термодин? мики. Энергию кохезии, отнесенную к единице объема (1 см3), называют удельной энергией кохезии или плотностью энергии кохезии.
В табл. 63 приведены величины энергий кохезии для некоторых высокомолекулярных соединений и целлюлозы Г1].
Молярная кохезия некоторых линейных полимеров [J]
Мономерная единица цепи
Молярная кохезчя на отрезо цепи длиной 5А, Ккал’мол->
Как видно из табл. 63, целлюлоза имеет среди указанных полимеров; самую высокую энергию кохезии. Это характеризует ее очень большое межмолекулярное взаимодействие, осуществляемое, как уже указывалось, главным образом водородными связями (см. выше, стр. 58).
Указанное обстоятельство играет важную роль в том, что природная целлюлоза растворяется с трудом и* в весьма ограниченном числе растворителей, образующих главным образом комплексные соединения с нею (как ‘например медноаммиачный комплекс) или химически взаимодействующих, как например концентрированная серная кислота.
Природа специфических растворов целлюлозы (медноаммначныг растворов ксантогената) будет рассмотрена в других разделах этой книги Здесь же основное внимание будет уделено лишь общим аспектам растворения целлюлозы и ее производных.
Для того чтобы произошло растворение полимера, необходимо разрушение связей между отдельными макромолекулами. Это возмоишо в том случае, если свободная энергия системы поншкается при смешении молекул растворителя с молекулами полимера. В связи с этим известной оценкой возможности растворения в том или ином растворителе является
Величина плотности энергии кохезии обоих компонентов смеси. Мы не будем рассматривать здесь природу специфического взаимодействия растворителя с растворяемым веществом, которая во многих деталях пока еще не ясна.
Для наших общих утверждений достаточно сказать, что важное значение для растворения целлюлозы и ее производных имеет энергетический фактор взаимодействия этих веществ с растворителем.
Влияние на растворимость указанных выше свойств целлюлозы, т. е. ■большого энергетического взаимодействия ее макромолекул, регулярности их строения ит. п. — свойств, связанных с энергетическим фактором, можно видеть из следующих примеров.
Термодинамические условия самопроизвольного растворения
10]. Для такого случая она приводит к следующим соотношениям для энтропии системы
Где Nt и N2 молярные доли обоих компонентов смеси
Если сумма молекул обоих компонентов смеси равна числу Авогадро NА, т. е.
При отнесении AS к изменению парциальных молярных количеств соответствующие идеальные энтропии смешения будут
Отсюда видно, что парциальная молярная энтропия смешения идеального раствора пропорциональна молярной доли компонента в смеси.
Экспериментально A. S’j можно определить расчетным путем (зная величины АН1 и Д/) по формуле
Где Д//] и ДF1—парциальные молярные величины энтальпии и свободной энергии.
Определение Д/ производится при помощи измерения упругости пара растворителя над раствором и над чистым растворителем (PJ).
ДЙг может быть определено непосредственным калориметрированием — или из измерений ДFx при двух температурах и концентрациях.
Величина идеальной энтропии смешения достигается только в том — случае, если после смешения все конфигурации в смеси совершенно равнозначны или смесь устроена абсолютно беспорядочно. Если некоторые конфигурации в смеси исключаются или очень редки (мало вероятны) по любым причинам, тогда и Д5’1 будут ниже идеальной величины. Тот же эффект имеет место и в том случае, если в системе имеется частичный порядок или какие-нибудь конфигурации являются предпочтительными. Другими словами: увеличение S или: W эквивалентно увеличению хаотичности (беспорядка). Любой предпочтительный способ устройства системы ведет к уменьшению S Или W.
Реальные смеси жидкостей в общем не состоят из сферических молекул эквивалентного размера и одинаковых сил притяжения. Поэтому энтропия реальных смесей отличается от идеальной величины.
Растворы высокополимерных соединений, в том числе целлюлозы и ее эфиров, показывают очень большие отклонения от поведения идеальных растворов. Эти отклонения вызываются не только тем, что в уравнении (1) Д Н=/=0, но и тем, что Д S здесь имеет обычно очень высокую величину. Значительные отклонения энтропии смешения от идеальной величины были объяснены Мейером [9> стр — 692 ] на основе большого размера и гибкости молекул полимерных соединений.
Благодаря гибкости молекул полимера отдельные части их могут вести себя как самостоятельные кинетические единицы, свободно обмениваясь местами с молекулами растворителя. Эти части молекул, которые мы будем называть сегментами, не имеют определенного размера. Их размер является величиной статистической, различной для одного и того же полимера в разных системах и разных физико-химических условиях.
Подобно статистическим расчетам термодинамической вероятности атермической смеси простых молекул была сделана качественная оценка термодинамической вероятности состояния системы каучук—толуол. Эту систему можно представить себе в виде квазикристаллической решетки, места которой заняты частично молекулами толуола (белые шары) и частично сегментами гибких молекул каучука (черные шары) (рис. 95).
Представим себе начальный момент растворения полимера — набухание, когда концентрация растворителя в системе невелика.
Сравним число возможных конфигураций белых шаров (молекул толуола) в этой системе с числом их возможных конфигураций в низкомо
лекулярной системе, содержащей эквивалентное число черных шаров, не связанных друг с другом, при условии, что белые шары могут свободно меняться местами с черными, соединенными в гибкую цепь (молекулы каучука).
Как видно из рис. 95.4, при небольших концентрациях растворителя (толуола) число конфигураций молекул толуола в обоих случаях будет — совершенно одинаково. Две молекулы толуола, показанные на рис. 95Л, могут занимать любые места в квазикристаллической решетке, свободно- обмениваясь местами с сегментами каучука. Следовательно, парциальная. штропия смешения толуола при переносе двух молекул толуола из чистое жидкости в фазу полимера будет равна энтропии смешения толуола с эквивалентным числом не молекул каучука, а его отдельных звеньев.
О о о о о о о о • о
О о о — о • О О О О о о о о о о о о о о о О о • о о о о о о о О о • о о
ООО О ОТ) ООО О • О О О о о О •
Рис. 95. Модельная система Мейера
А — размещение молекул толуола (белые maj 1 концентрип данных растворах каучука1 (1) и его мономе; (2) (чернее l ipu).
Б — размещение молекул толуола в разбачлег ых раствора^, каучука (1) и его мономера (2).
При увеличении концентрации растворителя в системе парциальная молярная энтропия растворителя будет уменьшаться, что можно видеть на рис. 95Б.
Этот рисунок показывает, что число возможных конфигураций белых шаров в системе белые шары (толуол)—черные связанные шары (цепи каучука) много меньше, чем в системе белые шары (толуол)—черные свободные шары (углеводород низкого молекулярного веса).
Число конфигураций в этом последнем случае лимитируется тем,, что звенья связаны между собой, Поэтому все конфигурации, которые — не удовлетворяют условию обязательной связи между отдельными звеньями (рис. 95Б), исключаются.
Число способов расположения черных цепей (молекул каучука) среди белых шаров (молекул толуола) с увеличением разбавления будет 1 увеличиваться, так как форма гибкой цепи при разбавлении раствора меняется и не столь лимитируется под влиянием соседних цепеь При разбавлении цепная молекула полимера становится кине • тичёски более свободной, чем до смешения, и может независимо принимать Нее возможные конфигурации.
На основе качественных соображений о термодинамической вероятности системы полимер—низкомолекулярная жидкость Флори[12] и Хаггинсом [13] были сделаны приблизительные подсчеты W для этой модели. Значение парциальных молярных энтропий для атермической
смеси (Д# = 0) п молекул растворителя с /V макромолекул полимера, каждая из которых содержит х звеньев, дается уравнениями
ДSl = —R [in ъ + (l — dJ, (9)
Тде и V2 — объемные доли компонентов смеси, а индексом 1 и 2 здесь, так же как и в других случаях, обозначаются величины, относящиеся к растворителю и полимеру соответственно.
Выше уже говорилось о том, что целлюлозные цепи по сравнению с другими полимерами обладают значительно большей жесткостью. Небольшая степень гибкости макромолекул целлюлозы (при достаточном большом энергетическом взаимодействии с растворителем) ограничивает значительные положительные отклонения энтропии смешения от идеальной величины и существенно препятствует растворимости целлюлозы.
Согласно этой же теории, изменение парциальной молярной свободной энергии — AF1 с учетом взаимодействия может быть написано в виде
В этом уравнении — эмпирическая константа, характерная для данной системы и выражающая взаимодействие полимера и растворителя. Величина может быть найдена с помощью измерения осмотического давления раствора, используя уравнение
Где я — осмотическое давление раствора; с — его концентрация; Vl — Молярный объем растворителя и d2 — плотность полимера. и |i, могут являться мерой растворяющей способности растворителя. Чем больше отрицательная величина, тем лучше растворитель. В термодинамическом смысле меньшая величина константы jix также соответствует лучшему растворителю.
Иллюстрируем теперь вышеизложенные соображения конкретными примерами, относящимися к целлюлозе и ее производным. Изучение термодинамических функций системы нитроцеллюлоза—циклогексанон [и], а также нитроцеллюлоза—ацетон [15] показало, что эти системы являются экзотермическими (Д/7 0). Таким образом, ацетат целлюлозы полностью сольватирован в разбавленных растворах. Разбавление более концентрированных растворов должно быть экзотермическим.
Величины TAS,, как это также видно из табл. 65, больше идеальных значений энтропии. Однако экспериментально найденные значения AS]
Являются значительно меньшими, чем эти значения, полученные для систем, состоящих из менее полярных и более гибких полимеров (для системы каучук—бензол, например, экспериментально найденная энтропия смешения отличается от идеальной в сотни раз).
В данном случае большой размер полимерных сегментов по сравнению с молекулами растворителя и ограниченная гибкость цепей уменьшают отклонения от идеальной величины.
В случае ограниченного набухания, например набухания целлюлозы в воде, из-за особой жесткости цепей и сильного энергетического взаимодействия между молекулами полимера и растворителя могут наблюдаться отрицательные изменения энтропии, так как в данном случае молекулы растворителя, проникая в фазу полимера и растворяясь в нем, располагаются меньшим числом способов, чем в чистом растворителе.
Подобный случай имеет место также для системы триацетилцеллюлоза—тетрахлорэтан [17]. Для этой системы характерны отрицательные изменения энтропии смешения при увеличении концентрации ацетил- целлюлозы в смеси. Термодинамические функции системы триацетилцеллюлоза— тетрахлоэтан приведены в табл. 66.
Отрицательные значения энтропии смешения не могут быть, однако, объяснены только сорбцией молекул растворителя на молекулах три- ацетилцеллюлозы.
Расчет показывает, что переход отрицательных значений энтропии смешения к положительным, наблюдаемый при молярной концентрации триацетилцеллюлозы N2=9.03.10″5, соответствовал бы связыванию одним звеном триацетилцеллюлозы 70 молекул тетрахлорэтана, что не согласуется с экспериментальными данными.
Значения термодинамических функций системы триацетилцеллюлоза— тетрахлорэтан [17|