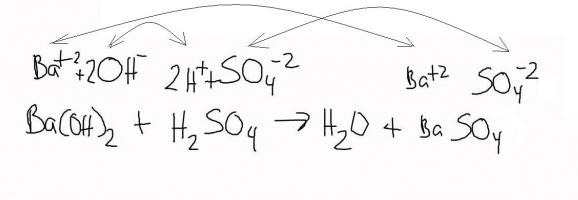в чем растворяется сульфат бария
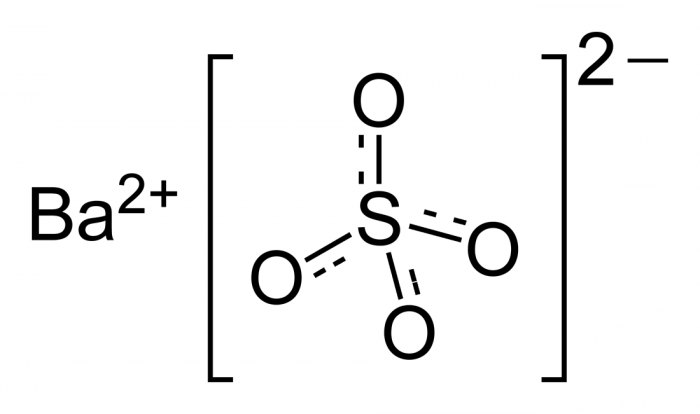
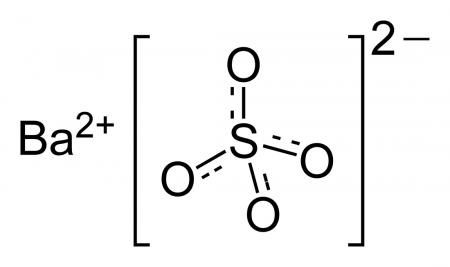
Сульфат бария
| Сульфат бария | |
|---|---|
 | |
 | |
| Систематическое наименование | Сульфат бария |
| Хим. формула | BaSO4 |
| Рац. формула | BaSO4 |
| Состояние | твёрдый |
| Молярная масса | 233.43 г/моль |
| Плотность | 4.5 г/см³ |
| Температура | |
| • плавления | 1580 °C |
| • разложения | 2912 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0,0002448 г/100 мл (20 °C) 0,000285 г/100 мл (30 °C) |
| Рег. номер CAS | 7727-43-7 |
| PubChem | 24414 |
| Рег. номер EINECS | 231-784-4 |
| SMILES | |
| RTECS | CR0600000 |
| ChEBI | 133326 |
| ChemSpider | 22823 |
| Токсичность | не токсичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат бария (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Содержание
Получение
Сульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
Последняя реакция используется также для получения пероксида водорода.
В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и декантируется.
Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Химические свойства
Сульфат бария нерастворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов.
Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
BaSO4 + 4C → BaS + 4CO
При температурах выше 1600 °C разлагается:
2BaSO4 → 2BaO + 2SO2 + O2
Токсичность
Сульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих смесей, используемых в качестве белых пигментов:
Употребляется как клеевая краска, так как нерастворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сероводорода.
Другие применения
Сульфат бария используется для различных промышленных целей:
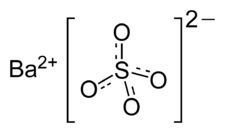
Сульфат бария
| Сульфат бария | |
  | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфат бария |
| Химическая формула | BaSO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердый |
| Отн. молек. масса | 233.43 а. е. м. |
| Плотность | 4.5 г/см³ |
| Термические свойства | |
| Температура плавления | 1580 °C |
| Химические свойства | |
| Растворимость в воде | 0.000115 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7727-43-7 |
Сульфа́т ба́рия (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Содержание
Получение
Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Химические свойства
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
При температуре свыше 1600 °C разлагается:
Токсичность
Сульфат бария не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и именно поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в растворе соляной кислоты, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («бариевую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих часть смесей, используемых в качестве белых пигментов:
Употребляется как клеевая краска, так как не растворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сернистого водорода.
Пиротехника
Сульфат бария используется как цветовой компонент для пиротехнических средств, так как ионы бария способствуют окрашиванию пламени в зеленый цвет. В настоящее время для этих целей в основном используют нитрат бария, за счет того, что он является сильным окислителем и способствует энергичному горению пиротехнической смеси.
Другие применения
Сульфат бария используется для различных промышленных целей:
Сульфат бария, характеристика, свойства и получение, химические реакции
Сульфат бария, характеристика, свойства и получение, химические реакции.
Сульфат бария – неорганическое вещество, имеет химическую формулу BaSO4.
Краткая характеристика сульфата бария:
Сульфат бария – неорганическое вещество белого цвета.
Химическая формула сульфата бария BaSO4.
Сульфат бария – неорганическое химическое соединение, соль серной кислоты и бария.
Практически не растворяется в воде.
Устойчив при высокой температуре.
Сульфат бария не ядовит, пожаро- и взрывобезопасен.
Сульфат бария распространён в природе в виде минерала барита (тяжелого шпата).
Физические свойства сульфата бария:
| Наименование параметра: | Значение: |
| Химическая формула | BaSO4 |
| Синонимы и названия иностранном языке | barium sulfate (англ.) |
barium sulphate (барит (рус.)
баритовые белила (рус.)
Получение сульфата бария:
В промышленности сульфат бария получают из природного минерала барита (тяжелого шпата).
В лаборатории сульфат бария получают в результате следующих химических реакций:
Химические свойства сульфата бария. Химические реакции сульфата бария:
1. реакция взаимодействия сульфата бария и углерода:
BaSO4 + 4C → BaS + 4CO (t = 1100-1200 °C),
В результате реакции образуются в первом случае – сульфид бария и оксид углерода (II), во втором – сульфид бария, оксид углерода (IV) и оксид углерода (II).
2. реакция взаимодействия сульфата бария и водорода:
3. реакция взаимодействия сульфата бария и гидроксида натрия :
4. реакция термического разложения сульфата бария:
Применение и использование сульфата бария:
Сульфат бария используется во множестве отраслей промышленности и для бытовых нужд:
– при рентгеновских исследованиях в качестве рентгеноконтрастного вещества;
– в аналитической химии;
– в качестве компонента бурового раствора нефтяных скважин ;
Примечание: © Фото https://www.pexels.com, https://pixabay.com
сульфат бария реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата бария
реакции
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Что такое бария сульфат? Как получают сульфат бария?
Бария сульфат – это неорганическое вещество с химической формулой BaSO4. Представляет собой белый порошок без запаха, нерастворимый в воде. Его белизна и непрозрачность, а также высокая плотность определяют основные области применения.
История названия
Барий относится к щёлочноземельным металлам. Последние названы так потому, что, по словам Д. И. Менделеева, их соединения образуют нерастворимую массу земли, а окислы «имеют землистый вид». Барий в природе содержится в виде минерала барита, который представляет собой бария сульфат с различными примесями.
Впервые он был обнаружен шведскими химиками Шееле и Ганом в 1774 году в составе так называемого тяжелого шпата. Отсюда возникло и название минерала (от греч. «барис» – тяжелый), а затем и самого металла, когда в 1808 г. его выделил в чистом виде Гемфри Деви.
Физические свойства
Поскольку BaSO4 – это соль серной кислоты, то ее физические свойства отчасти определяются самим металлом, который является мягким, химически активным и серебристо-белым. Природный барит бесцветен (иногда белый) и прозрачен. Химически чистый BaSO4 имеет цвет от белого до бледно-желтого, он негорючий, с температурой плавления 1580°С.
Химические свойства
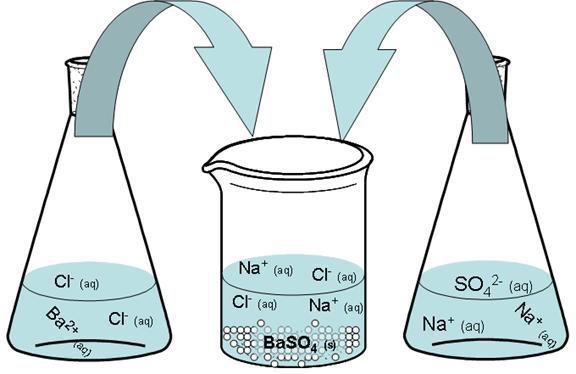
Смешаем водный раствор сульфата и смесь, содержащую хлорид. Бария сульфат образуется в результате соединения в одну молекулу двух ионов с одинаковым по величине и противоположным по знаку зарядом.
Ниже вы можете увидеть полное уравнение этой реакции (так называемое молекулярное).
В результате образуется нерастворимый осадок сульфата бария.
Товарный барит
На практике исходным сырьем для получения товарного сульфата бария, предназначенного для использования в буровых растворах при бурении нефтегазовых скважин, является, как правило, минеральный барит.
Термин «первичный» барит относится к товарной продукции, которая включает в себя сырой материал (получаемый из шахт и карьеров), а также продукты простого обогащения такими методами, как промывка, осаждение, сепарация в тяжелых средах, флотация. Большая часть сырого барита требует доведения его до минимальной чистоты и плотности. Минерал, который используется в качестве наполнителя, измельчают и просеивают до однородного размера так, чтобы, по меньшей мере, 97 % его частиц имели размер до 75 мкм, и не более 30 % были менее 6 мкм. Первичный барит также должен быть достаточно плотным, чтобы его удельный вес составил 4,2 г/см 3 или выше, но при этом достаточно мягким, чтобы не повредить подшипники.
Получение химически чистого продукта
Минеральный барит зачастую загрязнен различными примесями, в основном оксидами железа, окрашивающими его в различные цвета. Он обрабатывается карботермическим способом (нагревом с коксом). В результате получается сульфид бария.
BaSO4 + 4 С → BaS + 4 СО
Последний, в отличие от сульфата, растворим в воде и легко реагирует с кислородом, галогенами и кислотами.
Чтобы получить высокочистый выходной продукт, используется серная кислота. Сульфат бария, образуемый по такому процессу, часто называют бланфиксом, что в переводе с французского означает «белый фиксированный». Он часто встречается в потребительских продуктах, таких как краски.
В лабораторных условиях сульфат бария образуется путем объединения в растворе ионов бария и сульфат-ионов (см. выше). Поскольку сульфат является наименее токсичной солью бария из-за ее нерастворимости, отходы, содержащие другие его соли, иногда обрабатывают сульфатом натрия, чтобы связать весь барий, являющийся достаточно токсичным.
Из сульфата в гидроксид и обратно
Исторически барит использовался для производства гидроксида бария Ba(OH)2, необходимого при рафинировании сахара. Это вообще очень интересное и широко используемое в промышленности соединение. Оно хорошо растворимо в воде, образует раствор, известный как баритовая вода. Ее удобно использовать для связывания сульфат-ионов в различных составах путем образования нерастворимого BaSO4.
Выше мы видели, что при нагреве в присутствии кокса из сульфата легко получить водорастворимый сульфид бария – BaS. Последний же при взаимодействии с горячей водой образует гидроксид.
Гидроксид бария и сульфат натрия, взятые в растворах, при смешивании дадут нерастворимый осадок сульфата бария и едкий натрий.
Получается, что природный бария сульфат (барит) промышленным способом сначала превращается в бария гидроксид, а затем служит для получения того же сульфата при очистке различных солевых систем от сульфат-ионов. Точно так же будет проходить реакция и при очистке от ионов SO4 2- раствора сернокислой меди. Если сделать смесь «гидроксид бария + сульфат меди», то в результате получится гидроксид меди и нерастворимый бариевый сульфат.
Даже в реакции с самой серной кислотой ее сульфат-ионы будут полностью связаны барием.
Использование в буровых растворах
Около 80 % мирового производства сульфата бария, очищенного и измельченного барита, потребляется в качестве компонента буровых растворов при создании нефтегазовых скважин. Добавка его увеличивает плотность жидкости, закачиваемой в скважину, с целью лучшего сопротивления высокому пластовому давлению и предотвращения прорывов.
Когда скважина бурится, долото проходит через различные образования, каждое из которых имеет свои характеристики. Чем больше глубина, тем больший процент барита должен присутствовать в структуре раствора. Дополнительным преимуществом является то, что бария сульфат – немагнитное вещество, поэтому он не мешает проведению различных измерений в скважине с помощью электронных устройств.
Лакокрасочная и бумажная промышленность
Большая часть синтетического BaSO4 используется в качестве компонента белого пигмента для красок. Так, бланфикс в смеси с двуокисью титана (TiO2) продается в качестве белой масляной краски, применяемой в живописи.
Сочетание BaSO4 и ZnS (сульфид цинка) дает неорганический пигмент, который называется литопоном. Он используется в качестве покрытия для определенных сортов фотобумаги.
Совсем недавно бария сульфат был применен для осветления бумаги, предназначенной для струйных принтеров.
Применение в химической промышленности и цветной металлургии
В производстве полипропилена и полистирола BaSO4 используют в качестве наполнителя в пропорции до 70 %. Он имеет эффект увеличения стойкости пластмасс к кислотам и щелочам, а также придает им непрозрачность.
Он также используется для производства других соединений бария, в частности его карбоната, который применяется для изготовления светодиодного стекла для телевизионных и компьютерных экранов (исторически в электронно-лучевых трубках).
Формы, используемые в отливке металлов, часто покрывают бария сульфатом для предотвращения сцепления с расплавленным металлом. Так поступают при изготовлении анодных медных пластин. Их отливают в медные изложницы, покрытые слоем сульфата бария. Когда жидкая медь затвердевает в виде готовой анодной пластины, она может быть легко извлечена из литейной формы.
Пиротехнические устройства
Поскольку соединения бария испускают зеленый свет при горении, то соли этого вещества часто используются пиротехнических формулах. Хотя нитрат и хлорат являются более распространенными, чем сульфат, последний широко используется в качестве компонента пиротехнических стробоскопов.
Рентгеноконтрастный препарат
Бария сульфат является рентгеноконтрастным агентом, используемым для диагностики определенных медицинских проблем. Так как подобные вещества являются непрозрачными для рентгеновских лучей (блокируют их в результате своей высокой плотности), то области тела, в которых они локализуются, появляются как белые участки на рентгеновской пленке. Это создает необходимое различие между одним (диагностируемым) органом и другими (окружающими его) тканями. Контраст поможет врачу увидеть любые особые условия, которые могут существовать в этом органе или части тела.
Бария сульфат принимается через рот или ректально при помощи клизмы. В первом случае он делает пищевод, желудок или тонкий кишечник непрозрачным для рентгеновских лучей. Таким образом, они могут быть сфотографированы. Если вещество введено при помощи клизмы, то толстую кишку или кишечник можно увидеть и зафиксировать рентгеновскими лучами.
Доза сульфата бария будет разной для разных пациентов, все зависит от типа теста. Препарат выпускается в виде специальной медицинской бариевой суспензии или в таблетках. Различные тесты, при которых нужен контраст и рентгеновское оборудование, требуют различного количества суспензии (в некоторых случаях необходим прием препарата в форме таблетки). Контрастное вещество должно использоваться только под непосредственным контролем врача.