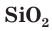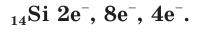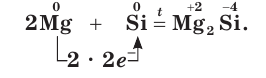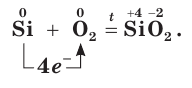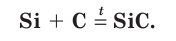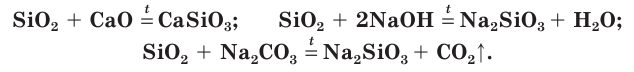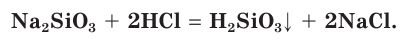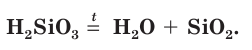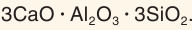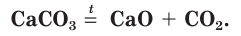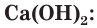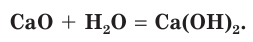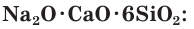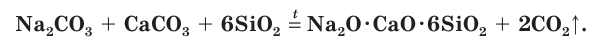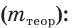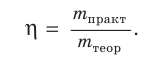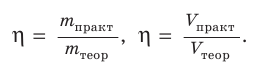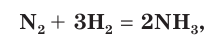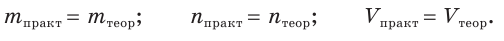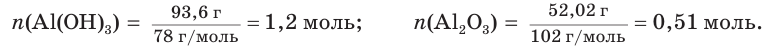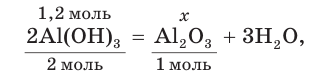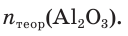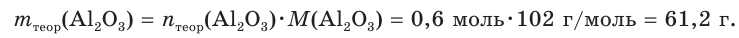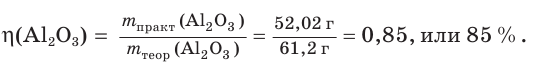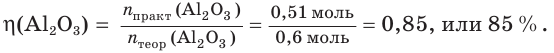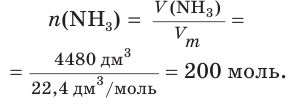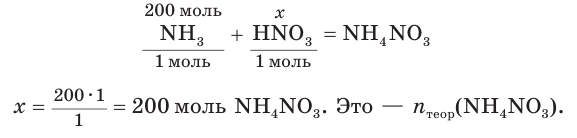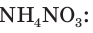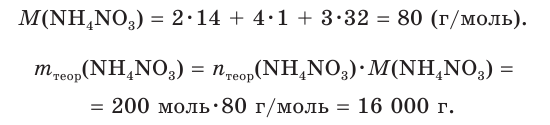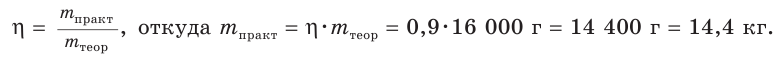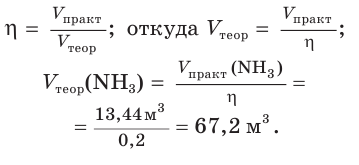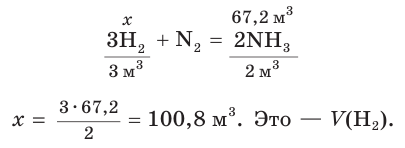в чем растворяется кремний
Кремний
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
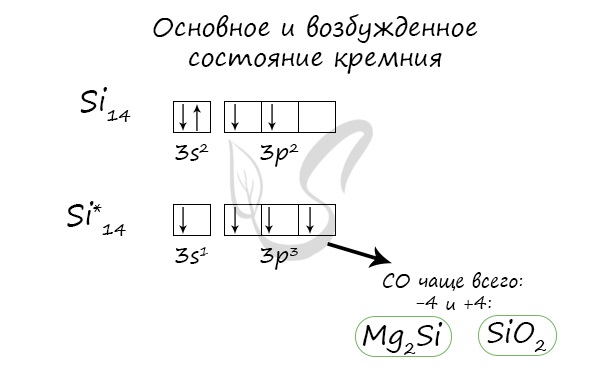
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
При обычных условиях без нагревания кремний реагирует только со фтором.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
В большинстве реакций Si выступает в роли восстановителя:
При низких температурах кремний химически инертен, при нагревании его реакционная способность резко возрастает.
1. С кислородом взаимодействует при Т выше 400°С:
Si + О2 = SiO2 оксид кремния
2. С фтором реагирует уже при комнатной температуре:
Si + 2F2 = SiF4 тетрафторид кремня
4. С парами серы при 600°С образует дисульфид:
5. Реакция с азотом происходит выше 1000°С:
6. При температуре = 1150°С реагирует с углеродом:
SiO2 + 3С = SiС + 2СО
По твердости карборунд близок к алмазу.
7. С водородом кремний непосредственно не реагирует.
8. Кремний стоек к действию кислот. Взаимодействует только со смесью азотной и фтороводородной (плавиковой) кислот:
9. реагирует с растворами щелочей с образованием силикатов и выделением водорода:
10. Восстановительные свойства кремния используют для выделения металлов из их оксидов:
2MgO = Si = 2Mg + SiO2
Кремний образует силициды с s-металлами и большинством d-металлов.
Силан (моносилан) SiH4
1. Разложение силицида магния соляной кислотой: Mg2Si + 4HCI = 2MgCI2 + SiH4
2. Восстановление галогенидов Si алюмогидридом лития: SiCl4 + LiAlH4 = SiH4↑ + LiCl + AlCl3
1.SiH4 окисляется кислородом даже при очень низких температурах:
2. SiH4 легко гидролизуется, особенно в щелочной среде:
Оксид кремния (IV) (кремнезем) SiO2
Аморфный SiO2 встречается в виде минерала опала: искусственно получают силикагель, состоящий из коллоидных частиц SiO2 и являющийся очень хорошим адсорбентом. Стеклообразный SiO2 известен как кварцевое стекло.
Физические свойства
В воде SiO2 растворяется очень незначительно, в органических растворителях также практически не растворяется. Кремнезем является диэлектриком.
Химические свойства
2. SiO2 взаимодействует также при нагревании с основными оксидами:
3. Будучи нелетучим оксидом, SiO2 вытесняет углекислый газ из Na2CO3 (при сплавлении):
4. Кремнезем реагирует с фтороводородной кислотой, образуя кремнефтористоводородную кислоту H2SiF6:
Кремниевые кислоты
— ортокремниевая кислота H4SiО4;
— метакремниевая (кремниевая) кислота H2SiO3;
— ди- и поликремниевые кислоты.
Все кремниевые кислоты малорастворимы в воде, легко образуют коллоидные растворы.
Способы по-лучения
1. Осаждение кислотами из растворов силикатов щелочных металлов:
2. Гидролиз хлорсиланов: SiCl4 + 4Н2О = H4SiO4 + 4HCl
Химические свойства
При нагревании они дегидратируются с образованием в качестве конечного продукта кремнезема
Поскольку кремниевые кислоты чрезвычайно слабые, их соли в водных растворах сильно гидро лизованы:
По этой же причине при пропускании углекислого газа через растворы силикатов происходит вытеснение из них кремниевой кислоты:
Данную реакцию можно рассматривать как качественную реакцию на силикат-ионы.
Стекло
Обычное оконное стекло имеет состав Na2O • СаО • 6SiO2, т. е. является смесью силикатов натрия и кальция. Его получают сплавлением соды Na2CO3, известняка СаСO3 и песка SiO2;
Цемент
Порошкообразный вяжущий материал, образующий при взаимодействии с водой пластичную массу, превращающуюся со временем в твердое камневидное тело; основной строительный материал.
КРЕМНИЙ
КРЕМНИЙ, Si (silicium), химический элемент IVA подгруппы (C, Si, Ge, Sn и Pb) периодической системы элементов, неметалл.
Кремний в свободном виде был выделен в 1811 Ж.Гей-Люссаком и Л.Тенаром при пропускании паров фторида кремния над металлическим калием, однако он не был описан ими как элемент. Шведский химик Й.Берцелиус в 1823 дал описание кремния, полученного им при обработке калиевой соли K2SiF6 металлическим калием при высокой температуре, однако лишь в 1854 кремний был получен в кристаллической форме А.Девилем.
Кремний – второй по распространенности (после кислорода) элемент в земной коре, где он составляет более 25% (масс.). Встречается в природе в основном в виде песка, или кремнезема, который представляет собой диоксид кремния, и в виде силикатов (полевые шпаты M[AlSi3O8] (M = Na, K, Ba), каолинит Al4[Si4O10](OH)8, слюды). Кремний можно получить прокаливанием измельченного песка с алюминием или магнием; в последнем случае его отделяют от образующегося MgO растворением оксида магния в соляной кислоте. Технический кремний получают в больших количествах в электрических печах путем восстановления кремнезема углем или коксом. Полупроводниковый кремний получают восстановлением SiCl4 или SiHCl3 водородом с последующим разложением образующегося SiH4 при 400–600 ° С. Высокочистый кремний получают выращиванием монокристалла из расплава полупроводникового кремния по методу Чохральского или методом бестигельной зонной плавки кремниевых стержней (см. также ЗОННАЯ ПЛАВКА). Элементный кремний получают в основном для полупроводниковой техники, в остальных случаях он используется как легирующая добавка в производстве сталей и сплавов цветных металлов (например, для получения ферросилиция FeSi, который образуется при прокаливании смеси песка, кокса и оксида железа в электрической печи и применяется как раскислитель и легирующая добавка в производстве сталей и как восстановитель в производстве ферросплавов).
Применение.
Наибольшее применение кремний находит в производстве сплавов для придания прочности алюминию, меди и магнию и для получения ферросилицидов, имеющих важное значение в производстве сталей и полупроводниковой техники. Кристаллы кремния применяют в солнечных батареях и полупроводниковых устройствах – транзисторах и диодах. Кремний служит также сырьем для производства кремнийорганических соединений, или силоксанов, получаемых в виде масел, смазок, пластмасс и синтетических каучуков. Неорганические соединения кремния используют в технологии керамики и стекла, как изоляционный материал и пьезокристаллы. См. также КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ.
Свойства.
SiF4 гидролизуется, образуя ортокремниевую и гексафторокремниевую (H2SiF6) кислоты. H2SiF6 по силе близка к серной кислоте. Многие фторосиликаты металлов растворимы в воде (соли натрия, бария, калия, рубидия, цезия малорастворимы), поэтому HF используют для перевода минералов в раствор при выполнении анализов. Сама кислота H2SiF6 и ее соли ядовиты.
Диоксид кремния (кремниевый ангидрид).
Природный диоксид кремния встречается преимущественно в форме кварца, хотя существуют и другие минералы – кристобалит, тридимит, китит, коусит. Кристаллический диоксид кремния широко распространен в природе в виде прозрачных бесцветных или окрашенных монокристаллов (горный хрусталь, аметист, дымчатый кварц, тридимит, кварцит, розовый кварц, агат, яшма, сердолик, кремень, опал и халцедон) и в форме обломочных пород (морской песок, гравий, галька, песчаник и конгломерат). Окраска аметиста объясняется примесями Mn и Fe, а дымчатого кварца – органическими включениями. Опал и кремень являются слабогидратированными формами SiO2. Аморфный кремнезем встречается в диатомовых отложениях на дне морей и океанов (трепел, кизельгур); эти отложения образовались из SiO2, входившего в состав диатомовых водорослей и некоторых инфузорий. Диатомитовая земля и трепел обнаружены в Калифорнии, Орегоне и в разных частях Европы. Ежегодно добывается до 2 млн. т SiO2 для производства абразивов, теплоизоляции, фильтрующих сред, наполнителя полимеров, красок и композиций. См. также КВАРЦ.
Кремниевые кислоты.
Две оксокислоты кремния H4SiO4 (ортокремниевая) и H2SiO3 (метакремниевая, или кремниевая) существуют только в растворе и необратимо превращаются в SiO2, если выпарить воду. Другие кремниевые кислоты получаются за счет различного количества воды в их составе: H6Si2O7 (пирокремниевая кислота из двух молекул ортокремниевой кислоты), H2Si2O5 и H4Si3O8 (ди- и трикремниевая кислоты из двух и соответственно трех молекул метакремниевой кислоты). Все кислоты кремния слабые. При добавлении в раствор силиката серной кислоты образуется гель (желатинообразное вещество), при нагревании и высушивании которого остается твердый пористый продукт – силикагель, имеющий развитую поверхность и используемый как адсорбент газов, осушитель, катализатор и носитель катализаторов.
Силикаты (соли кремниевых кислот).
В тетраэдрической структуре природных силикатов атом кремния окружен четырьмя атомами кислорода; ион щелочного или щелочноземельного металла, слишком малый по сравнению с кислородными атомами, размещается в пространстве между тетраэдрами. Иногда тетраэдры выстраиваются в протяженные цепи (например, асбест), иногда образуется слоистая структура (слюда), в других случаях формируется кольцевая структура (например, берилл). К природным силикатам относятся полевые шпаты, слюды, глины, асбест и др. Силикаты входят в состав горных пород: гранита, гнейса, базальта, различных сланцев и т.д. Многие драгоценные камни (изумруд, топаз, аквамарин и др.) – это прозрачные кристаллы силикатов. Силикаты в большинстве своем (кроме силикатов натрия и калия) нерастворимы в воде. Силикаты натрия и калия внешне напоминают стекло, поэтому их называют растворимым стеклом.
Жидкое стекло
– это водный раствор силиката натрия или калия. Силикат натрия получается сплавлением кварцевого песка со щелочью (NaOH) или содой (Na2CO3) или кипячением смеси кварца с NaOH под давлением. Коммерческий продукт содержит Na2SiO3 с непостоянной примесью SiO2. Растворимое стекло широко используется как наполнитель в мылах. Некоторые моющие средства тоже содержат силикат натрия. Жидкое стекло используют для придания влаго- и огнестойкости деревянным строениям, в технологии кислото- и огнеупорного цемента и бетона, керосинонепроницаемых штукатурок по бетону, для пропитывания тканей, для приготовления огнезащитных красок по дереву, для химического укрепления слабых грунтов.
Гидриды.
Подобно углероду кремний образует ковалентные связи Si–Si и Si–H. Соединения, в которых атомы кремния соединены одинарной связью, называются силанами, а если атомы кремния соединены двойной связью, –силенами. Подобно углеводородам эти соединения образуют цепи и кольца. SiH4 называется моносилан, Si2H6 – дисилан, Si3H8 – трисилан, Si4H10 – тетрасилан и т.д. Соединения, в которых атомы кремния соединены через атом кислорода, называются силоксанами, а через атомы серы – силазанами. Силаны и силены могут образовывать связь с углеводородными радикалами и галогенами, например, метилдихлорсилан CH3SiHCl2. Все силаны могут самовозгораться, образуют взрывчатые смеси с воздухом и легко реагируют с водой.
См. также КЕРАМИКА ПРОМЫШЛЕННАЯ; ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ; СТЕКЛО; ПОЛУПРОВОДНИКОВЫЕ ЭЛЕКТРОННЫЕ ПРИБОРЫ.
Андрианов К.А. Методы элементоорганической химии. Кремний. М., 1968
Воронков М.Г. и др. Кремний и жизнь. Рига, 1978
Самсонов Г.В. и др. Силициды. М., 1979
Айлер Р. Химия кремнезема. М., 1982
Урок №43. Кремний и его соединения. Стекло. Цемент
Общая характеристика кремния
История открытия
Физические свойства
Распространенность
Кремний – второй по распространенности элемент на Земле после кислорода. Его доля составляет 27,7% массы земной коры. В природе кремний встречается только в виде соединений, таких как силикаты, алюмосиликаты и кремнезем – оксид кремния(IV) SiO 2
Получение
1) Промышленность – нагревание угля с песком:
2C + SiO 2 = t˚ = Si + 2CO
2) Лаборатория – нагревание песка с магнием:
2Mg + SiO 2 = t˚ = Si + 2MgO
Химические свойства
Si – восстановитель
Si 0 + O 2 = t˚ = Si +4 O 2
2) Со фтором при обычных условиях
Si 0 + C = t˚ = Si +4 C
4) С водородом не взаимодействует
Силан (SiH 4 ) получают разложением силицидов металлов кислотой:
5) С растворами кислот не реагирует
плавиковая кислота: Si+4HF=SiF 4 +2H 2
с месь азотной и плавиковой кислот растворяет кремний: 3Si + 4HNO 3 + 18HF → 3H 2 [SiF 6 ] + 4NO + 8H 2 O
2NaOH + Si + H 2 O = t˚ = Na 2 SiO 3 + 2H 2
Si – окислитель
С металлами (образуются силициды):
Применение
Наибольшее применение кремний находит в производстве сплавов для придания прочности алюминию, меди и магнию и для получения ферросилицидов, имеющих важное значение в производстве сталей и полупроводниковой техники.
Добавки кремния к сплавам повышают их коррозионную стойкость.
Кремний служит также сырьем для производства кремнийорганических соединений, или силоксанов, получаемых в виде масел, смазок, пластмасс и синтетических каучуков. Неорганические соединения кремния используют в технологии керамики и стекла, как изоляционный материал и пьезокристаллы.
Силикаты, алюмосиликаты и кремнезем – основное сырье для производства стекла и керамики, а также для строительной промышленности.
Физические свойства:
Получение:
Mg 2 Si + 4HCl → 2MgCl 2 + SiH 4 ↑
Химические свойства:
1) Окисление: SiH 4 + 2O 2 = t˚ = SiO 2 + 2H 2 O
2) Разложение: SiH 4 = t˚ = Si + 2H 2
Оксид кремния (IV)
(SiO 2 ) n
SiO 2 – встречается в природе в виде: кварца, горного хрусталя, аметиста, агата, яшмы, опала, кремнезёма (основная часть песка).
Входит в состав: каолинита – Al 2 O 3 • 2SiO 2 • 2H 2 O (основная часть глины) и ортоклаза – K 2 O • Al 2 O 3 • 6SiO 2 (полевой шпат).
Содержание:
Кремний — химический элемент и простое вещество
В периодической системе химических элементов кремний Si расположен в третьем периоде в IVА-группе. Чем же он отличается от углерода? Познакомимся со свойствами этого химического элемента и образуемого им простого вещества подробнее.
Кремний в природе
Кремний после кислорода — самый распространенный элемент в земной коре (массовая доля 27,6 %). Земная кора в основном состоит из соединений кремния с кислородом, в состав которых включаются и другие элементы. В природе кремний встречается преимущественно в виде оксида кремния(IV)
Кремний один из самых распространенных элементов во всей Вселенной. Основной компонент марсианской почвы — кремнезем SiO3, а в лунном грунте на долю этого вещества приходится 41 %. Силикаты металлов обнаружены на Венере и других планетах.
Кремний является важным элементом для нормального существования всех живых организмов. Повышенным содержанием кремния характеризуются морские организмы — диатомовые водоросли, радиолярии, губки (рис. 108). Большое количество кремния накапливают хвощи и злаки, в том числе рис.
Строение атома
В атоме кремния 14 электронов, которые располагаются на трех электронных слоях:
Так же как и у атомов углерода, у атомов кремния на внешнем электронном слое находится по 4 электрона и до его завершения не хватает тоже 4 электрона. Поэтому в своих соединениях кремний проявляет отрицательную степень окисления, равную –4, например в силициде магния 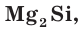
Строение и физические свойства простого вещества
Кристаллическая решетка кремния аналогична кристаллической решетке алмаза (см. рис. 90). В кристалле кремния каждый его атом соединен с другими атомами четырьмя прочными ковалентными связями. В настоящее время получают кремний 99,9999999 %-й чистоты. Это означает, что среди миллиарда атомов кремния может быть лишь один атом другого элемента.
В отличие от алмаза кремний обладает способностью при определенных условиях проводить электрический ток. Электропроводность кремния возрастает при нагревании или освещении. Именно поэтому он используется в полупроводниковой технике, в том числе для преобразования энергии солнечного излучения в электрическую энергию в солнечных батареях.
Химические свойства кремния
Так же как и углерод, кремний реагирует с другими веществами, как правило, при нагревании.
Взаимодействуя с атомами менее электроотрицательных элементов (металлов), атомы кремния принимают электроны (восстанавливаются), приобретая при этом отрицательные степени окисления:
При этом простое вещество кремний проявляет окислительные свойства.
Взаимодействуя с атомами более электроотрицательных элементов, атомы кремния могут отдавать электроны (окисляться), приобретая положительные степени окисления:
При этом простое вещество кремний проявляет восстановительные свойства.
При очень высоких температурах кремний взаимодействует с углеродом, образуя карбид кремния (карборунд):
В этой реакции кремний выступает в качестве восстановителя, а углерод — в качестве окислителя. В качестве восстановителя кремний применяют также при промышленном получении металлов из руд.
Структура простого вещества кремния аналогична структуре алмаза.
При взаимодействии с другими веществами кремний может проявлять как восстановительные, так и окислительные свойства.
Оксид кремния(IV). Кремниевая кислота и ее соли
Среди кислородсодержащих соединений кремния наибольшее значение имеют оксид кремния(IV), кремниевая кислота и ее соли — силикаты.
Оксид кремния(IV)
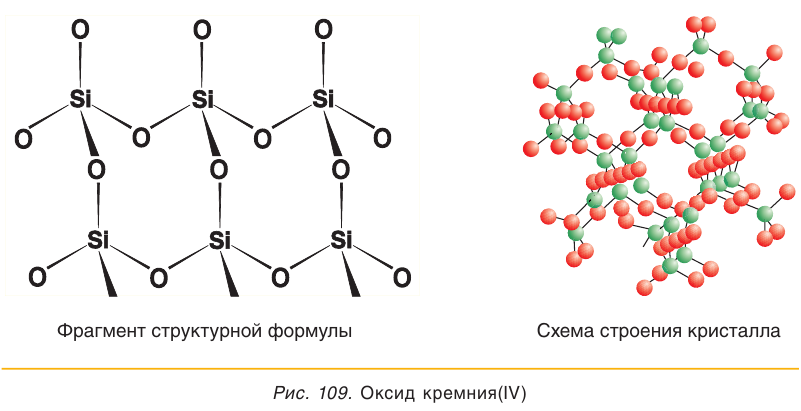
Оксид кремния(IV) представляет собой твердое тугоплавкое вещество (температура плавления 1713 °С), нерастворимое в воде. Высокая температура плавления этого вещества свидетельствует о том, что оно имеет немолекулярное строение.
В кристаллах оксида кремния(IV) атомы кремния и кислорода связаны между собой ковалентными связями (рис. 109). Для описания состава таких веществ, как вы помните, пользуются формульными единицами. Состав формульной единицы 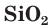
В природе оксид кремния(IV) образует речной песок, горный хрусталь и распространенный на территории Беларуси кремень. Часто в природе минералы на основе SiO3 содержат примеси оксидов железа, алюминия, хрома и других элементов, придающих им определенную окраску. Они используются в качестве поделочных и драгоценных камней (например, цитрин, аметист, яшма, агат и др.).
Оксид кремния(IV) — химически неактивное вещество. Он не растворяется в воде и не взаимодействует с ней. Но как кислотный оксид SiO2 реагирует с основными оксидами, щелочами и некоторыми солями, например карбонатами, при нагревании или сплавлении с образованием солей слабой кремниевой кислоты — силикатов:
Чистый кристаллический оксид кремния(IV) прозрачен, бесцветен, как вода, и в связи с этим применяется для изготовления оптических приборов. Из расплавленного SiO2 получают так называемое кварцевое стекло. Оно выдерживает нагревание до 1000—1200 °С и устойчиво к резкому перепаду температур. У кварцевого стекла есть еще одно важное достоинство: оно пропускает ультрафиолетовые лучи, что позволяет использовать его в производстве медицинской, научно-исследовательской и промышленной аппаратуры.
Кремниевая кислота
Кремниевую кислоту получают, действуя более сильными кислотами на растворы ее солей. Она образует студенистый осадок, содержащий воду (рис. 110). Кремниевая кислота имеет сложный состав, который условно можно выразить простейшей формулой 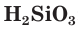
Кремниевая кислота мало растворяется в воде. Она является непрочным соединением — при нагревании или длительном хранении постепенно разлагается на воду и оксид кремния(IV):
Кремниевая кислота очень слабая.
При обезвоживании осадка кремниевой кислоты образуется пористый аморфный оксид кремния(IV) — силикагель. Он имеет развитую поверхность, поэтому отлично поглощает влагу. В химических лабораториях силикагель используют для осушения газов.
Соли кремниевой кислоты
Из солей кремниевой кислоты растворимы только силикаты щелочных металлов. Силикаты калия и натрия называют растворимыми стеклами, а их концентрированные водные растворы — жидким стеклом. Раньше жидкое стекло широко использовалось в качестве силикатного клея. Концентрированный раствор силиката натрия применяется для пропитки деревянных изделий и тканей для придания им огнеупорных свойств. Приготовим две одинаковые полоски бумаги. Одну из них покроем тонким слоем жидкого стекла и высушим на воздухе. Затем одновременно внесем полоски в пламя спиртовки (рис. 111). Что при этом наблюдается?
Если в разбавленный раствор силиката натрия поместить несколько кристаллов окрашенных солей, то через некоторое время в растворе появятся длинные цветные нити в виде веточек. Получается силикатный «сад» (рис. 112). С особенностями протекания этого процесса вы можете познакомиться, если прочитаете дополнительную литературу.
Природные кремнеземы, силикаты и глина являются сырьем для силикатной промышленности.
В составе силикатов часто встречается третий по распространенности в земной коре после кислорода и кремния элемент алюминий. В этом случае они называются алюмосиликатами. Их состав часто записывают в виде соединения оксидов. Например, состав калиевого полевого шпата выражается формулой 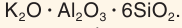

Строительные материалы на основе природных оксидов и солей
С древних времен человек старался использовать окружавшие его воду, растительный и животный мир, почву, камни. Именно из камня он сделал первые орудия труда и охоты. На заре возникновения цивилизации появились нехитрые каменные сооружения. Камни надо было скреплять между собой, чтобы сооружение не разваливалось. В связи с этим в обиходе появились вяжущие вещества. Человек научился пользоваться глиной, делать из нее различные изделия. Еще позже возникло производство кирпича и стекла. Так зарождалось строительное ремесло.
Современная строительная индустрия использует неорганические соединения в самом разнообразном виде: материалы из силикатных расплавов (стекло), керамические изделия, вяжущие вещества. Основным источником сырья для производства строительных материалов являются природные соединения: песок, известняк, силикаты, алюмосиликаты, глина.
Керамические материалы
Слово «керамика» происходит от греческого слова керамос — глина, глиняная посуда. Основным сырьем для производства керамики служит глина, которая способна образовывать с водой пластичную массу. Влажной глине можно придать любую форму. При высокой температуре она необратимо твердеет, что и используется в производстве керамических изделий. После обжига керамические изделия получаются пористыми и водопроницаемыми. Поэтому керамику часто покрывают глазурью — легкоплавкими смесями, которые после специальной термической обработки образуют на поверхности изделий стекловидную массу (рис. 113).
Керамика представляет собой один из древнейших искусственных материалов. Керамические изделия были известны человеку с эпохи неолита. Первыми керамическими материалами были кирпич, плитка, посуда и самые разнообразные емкости (см. рис.).
К керамическим изделиям относятся строительный кирпич, черепица, огнеупорные и облицовочные материалы, сантехническое оборудование (ванны, раковины и др.).
Вяжущие строительные материалы
Вяжущие строительные материалы представляют собой вещества или смеси веществ, способные при смешивании с водой образовывать вязкую массу, которая постепенно затвердевает.
Одним из древнейших строительных материалов является известь. Различают негашеную известь CaO и гашеную известь 
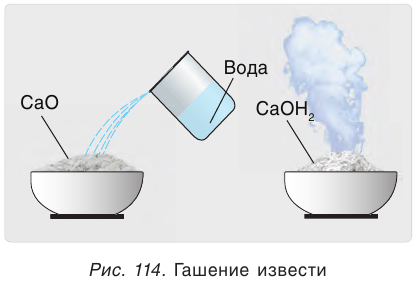
Оксид кальция CaO (негашеную известь) переводят в гидроксид («гасят» водой) и получают гашеную известь
Эта реакция протекает с выделением большого количества теплоты, что приводит к сильному разогреванию смеси (рис. 114). В результате образуется облако водяного пара, как при гашении костра водой. Поэтому данная реакция и называется «гашение извести». Гашеную известь в смеси с песком используют в качестве вяжущего строительного материала.
Другим примером вяжущих строительных материалов является цемент. Если его смешать с водой, то образуется тестообразная масса, которая через некоторое время затвердевает. Это свойство цемента и используется в строительном деле для скрепления, например, кирпичей при сооружении стен. В Беларуси его производят на нескольких предприятиях, крупнейшими из которых являются ОАО «Красносельскстройматериалы» и ОАО «Кричевцементошифер».
Из смеси цемента, песка и воды с добавлением мелкого щебня или гравия получают бетон. Если в бетон ввести каркас из железных стержней, то получается железобетон. Бетон и железобетон широко применяются в строительстве. Введение в бетон химических веществ определенного состава позволяет получать пенобетон, отличающийся легкостью, высокими тепло- и звукоизоляционными свойствами. Важнейшим отличием бетона от известкового раствора является то, что при его затвердевании происходит поглощение воды.
Недавно ученые на основе фосфата магния разработали биобетон. Внешние панели из биобетона после постройки тут же начинают накапливать дождевую воду, становясь идеальной средой для развития лишайников и мхов. Это позволяет создавать вертикальные сады на стенах жилых зданий, реализуя концепцию экогородов (см. рис. вверху). Кроме того, бетон активно используется как дизайнерский материал для изготовления садовой скульптуры (см. рис. внизу), предметов мебели и интерьера.
В качестве вяжущего материала используют также алебастр, который часто называют полуводным гипсом. Его формулу записывают следующим образом 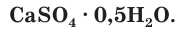
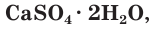
Стекло
Чаще всего мы сталкиваемся со стеклами, полученными на основе различных силикатов, поэтому в быту слово «стекло» употребляется для обозначения именно силикатных стекол.
Кроме красивого внешнего вида, стекло обладает низкой теплопроводностью и высокой прозрачностью, что позволяет использовать его для изготовления оконных стеклопакетов. При нагревании стекло легко вытягивается в тонкие, длинные нити, из которых изготавливают стекловату, стекловолокно и стеклоткани. Стекловата и стекловолокно используются в качестве звуко- и теплоизоляторов. Крупнейшим производителем стеклонитей и стеклотканей различного назначения на территории Беларуси является ОАО «Полоцк-Стекловолокно».
Стекольная промышленность Беларуси имеет давнюю историю. В 1717 г. в деревнях Налибоки и Янковичи (ныне Столбцовский район) по образцу Дрезденской мануфактуры Радзивиллы основали Налибокскую стеклянную мануфактуру, где изготавливались зеркала, подсвечники, художественная и бытовая посуда. В 1737 г. в деревне Уречье (ныне Любанский район) была основана Уречская стеклянная мануфактура, которая выпускала изделия из бесцветного и цветного стекла. Эти мануфактуры существовали до середины XVIII в. В 1883 г. помещик Зенон Ленский построил в поселке Березовка (ныне Лидский район) мануфактуру, которая позже, в 1908 г., стала стеклозаводом «Неман», работающим и по сей день.
Стекло не является индивидуальным соединением, а представляет собой сплав нескольких веществ. Для получения стекла (как говорят на производстве, при «варке» стекла) в качестве исходных материалов используют 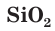
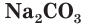
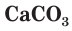
Часто при варке стекла для придания ему специфических свойств и окраски в исходную смесь добавляют разнообразные соли и оксиды.
Понятие о выходе продукта химической реакции
На практике при проведении химических реакций обычно получается несколько меньшее количество продукта, чем рассчитанное теоретически в соответствии с уравнением реакции. Это может происходить по нескольким причинам.
Многие химические реакции обратимы, т. е. протекают не до конца. Потери веществ могут быть также обусловлены их испарением, частичным растворением (ведь абсолютно нерастворимых веществ нет), потерями при упаривании или фильтровании растворов и т. п. Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность оборудования, в котором проходят химические процессы, всегда приводит к потерям газообразных веществ. И наконец, часть веществ может не вступить в реакцию или образовать при взаимодействии побочные продукты.
Для оценки полноты протекания процесса пользуются понятием выход продукта химической реакции. Оно подобно понятию «коэффициент полезного действия», которое применяется в физике для характеристики процессов преобразования и использования энергии, работы различных двигателей и механизмов.
Выход продукта химической реакции обозначается буквой греческого алфавита η (эта). Он представляет собой величину, равную отношению реально полученной, т. е. практической массы вещества 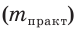
Выход продукта химической реакции — безразмерная величина, например: η(СаО) = 0,75, или 75 %.
Поскольку масса вещества пропорциональна его химическому количеству, то выход продукта реакции можно определять и как отношение соответствующих химических количеств вещества или объемов (для газов):
Например, если известно, что в реакции синтеза аммиака
Таким образом, выход продукта реакции — это величина, равная отношению реально полученной массы (химического количества, объема) вещества к массе (химическому количеству, объему) этого вещества, рассчитанной по уравнению реакции.
Величина выхода продукта реакции не может превышать 100 %. Если выход равен 100 %, то говорят, что реакция протекает количественно. В этом случае
Кроме выражения «выход продукта химической реакции», часто используют и более краткие формы этого понятия: «выход продукта», «выход реакции», «реакция протекает с 90 %-м выходом».
На практике часто приходится рассчитывать химическое количество, массу или объем продукта реакции, если его выход отличается от 100 %, или, наоборот, определять выход продукта реакции. Рассмотрим типы расчетов с использованием этого понятия.
Тип 1. Даны массы (объемы, химические количества) исходного вещества и продукта реакции. Требуется определить выход продукта реакции.
Пример:
При прокаливании гидроксида алюминия 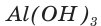
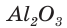
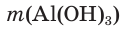
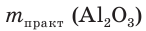
1. Определяем молярные массы гидроксида и оксида алюминия:
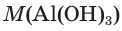
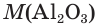
2. Находим химические количества гидроксида и оксида алюминия:
3. Записываем уравнение реакции разложения гидроксида алюминия и производим расчет теоретического химического количества (х) и теоретической массы полученного оксида алюминия:
откуда получим: х = 0,6 моль. Это —
Тогда теоретическая масса оксида алюминия составит:
4. Определяем выход продукта реакции (двумя способами):
а)
б)
Ответ: выход продукта реакции равен 85 %.
Тип 2. Даны масса (объем, химическое количество) исходного вещества и выход продукта реакции. Требуется определить массу (объем, химическое количество) продукта реакции.
Пример:
Рассчитайте массу нитрата аммония 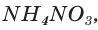
V(NH3) = 4,48 м3 = 4480 дм3
Найдем химическое количество аммиака:
2. Составим уравнение реакции и рассчитаем теоретическое химическое количество
3. Находим теоретическую массу
4. Из формулы для определения выхода продукта реакции выражаем 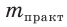
Ответ: практическая масса нитрата аммония равна 14,4 кг.
Тип 3. Даны масса (объем, химическое количество) продукта и выход продукта. Требуется определить массу (объем, химическое количество) исходного вещества.
Пример:
Определите объем (н. у.) водорода, который понадобится для получения аммиака объемом 13,44 м 3 (н. у.), если его практический выход равен 20 %.
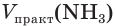

1. Рассчитаем теоретический объем аммиака:
2. Составим уравнение реакции синтеза аммиака и рассчитаем объем (х) водорода:
Ответ: для синтеза аммиака потребуется водород объемом 100,8 м3
Выход продукта реакции — это величина, равная отношению реально полученной в результате реакции массы (химического количества, объема) вещества к массе (химическому количеству, объему) этого вещества, рассчитанной по уравнению реакции
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.