в чем растворяется карбонат кальция
Карбонат кальция, характеристика, свойства и получение, химические реакции
Карбонат кальция, характеристика, свойства и получение, химические реакции.
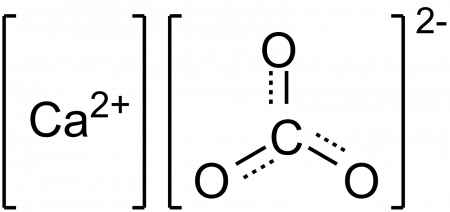
Карбонат кальция – неорганическое вещество, имеет химическую формулу СаСО3.
Краткая характеристика карбоната кальция:
Карбонат кальция – неорганическое вещество белого цвета.
Химическая формула карбоната кальция СаСО3.
Карбонат кальция при прокаливании разлагается. Однако при избыточном давлении углекислого газа (СО2) плавится без разложения.
Встречается в виде трех кристаллических модификаций:
– кальцита (известняк, мел, мрамор);
– фатерита или ватерита.
Кальцит и арагонит являются устойчивыми кристаллическими модификациями. Фатерит является наименее стабильной разновидностью карбоната кальция, и очень быстро превращается в воде либо в кальцит, либо в арагонит. Фатерит в природе встречается относительно редко.
Зарегистрирован как белый пищевой краситель E170.
Физические свойства карбоната кальция:
| Наименование параметра: | Значение: |
| Химическая формула | СаСО3 |
| Синонимы и названия иностранном языке | calcium carbonate (англ.) |
углекислый кальций (рус.)
Получение карбоната кальция:
Промышленный способ получения карбоната кальция заключается в разработке его месторождений в природе.
В лаборатории карбонат кальция получают гашением негашеной извести и последующим продуванием углекислого газа.
Так как гидроксид кальция растворяется в воде в небольшом количестве, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода (углекислого газа). В результате образуется карбонат кальция, который выпадает в осадок.
Химические свойства карбоната кальция. Химические реакции карбоната кальция:
Карбонат кальция – это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная кислота H2CO3).
Водные растворы CaCO3 имеют слабую щелочную реакцию.
1. реакция термического разложения карбоната кальция – обжиг известняка:
В результате реакции образуются оксида кальция и оксид углерода (IV). Обжиг известняка – это промышленный способ получения углекислого газа. Технологически этот процесс в промышленности реализуют в специальных шахтных печах.
2. реакция карбоната кальция и углерода (графита, кокса):
CaCO3 + C → CaO + 2CO (t = 800-850 °C).
В результате реакции образуются оксид кальция и оксида углерода (II).
3. реакция карбоната кальция и фтороводорода:
4. реакция взаимодействия карбоната кальция и сероводорода:
В результате реакции образуются сульфид кальция, вода и оксид углерода (IV).
Аналогичные реакции протекают и с другими галогеноводородами.
5. реакция взаимодействия карбоната кальция и азотной кислоты:
6. реакция взаимодействия карбоната кальция и угольной кислоты:
В результате реакции образуется гидрокарбонат кальция.
7. реакция взаимодействия карбоната кальция и бромной кислоты:
В результате реакции образуются бромат кальция, вода и оксид углерода (IV).
Аналогично проходят реакции карбоната кальция и с другими кислотами.
8. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
В результате реакции образуется гидрокарбонат кальция. Реакция протекает при комнатной температуре.
9. реакция взаимодействия карбоната кальция и оксида кремния:
В результате реакции образуются метасиликат кальция и оксида углерода (IV).
10. реакция взаимодействия карбоната кальция и оксида титана:
В результате реакции образуются титанат кальция и оксида углерода (IV). Реакция протекает при сплавлении реакционной смеси.
11. реакция взаимодействия карбоната кальция, оксида серы и кислорода:
В результате реакции образуются сульфат кальция и оксида углерода (IV). Данная реакция представляет собой метод очистки смеси газов от SO2.
12. реакция взаимодействия карбоната кальция, оксида свинца и кислорода:
13. реакция взаимодействия карбоната кальция и гидроксида натрия:
В результате реакции образуются карбонат натрия и гидроксид кальция. При этом гидроксид натрия в качестве исходного вещества используется в виде водного раствора.
14. реакция взаимодействия карбоната кальция и хлорида аммония:
В результате реакции образуются хлорид кальция, аммиак, вода и оксид углерода (IV). Реакция протекает при кипении.
15. реакция взаимодействия карбоната кальция и сульфида калия:
В результате реакции образуются карбонат калия и сульфид кальция.
16. реакция взаимодействия карбоната кальция и сульфида натрия:
В результате реакции образуются карбонат натрия и сульфид кальция.
Применение и использование карбоната кальция:
Карбонат кальция используется во множестве отраслей промышленности и для бытовых нужд:
– для письма на досках;
– в быту для побелки потолков, покраски стволов деревьев;
– в целлюлозно-бумажной промышленности – в производстве бумаги в качестве отбеливателя, наполнителя, а также раскислителя;
– в качестве пищевой добавки в пищевой промышленности;
– при производстве предметов гигиены (например, зубной пасты) и лекарственных средств;
– при производстве силикатного стекла ;
– в качестве наполнителя при производстве шпаклёвок и герметиков,
Карбонат Кальция
Химическое название
Химические свойства
Кальция Карбонат, что это такое? Это неорганическое хим. соединение, соль, образованная Ca и угольной кислотой. Химическая формула Карбоната Кальция: CaCO3. В природе вещество можно обнаружить в кальците, ватерите, арагоните, мраморе, известняке, обычном меле, яичной скорлупе. Это достаточно распространенный минерал, в соответствии с химической формулой имеет три полиморфные модификации.
По внешнему виду – белые кристаллы без запаха или мелкий порошок. Вещество не растворяется в воде, спирте, растворимо в разбавленной азотной и соляной кислоте (при этом выделяется углекислый газ). Согласно Википедии, молярная масса вещества = 100,1 грамм на моль.
Углекислый кальций изготавливают из минералов, в основном мрамора. В лабораторных условиях соединение можно получить с помощью реакции кальцинации оксида Ca, в итоге образуется гидроксид Ca, через который проводят СО2 и осаждается карбонат. Для химических свойств характерна реакция разложения Карбоната Кальция, при которой под действием высокой температуры, вещ-во расщепляется на негашеную известь и углекислый газ. Также для химического соединения характерна реакция с водой и СО2, с образованием гидрокарбоната Ca.
Фармакологическое действие
Противоязвенное, восполняющее дефицит кальция, антацидное.
Фармакодинамика и фармакокинетика
При попадании средства в пищеварительный тракт происходит нейтрализация соляной кислоты, снижается кислотность желудочного сока в целом. Эффект от применения Карбоната Кальция наступает достаточно быстро, однако при прекращении действия может возникнуть обратное действие, секреция желудочного сока усиливается. Вещество нормализует уровень электролитов, угнетает активность остеокластов, замедляет процессы разрушения костной ткани.
Показания к применению
Углекислый кальций назначают:
Противопоказания
Побочные действия
Карбонат Кальция может спровоцировать развитие аллергических реакций, диспепсии (газообразование, боли, диарея, запор), вторичного усиления желудочной секреции, гиперкальциемии, алкалоза.
Карбонат Кальция, инструкция по применению (Способ и дозировка)
Индивидуальный режим дозирования. В качестве антацида углекислый кальций назначают в дозировке от 500 мг до 1 грамма. При профилактике остеопороза применяют до 1,2 грамм в сутки.
Для детей дозировку корректируют. Назначают 300-600 мг вещества в день.
Передозировка
При передозировке может возникнуть гиперкациемия (прием более 2 грамм в сутки). Симптомы: общая слабость, головные боли, анорексия, отсутствие аппетита, рвота, запоры, чувство жажды, вялость, полиурия, болезненные ощущения в суставах и мышцах, сбои сердечного ритма, заболевания почек.
Показано промыть желудок, дать пострадавшему энтеросорбенты, проводить симптоматическое лечение.
Взаимодействие
Сочетанный прием средства с тетрациклиновыми антибиотиками может привести к снижению их эффективности и плазменной концентрации.
При сочетании препарата с тиазидными диуретиками выше риск развития метаболического алкалоза и гиперкальциемии.
Карбонат Кальция замедляет процессы абсорбции других лекарств.
При сочетании средства с левотироксином, оно снижает эффект от приема анаболика.
Особые указания
При продолжительном лечении средством рекомендуют контролировать плазменную концентрацию кальция.
При приеме больших доз препарата и больших количеств молочной продукции может развиться гиперкальциемия и молочно-щелочной синдром.
Нельзя применять лекарство в таблетированной форме для лечения рахита, кариеса и остеопороза в качестве антацида.
Детям
Для детей нужно скорректировать дозировку.
При беременности и лактации
Вещество часто назначают беременным женщинам и кормящим мамам.
Препараты, в которых содержится (Аналоги)
Торговые названия средства: Кальция карбонат, Витакальцин, Аддитива кальций, Скоралайт, УПСАВИТ Кальций. В комбинации с магния карбонатом: Тамс, Ренни, Рамни, Эндрюс антацид. В сочетании с колекальциферолом средство входит в состав следующих лекарств: Идеос, Ревиталь Кальций Д3, Кальций-Д3 Никомед, Натекаль Д3, Компливит кальций Д3. С магния гидроксидом: Гастрик, Витрум Маг. Комплексные средства: Альфадол-Са, Витрум Бьюти Люкс, Витрум Остеомаг, Гевискон, Кальцемин и так далее.
Отзывы
Вещество часто назначают для лечения дефицита кальция детям и взрослым пациентам, это хорошее средство от изжоги. Лекарство хорошо переносится, его добавляют в состав различных препаратов, разной ценовой категории. Пациенты отмечают высокую эффективность и отсутствие побочных реакции при использовании любых препаратов на его основе.
Цена Карбоната Кальция, где купить
Купить Кальция Карбонат пищевой на развес можно по цене 250 рублей за кг. Стоимость таблеток Ренни составляет порядка 150 рублей за 12 таблеток.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Карбонат кальция
| Карбонат кальция | |||
|---|---|---|---|
| |||
 | |||
| Систематическое наименование | карбонат кальция | ||
| Традиционные названия | углекислый кальций | ||
| Хим. формула | CaCO3 | ||
| Состояние | твёрдые белые кристаллы | ||
| Молярная масса | 100.0869 г/моль | ||
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ | ||
| Температура | |||
| • плавления | (кальцит) 825 °C, (арагонит) 1339 °C | ||
| • разложения | 900−1000 °C | ||
| Давление пара | 0 ± 1 мм рт.ст. | ||
| Константа диссоциации кислоты pKa | 9.0 | ||
| Растворимость | |||
| • в воде | (25 °C) 0,0014 г | ||
| Показатель преломления | 1,60 | ||
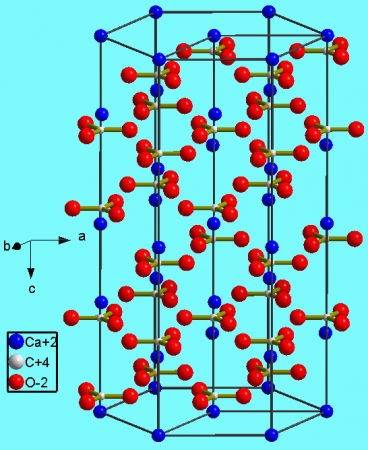
| Кристаллическая структура | тригональная, пространств. гр. 2/m | ||
| ГОСТ | ГОСТ 4530-76 | ||
| Рег. номер CAS | 471-34-1 | ||
| PubChem | 10112 | ||
| Рег. номер EINECS | 207-439-9 | ||
| SMILES | |||
| Кодекс Алиментариус | E170 | ||
| RTECS | FF9335000 | ||
| ChEBI | 3311 | ||
| ChemSpider | 9708 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Содержание
Применение
Используется как белый пищевой краситель E170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов.
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
Химические свойства
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ: