в чем растворяется диоксид титана
Как разводить диоксид титана для мыла для начинающих в мыловарении
Диоксид титана в мыловарении – важный ингредиент, без которого невозможно окрасить мыльную основу в белоснежный цвет. Никакой другой краситель не дает такого насыщенного белого. Диоксид титана – это минеральный пигмент, который используется в пищевой промышленности, в косметологии, в изготовлении различных красителей. Для мыла я использую чистый диоксид титана, который является пищевой добавкой. Как разводить диоксид титана для мыла читайте далее. Видео в конце текста.
Внешний вид диоксида титана
Внешне диоксид титана это сухой белый порошок, который легко разводится в воде, в глицерине, спирте. Нельзя диоксид титана в сухом виде сразу кидать в мыльную основу, его нужно предварительно развести, чем мы сейчас и займемся.
До того, как развести диоксид титана для мыла, приготовьте горячую воду. Именно в горячей порошок «разойдется» сразу без комочков. У меня пакетик диоксида титана, весом 10 г. Вы можете приобрести такой в моем магазинчике.
Разведение диоксида титана в воде
Разводить я буду его в небольшом пластиковом стаканчике обычной горячей водой. Возьму примерно чайную ложечку порошка и добавлю к нему примерно три ложечки воды. Диоксид мгновенно окрашивает жидкость в белый цвет. Если вы увидите, что порошок не весь растворился, то добавьте немного воды. Но не нужно лить слишком много – раствор должен быть концентрированным.
Хранение готового жидкого диоксида титана
Для работы такой раствор диоксида титана уже подойдет. Но если вы хотите его использовать и далее в жидком состоянии, то лучше, если в этот раствор добавите глицерина. В этом случаем краситель еще долго останется в рабочем состоянии и не высохнет. Храните жидкость в плотно закрытом флаконе, после пользования обязательно протирайте горлышко флакона или носик-капельницу, чтобы она не забивалась засохшей краской.
Для окрашивания 100 грамм прозрачной мыльной основы достаточно добавить от нескольких капель до чайной ложечки глицериновой суспензии, это зависит от концентрации получившегося раствора. С базовым рецептом мыловарения в домашних условиях можете ознакомиться, открыв статью «Мыловарение для начинающих Как сделать мыло в домашних условиях — пошаговая инструкция».
Кстати, диоксид титана является одновременно пищевым красителем или пищевой добавкой и минеральным пигментом. Обратите внимание — не косметическим, о которых я рассказываю в другом своем мастер-классе «Пигментная паста: как пользоваться, чем разбавить»
Советы от Хельги
Видео мастер-класс «Мыловарение для начинающих. Как разводить диоксид титана для мыла»
Возможно, вам будут интересны и эти статьи:
Оксид титана IV
| Оксид титана IV | |
|---|---|
 | |
| Систематическое наименование | Диоксид титана |
| Хим. формула | TiO2 |
| Рац. формула | TiO2 |
| Состояние | твёрдое |
| Молярная масса | 79,866 г/моль |
| Плотность | (Р) 4,235 г/см³ (А) 4,05 г/см³ (Б) 4,1 г/см³ |
| Т. плав. | 1843 °C |
| Т. кип. | 2972 °C |
| Т. разл. | 2900 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Рег. номер CAS | 13463-67-7 |
| PubChem | 26042 |
| Рег. номер EINECS | 236-675-5 |
| SMILES | |
| Кодекс Алиментариус | E171 |
| RTECS | XR2775000 |
| ChEBI | 32234 |
| ChemSpider | 24256 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Оксид титана IV (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 — амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана идёт лишь около 5 % титановой руды).
Содержание
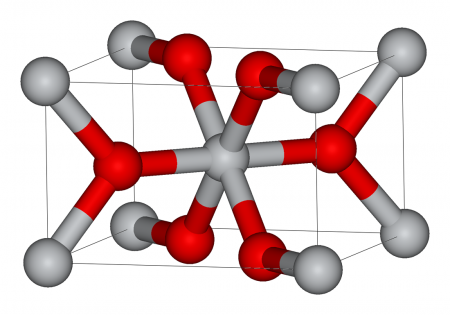
Строение
Оксид титана существует в виде нескольких модификаций. В природе встречаются кристаллы с тетрагональной сингонией (анатаз, рутил) и ромбической сингонией (брукит). Искусственно получены ещё две модификации высокого давления — ромбическая IV и гексагональная V.
| Модификация/Параметр | Рутил | Анатаз | Брукит | Ромбическая IV | Гексагональная V | |
|---|---|---|---|---|---|---|
| Параметры элементарной решётки, нм | a | 0,45929 | 0,3785 | 0,51447 | 0,4531 | 0,922 |
| b | — | — | 0,9184 | 0,5498 | — | |
| c | 0,29591 | 0,9486 | 0,5145 | 0,4900 | 0,5685 | |
| Число формульных единиц в ячейке | 2 | 4 | 8 | |||
| Пространственная группа | P4/mnm | I4/amd | Pbca | Pbcn | ||
Октаэдры расположены таким образом, что каждый ион кислорода принадлежит трём октаэдрам. В анатазе на один октаэдр приходятся 4 общих ребра, в рутиле — 2.
Нахождение в природе
В чистом виде в природе встречается в виде минералов рутила, анатаза и брукита (по строению первые два имеют тетрагональную, а последний — ромбическую сингонию), причём основную часть составляет рутил.
Третье в мире по запасам рутила месторождение находится в Рассказовском районе Тамбовской области. Крупные месторождения находятся также в Чили (Cerro Bianco), канадской провинции Квебек, Сьерра-Леоне.
Свойства
Физические, термодинамические свойства
Чистый диоксид титана — бесцветные кристаллы (желтеют при нагревании). Для технических целей применяется в раздробленном состоянии, представляя собой белый порошок. Не растворяется в воде и разбавленных минеральных кислотах (за исключением плавиковой).
Температура плавления, кипения и разложения для других модификаций не указана, так как они переходят в рутильную форму при нагревании (см. выше).
| 298—500 | 298—600 | 298—700 | 298—800 | 298—900 | 298—1000 | |
|---|---|---|---|---|---|---|
| Модификация | Интервал температуры, K | |||||
| рутил | 60,71 | 62,39 | 63,76 | 64,92 | 65,95 | 66,89 |
| анатаз | 63,21 | 65,18 | 66,59 | 67,64 | 68,47 | 69,12 |
| Модификация | ΔH°f, 298, кДж/моль | S°298, Дж/моль/K | ΔG°f, 298, кДж/моль | C°p, 298, Дж/моль/K | ΔHпл., кДж/моль |
|---|---|---|---|---|---|
| рутил | -944,75 (-943,9) | 50,33 | -889,49 (-888,6) | 55,04 (55,02) | 67 |
| анатаз | -933,03 (938,6) | 49,92 | -877,65 (-888,3) | 55,21 (55,48) | 58 |
Вследствие более плотной упаковки ионов в кристалле рутила увеличивается их взаимное притяжение, снижается фотохимическая активность, увеличиваются твёрдость (абразивность), показатель преломления (2,55 — у анатаза и 2,7 — у рутила), диэлектрическая постоянная.
Химические свойства
Диоксид титана амфотерен, то есть проявляет как осно́вные, так и кислотные свойства (хотя реагирует главным образом с концентрированными кислотами).
Медленно растворяется в концентрированной серной кислоте, образуя соответствующие соли четырёхвалентного титана:
При сплавлении с оксидами, гидроксидами, карбонатами образуются титанаты — соли титановой кислоты (амфотерного гидроксида титана TiO(OH)2)
C пероксидом водорода даёт ортотитановую кислоту:
При нагревании с аммиаком даёт нитрид титана:
При нагревании восстанавливается углеродом и активными металлами (Mg, Ca, Na) до низших оксидов.
При нагревании с хлором в присутствии восстановителей (углерода) образует тетрахлорид титана.
Нагревание до 2200 °C приводит сначала к отщеплению кислорода с образованием синего Ti3O5 (то есть TiO2·Ti2O3), а затем и тёмно-фиолетового Ti2O3.
Гидратированный диоксид TiO2·nH2O [гидроксид титана(IV), оксо-гидрат титана, оксогидроксид титана] в зависимости от условий получения может содержать переменные количества связанных с Ti групп ОН, структурную воду, кислотные остатки и адсорбированные катионы. Полученный на холоде свежеосажденный TiO2·nH2O хорошо растворяется в разбавленных минеральных и сильных органических кислотах, но почти не растворяется в растворах щелочей. Легко пептизируется с образованием устойчивых коллоидных растворов.
При высушивании на воздухе образует объёмистый белый порошок плотностью 2,6 г/см³, приближающийся по составу к формуле TiO2·2H2O (ортотитановая кислота). При нагревании и длительной сушке в вакууме постепенно обезвоживается, приближаясь по составу к формуле TiO2·H2O (метатитановая кислота). Осадки такого состава получаются при осаждении из горячих растворов, при взаимодействии металлического титана с HNO3 и т. п. Их плотность
3,2 г/см³ и выше. Они практически не растворяются в разбавленных кислотах, не способны пептизироваться.
При старении осадки TiO2·nH2O постепенно превращается в безводный диоксид, удерживающий в связанном состоянии адсорбированные катионы и анионы. Старение ускоряется кипячением суспензии с водой. Структура образующегося при старении TiO2 определяется условиями осаждения. При осаждении аммиаком из солянокислых растворов при рН Токсические свойства, физиологическое действие, опасные свойства
Регистрационный номер ООН — UN2546
При вдыхании
TLV (предельная допустимая концентрация): как TWA (средневзвешенная во времени концентрация, США) — 10 мг/м³ A4 (ACGIH 2001).
ПДК в воздухе рабочей зоны — 10 мг/м³ (1998)
IARC (МАИР) относит оксид титана к группе 2B (потенциально канцерогенный) в случае вдыхания наночастиц.
В качестве пищевой добавки E171
Оценки безопасности пищевой добавки E171 (Оксид титана) со стороны EFSA: разрешен к пищевому применению директивой 94/36/EEC (в отдельных формах), ADI не установлен, MoS 2250 мг/кг.
В конце 2010-х появилось несколько публикаций INRA об исследовании оксида титана на мышах или на малом числе пациентов. Агентство EFSA направило авторам статей ряд вопросов и не нашло причин для переоценки рисков на основании данных публикаций, остается в силе мнение 2016 года.
По данным Роспотребнадзора пищевая добавка E171 разрешена для применения на территории России.
Добыча и производство
Мировое производство диоксида титана на конец 2004 года достигло приблизительно 5 миллионов тонн.
Основные производители и экспортёры диоксида титана:
В последние годы чрезвычайно быстро растет производство диоксида титана в Китае.
Сумской государственный институт минеральных удобрений и пигментов (МИНДИП) в своих научно-исследовательских работах особое место уделяет технологиям получения оксида титана (IV) сульфатным способом: исследование, разработка новых марок, модернизация технологии и аппаратурного оформления процесса.
Существуют два основных промышленных метода получения TiO2: из ильменитового (FeTiO3) концентрата и из тетрахлорида титана. Поскольку запасов ильменита для удовлетворения нужд промышленности явно недостаточно, значительная часть TiO2 производится именно из тетрахлорида титана.
Производство диоксида титана из ильменитового концентрата
Первый завод по производству титановых белил из природного титанового минерала ильменита FeTiO3 был построен в Норвегии в 1918 г., однако первые промышленные партии белил имели жёлтый цвет и плохо подходили для живописи, так что фактически белые титановые белила стали использоваться художниками лишь в 1922—1925 гг. При этом следует указать, что до 1925 г. были доступны лишь композитные титановые пигменты на базе барита или кальцита.
До 1940-х гг. двуокись титана выпускалась в кристаллической модификации — анатаз (β-TiO2) тетрогональной сингонии с показателем преломления
Технология производства состоит из трёх этапов:
Производство диоксида титана из тетрахлорида титана
В 1938—1939 гг. способ производства изменился — появился так называемый хлорный метод производства белил из тетрахлорида титана, благодаря чему титановые белила стали выпускаться в кристаллической модификации рутил (α-TiO2) — также тетрагональной сингонии, но с другими параметрами решётки и несколько бо́льшим по сравнению с анатазом показателем преломления 2,61.
Существуют три основных метода получения диоксида титана из его тетрахлорида:
Применение
Основные применения диоксида титана:
Другие применения — в производстве резиновых изделий, стекольном производстве (термостойкое и оптическое стекло), как огнеупор (обмазка сварочных электродов и покрытий литейных форм), в косметических средствах (мыло и т. д.), в фармакологической промышленности в качестве пигмента и наполнителя некоторых лекарственных форм (таблетки и т.д.), в пищевой промышленности (пищевая добавка E171). Используется в процессах очистки воздуха методом фотокатализа.
Ведутся исследования по использованию диоксида титана в фотохимических батареях — ячейках Гретцеля, в которых диоксид титана, являющийся полупроводником с широкой запрещенной зоной 3-3,2 эВ (в зависимости от кристаллической фазы) и развитой поверхностью, сенсибилизируется органическими красителями.
Подделки
Диоксид титана — ценный белый пигмент, не меняющий цвета со временем, в отличие от аналогичного пигмента оксида цинка, в связи с этим существует проблема фальсификации. Способом быстрого выявления фальсификации титановых белил цинковыми, в том числе, в составе красок, является нагрев исследуемого образца: оксид цинка обладает свойством желтеть при нагреве, а диоксид титана при нагреве не желтеет.
Цены и рынок
Цены на диоксид титана отличаются в зависимости от степени чистоты и марки. Так, особо чистый (99,999 %) диоксид титана в рутильной и анатазной форме стоил в сентябре 2006 года 0,5—1 доллара за грамм (в зависимости от размера покупки), а технический диоксид титана — 2,2—4,8 доллара за килограмм в зависимости от марки и объёма покупки.
Диоксид титана — популярный отбеливатель
Диоксид титана, TiO2 — химическое соединение, получаемое из титановой 
Характеристики вещества
Диоксид титана встречается в природе, это минералы: рутил, анатаз, брукит. В основном используют рутил (реже анатаз), из-за более плотной кристаллической решетки, которая обуславливает его более высокие параметры твердости, плотности, стабильности. Рутил выигрывает по показателю преломления и фотохимической активности (она у него более низкая, чем у анатаза).
Из химических свойств TiO2 следует отметить химическую инертность, он вступает в реакцию только с концентрированными кислотами и щелочами. Не растворяется в слабых кислотах и щелочах, за исключением плавиковой кислоты, в органических растворителях, воде. Из физических свойств — способность отсекать УФ-излучение, очень белый цвет мелкодисперсионного порошка. Не имеет вкуса и запаха; не гигроскопичен, не горит, не взрывоопасен, не токсичен.
Применение
Диоксид титана самого высокого качества применяют в виде популярной пищевой добавки E171 для отбеливания пищевых продуктов. Например, двуокисью титана отбеливают филе трески для крабовых палочек. Добавлением в муку среднего качества можно придать ей белизну, характерную для продукта более высокого сорта. E171 добавляют в жевательные резинки, в витамины и таблетки, в белый шоколад, сухое молоко, крем, майонез, мороженое, мясные продукты, такие как, например, шпик и паштеты.

Больше половины всего выпускаемого промышленностью оксида титана идет на производство лакокрасочных материалов, порошковых и водоэмульсионных красок, обладающих высокой светостойкостью, белизной, долговечностью.
TiO2 широко применяется при производстве пластмасс, бумаги, синтетических волокон, линолеума, резин, стекол, керамики, твердых сплавов. Белые рамы пластиковых окон, не желтеющие год за годом, жалюзи и обои, скорее всего, изготовлены с применением титановых белил.
Вреден ли оксид титана?
Время от времени публикуются статьи, пытающиеся поставить под сомнение безопасность диоксида титана в пищевых и косметических продуктах. Сейчас принято считать, что ежедневно вдыхать мелкодисперсионный порошок TiO2, а также употреблять его внутрь в дозах, превышающих 1% веса, вредно. Он может оказывать канцерогенное действие, вызывать заболевания печени и почек.
Тем не менее, пищевая добавка E171 разрешена к применению в РФ и ЕС. 
В магазине химических реактивов и лабораторного оборудования «ПраймКемикалсГрупп» можно купить высококачественный диоксид титана, различные химические вещества, посуду, лабораторные приборы по доступным ценам.