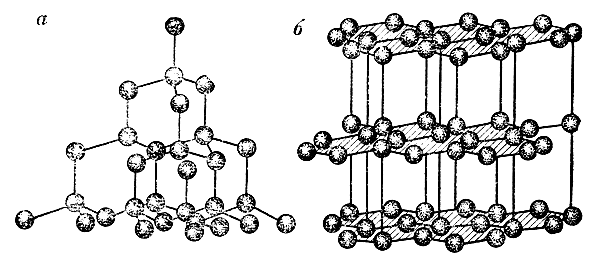в чем растворяется алмаз
Опыты растворения алмаза
Мы знаем, что алмаз, как показывает само его название, исключительно устойчив и весьма трудно разрушается. Нам не известно ни одного растворителя алмаза и ни одного химического реактива, который мог бы разрушить его при обыкновенной температуре. Зато выше 700—800° он довольно легко сжигается, и уже в пламени паяльной трубки можно легко сжечь мелкий порошок алмаза. Еще легче разрушить алмаз, сплавляя его с содой или селитрой при тех же температурах. Наконец, целый ряд сплавов при высоких температурах, повидимому, обладает способностью растворять алмаз, хотя и в незначительных количествах, — таковы сплавленные металлы и силикаты. Конечно, каждый из этих деятелей неизбежно изменяет характер растворения или сгорания алмаза, и, по всей вероятности, кристаллические образования, сопутствующие этим процессам, меняются в зависимости от того или иного деятеля или даже при тех или иных условиях, при которых этот деятель оказывает свое разрушительное влияние. Но в общем, в наиболее типическом случае разрушение кристаллов должно итти по той схеме, которая изложена выше.
Для наших опытов мы воспользовались сплавом калиевой селитры; при этом мы помещали в сплав, не переставая помешивать его, идеально образованные октаэдры чистого алмаза. Уж через 20—30 минут нагревания, при 800— 900° С, эти кристаллики начинали проявлять резко выраженное явление вытравления, и это вытравление шло закономерно, согласно тем теоретическим представлениям, которые нами были вложены в объяснение природных кристаллов алмаза.
Таким образом, нам удалось экспериментально подтвердить, что округлые грани алмаза связаны с процессами растворения, и неизбежно перед нами встал вопрос, как протекают эти процессы в природе и какие деятели являются там растворителями. Вот к этим вопросам мы и намерены теперь обратиться.
Материал взят из книги Кристаллография алмаза (А.Ё. Ферсман)
Король минералов
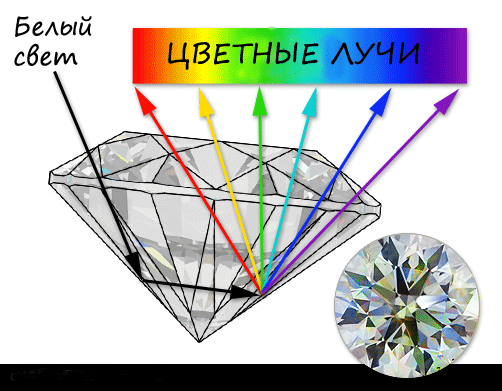
Как известно, луч света состоит из лучей разного цвета. Они составляют спектр, в котором крайними являются красный и фиолетовый лучи. Проходя через разные прозрачные материалы, световой луч преломляется по-разному, причем каждому цвету присущ свой, определенный характер преломления. Материал, пропускающий лучи, характеризуется показателями их преломления и разностью показателей преломления красного и фиолетового лучей. Разность показателей преломления красного и фиолетового лучей определяет дисперсию материала. «Игра» алмазного кристалла объясняется высокими показателями преломления и высокой дисперсией. Луч белого света, преломляясь в алмазе, дает более широко расходящийся пучок спектральных лучей и поэтому более заметно переливается всеми цветами радуги.
Алмаз (вверху) и кварц (внизу). ‘Игра’ алмаза зависит от сильного преломления лучей в кристалле. Пройдя алмаз, они расходятся веером. Это и есть дисперсия
Сокровища Алмазного фонда СССР. 1. Алмаз ‘Орлов’ (189,62 карата), вставленный в скипетр, XVI в.
Самым дорогим обычно считается бесцветный алмаз. Однако в природе бывают кристаллы алмаза ярких чистых тонов красного, зеленого, голубого и оранжевого цветов. Эти камни за свои качества ценятся еще выше.
2. Алмаз ‘Шах’ (88,7 карата), XVII в. Имеет большую историческую, художественную и материальную ценность
Этого добиваются, придав алмазу форму с 58 гранями, положение которых определяется с геометрической точностью.
Состав и структура алмаза. Эти легендарные кристаллы, как и все алмазы вообще, состоят из углерода, который очень распространен в природе. Из атомов углерода образуется и графит, и каменный уголь, причем по числу атомов молекулы графита и каменного угля совершенно не отличаются от молекулы бесцветного алмаза. Такой алмаз представляет собой чистейший углерод, а окраску кристаллу придают примеси.
Кристаллическая решетка алмаза (вверху) и графита (внизу). С кристаллической структурой алмаза связаны его удивительные свойства
Уникальные свойства алмаз получил в результате необычных условий, в которых он формировался миллионы лет назад. Огромная температура и высокое давление в недрах Земли заставили атомы углерода построиться в правильные кубические решетки, придавшие минералу непревзойденную твердость.
Школа твердости минералов
Известен и другой способ определения твердости. В отшлифованную поверхность исследуемого тела вдавливают с постоянной силой алмазную четырехгранную пирамиду. Чем меньше площадь образующейся ямки, тем выше твердость опытного образца. Чтобы получить численный показатель его твердости, силу (в кг), с которой вдавливали пирамиду, делят на площадь ямки (в мм 2 ).
Данный показатель (в кг/мм 2 ) несколько меняется в зависимости от силы прижима алмазной пирамиды. Особенно сильно измененным получается он у тел с неодинаковыми по всей глубине свойствами. Например, стекло, закаленное быстрым охлаждением расплава, имеет более плотный поверхностный слой: он остыл, сжался и затвердел в первую очередь, а внутренние части, заключенные в образовавшуюся «корочку», сохранили состояние меньшей плотности. В таких случаях удобнее измерять твердость при очень малом вдавливании алмазной пирамиды. Что же касается площади ямки, то она измеряется под микроскопом с сильным увеличением. Специальные приборы для измерения этой микротвердости были разработаны учеными Института машиноведения АН СССР М. М. Хрущёвым и Е. С. Берковичем.
Как видим, алмаз и здесь является эталоном твердости. По новой шкале, в частности, легко количественно охарактеризовать твердость тел, которые по этому показателю должны располагаться между алмазом и корундом.
В своей поэме «О природе вещей» он писал:
Алмаз химически стойкий. Он очень устойчив химически. Алмаз не растворяется даже при кипячении в серной, азотной, плавиковой кислотах или их смесях, разрушающе действующих на другие минералы. Для него не опасна и кипящая хлорная кислота, легко растворяющая графит. Алмаз медленно окисляется в расплавах щелочей и более стоек, чем графит, при окислении кислородом. Ни молекулы, ни атомы водорода не действуют на алмаз, тогда как графит легко превращается в газ при взаимодействии с атомами водорода.
Без доступа кислорода алмаз выдерживает кратковременный нагрев даже до 2000° С. Однако в среде, где присутствует кислород, при температурах выше 1500° С алмаз легко окисляется и переходит в графит.
Если механическая твердость и химическая стойкость алмазного кристалла ценились раньше только в ювелирном деле, то с началом технического использования алмаза они играют особую роль. Будучи самым твердым телом, алмаз используется не только для определения твердости других тел, но и для обработки материалов резанием, сверлением, грубой и тонкой шлифовкой, полировкой.
Для применения алмаза в некоторых новых технических направлениях имеют большое значение и другие его уникальные свойства, такие, как высочайшая теплопроводность в сочетании с высоким электрическим сопротивлением. Например, алмазы при температурах выше 100° (по шкале Кельвина) обладают теплопроводностью более высокой, чем даже серебро и медь, причем коэффициент теплового расширения очень мал. Благодаря этому алмаз не боится резких нагревов внешними источниками тепла.
Алмаз является великолепным изолятором и поэтому очень нужен в микроэлектронике. Достаточно сообщить отдельным участкам поверхности алмаза полупроводниковые свойства, и их можно использовать для получения микросхем. Кристаллы алмаза находят и другое применение в области радиоэлектроники.
Так алмаз, продолжая свою многовековую историю самого красивого драгоценного камня, приобретает и различные специальности.
Основные свойства и классификация природных алмазов
Общие физические свойства
Таблица 1. Свойства алмаза и графита
Природа алмаза долгое время оставалась загадочной. Вначале его приравнивали по составу к горному хрусталю (чистому кварцу), и только в XVII в. была открыта принадлежность алмаза к горючим телам. В 1649 г. флорентийские академики в своем знаменитом опыте по сжиганию алмаза в солнечных лучах, сфокусированных с помощью линзы, установили, что алмазы исчезают при сильном нагревании, но при этом они дали неверное толкование наблюдаемому явлению, полагая, что алмаз испаряется. Позднее было установлено, что алмазы попросту сгорают.
После открытия М. В. Ломоносовым в 1748 г. закона сохранения вещества, который затем 40 лет спустя был подтвержден французским химиком Лавуазье, бесследное исчезновение алмазов при нагревании потребовало другого объяснения, которое бы не противоречило этому всеобщему закону. Вот почему сам Лавуазье занялся опытами с алмазами. Им было установлено, что алмаз при сильном нагревании и свободном доступе воздуха не испаряется, а сгорает с образованием углекислоты. Своими опытами Лавуазье впервые доказал, что алмаз состоит из чистого углерода. Такое известие вызвало сенсацию, настолько невероятным было сопоставление драгоценного камня с углеродом, который до этого был известен в форме таких малоценных материалов, как графит, сажа, уголь.
Рис. 1. Атомная структура алмаза (а) и графита (б)
Алмаз весьма устойчивый минерал. Он стоек к кислотам и щелочам. Растворимость алмаза во всех кислотах, даже концентрированных, практически равна нулю. Даже фтористоводородная кислота и царская водка (смесь в определенной пропорции азотной и соляной кислот) не действуют на алмаз. Поэтому, образовавшись при высоких давлениях и температурах в глубинах Земли, алмаз практически не подвергается химическим превращениям в условиях земной поверхности и сохраняется без изменения в течение многих сотен миллионов лет.
Вместе с тем алмаз может быть легко разрушен (окисляется и сгорает) в смеси соды с расплавленной натриевой или калиевой селитрой. Расплавленные карбонаты щелочей при 1000-1200 °С также превращают алмаз в окись углерода. Установлено, что сера слабо реагирует с алмазом при нагревании выше 600 °С. При нагревании до 800 °С в присутствии железа или сплавов на его основе алмаз растворяется. Именно поэтому алмазные резцы не получили применения при обработке стали и чугуна.
Алмаз с чистой поверхностью не смачивается водой (гидрофобен), но обладает способностью прилипать к некоторым жировым смесям. Гидрофобностью алмаза объясняются его проникновение ниже слоев смоченных водой гравийно-песчаных отложений и осаждение в природных и искусственных условиях вместе с минералами, имеющими значительно большую, чем у алмаза, плотность (например, гранаты, ильмениты и др.). Эти минералы являются, таким образом, спутниками алмаза в речных отложениях и помогают геологам при поисках алмазных месторождений: их присутствие служит поисковым признаком на алмазы.
На способности алмазов прилипать к некоторым жирам основан один из способов их извлечения из раздробленной горной породы. Алмазы прилипают к жиру, а остальные минералы и обломки пород в основном уносятся водой. Прилипшие алмазы извлекают, растапливая жир. Такова в принципе схема данного технологического способа извлечения алмазов.
В чем растворяется алмаз
А.Л. Верещагин, И.С. Ларионова
Известно, что химическая стойкость синтетических алмазов к воздействию минеральных кислот и жидкофазных окислителей снижается с уменьшением размеров алмазного зерна [1].
Очистка ювелирных алмазов
Очистка ювелирных алмазов протекает в несколько стадий [4]:
Рекуперация технических алмазов
Для очистки алмазов, извлеченных из металлорежущего инструмента, используют также многостадийный процесс, например [8]:
Известны также способы извлечения алмазов из отработанного инструмента и пылевидных отходов с использованием водных растворов хлоридов меди или железа для растворения металлической составляющей [9].
Металлическую матрицу можно удалить и анодным растворением [10].
Очистка синтетических алмазов статического и динамического синтеза.
Отделение неалмазной углеродной фазы
В результате статического синтеза образуется спёк, в котором прочно связаны частицы алмаза и графита. В этой смеси частицы алмаза и графита имеют различные размеры и плотности. Поэтому для разделения такой смеси можно использовать физические и химические методы.
Предложено удалять графит и другие неалмазные фазы углерода в процессе формирования синтетических алмазов лазерным излучением соответствующей длины волны, мощность которого достаточна для испарения графита и других углеродных образований [17].
Физический метод разделения основывается на использовании различий в их плотности с использованием жидкости с промежуточной плотностью между плотностями алмаза и графита. Так, в [18] смесь графита с алмазом помещалась в водный раствор бромида цинка с плотностью 243 0-2800 кг/м 3 и после перемешивания и выдержки в течение 20 минут отделялась нижняя фракция, обогащенная алмазом. Графит находился на поверхности раствора. Эффективное использование этого метода требует предварительного разделения спёков на отдельные частицы алмаза и графита. Те же самые соображения можно отнести и к разделению смеси алмаза с графитом методом флотации [19] с использованием в качестве дисперсантов пирофосфата и гексаметафосфата натрия [20].
В связи с этим предпочтение отдаётся химическим методам очистки. Химические методы очистки заключаются в нагревании смеси графита с алмазом вместе с окислителем в условиях, обеспечивающих окисление и удаление графита. Химические методы могут быть разделены на сухой и влажный процесс.
В сухом процессе имеется несколько вариантов его осуществления.
В сухом методе порошкообразная смесь алмаза и графита окисляется на воздухе в присутствии оксида свинца как катализатора при температуре 623-823 K в течение 12-65 часов. Затем производится удаление оксидa свинца кислотной промывкой [24].
У всех этих процессов есть достоинства и недостатки. Например, использование концентрированной ортофосфорной кислоты осложнено высокой вязкостью реакционной смеси, применение серной кислоты требует высокой температуры, что делает все операции с такой смесью опасными; при использовании KIO 3 выделяется большое количество йода.
Извлечение алмазного порошка из шлифовальной пыли при обработке керамики алмазными шлифовальными кругами требует другого метода очистки, поскольку здесь примесями являются силикаты и оксиды алюминия. Для извлечения алмазов пыль сплавляется с бурой в неокислительной атмосфере. Затем смесь растворяется в кислоте, а в полученном остатке содержатся частицы алмазов [33].
Для удаления алмазов и других абразивных материалов из металлической матрицы (кобальт) предложено растворение полировальных кругов в автоклаве в азотной кислоте или в смеси серной и азотной кислот в атмосфере с повышенным содержанием кислорода [34].
Следует отметить, что окислительная очистка изменяет характер поверхности частиц алмаза и из гидрофобной она становится гидрофильной, т.е. практически всегда имеет место окисление поверхностных атомов углерода [35].
Для повышения прочности поликристаллических алмазов перед процессом их спекания фракционированные частицы подвергают комплексной кислотной обработке: сначала кипящей хлорной кислотой, затем смесью соляной и азотной кислот и после этого плавиковой кислотой [36].
Таким образом, очистка синтетических и природных алмазов заключается в удалении жировых загрязнений, механических примесей. Отделение технологических примесей требует использования химических методов: непрореагировавший графит отделяют газо- или жидкофазным окислением, примеси металлов удаляются растворением в кислотах.
Тонкая очистка алмазных порошков
Описан также процесс дополнительной очистки алмазов статического синтеза путём окислительной обработки в атмосфере диоксида углерода в течение 25-35 мин при 873-1173 K в присутствии карбонатов, бикарбонатов или гидроксидов натрия или калия с последующей обработкой соляной кислотой и нагреванием в атмосфере метана при 773-873 K в течение 1-2 ч [39].
Очистка ультрадисперсных алмазов детонационного синтеза
Очистка детонационных алмазов от металлических составляющих и неалмазных форм углерода
В ОИХФ (Черноголовка) для удаления непревращенного углерода из продуктов детонации смеси гексогена с сажей или графитом использовали [42] последовательное кипячение твёрдых продуктов детонации с азотной и хлорной кислотами. Полученный остаток обрабатывали кипящим раствором эквимолярной смеси гидроксидов натрия и калия для удаления примесей силикатов с последующей промывкой водой при центрифугировании.
В [49] описана двухстадийная очистка УДА. На первой стадии за счёт обработки с 5-20% раствором азотной кислоты при 323-373 K удаляют примеси металлов, а на второй стадии неалмазные формы углерода. Для этого в проточном реакторе продукт, полученный в первой стадии, обрабатывают окислительной серно-азотной или нитроолеумной смесью в проточном реакторе. В результате получается продукт, содержащий 2,5% несгораемых примесей и 2,7% неалмазных форм углерода.
Было показано, что борный ангидрид в составе стёкол обладает отрицательным каталитическим действием на процесс окисления алмазов статического синтеза водяным паром и диоксидом углерода [56]. Позже установили, что борный ангидрид ингибирует окисление и УДА кислородом воздуха при температуре 573-823 K [57].
Значительного снижения содержания металлических примесей в УДА можно добиться при проведении подрыва в среде, не содержащей металлов, например в бассейне или в соляной шахте, или при подрыве заряда в водной оболочке [59], при этом содержание несгораемых примесей снизилось с 5-7 до 0,1-0,3 масс.%. Однако такие предложения ещё не получили технического воплощения.
Тонкая очистка ультрадисперсных алмазов
Удалить адсорбированные газы можно и за счет термообработки при высокой температуре в газовой среде, нейтральной по отношению к углероду, (в водороде, аргоне, диоксиде углерода) [63]. Но полностью устранить газовыделение у УДА невозможно, так как карбоксильные группы доминируют на поверхности детонационных алмазов [64].
Выделение ультрадисперсных алмазов из водных суспензий
Значительные потери мелких фракций алмазов технических алмазов происходят на окончательной стадии промывки их водой [66].
Скорость процесса сушки таких суспензий можно повысить, если использовать распыление нагретой суспензии через форсунку высокого давления [72].
1. Крук В.Б. Химическая стойкость синтетических алмазов к воздействию минеральных кислот и жидкофазных окислителей // Синт. алмазы. Научн.-произв. сб. 1975.-вып.3(39).-С.13-15.
2. Веселовский В.С. Углерод, алмазы, графит и угли и методология их исследования.-М.-Л.: ОНТИ, 1936.-176 с.
7.Copperthwaite R.S. Surface analysis of chemically treated diamonds // S. Afr. J. Chem. 1982.-V.35.- № 4.-P.181-182.
8.Chio Shiu-Shin Shank diamond cleaning // US Patent № 4339281 from Jul.13,1982.
11. Путятин А.А., Никольская И.В., Калашников А.Я. Химические методы извлечения алмазов из продуктов синтеза // Сверхтвердые материалы.-1982.-№ 2.-С.20-28.
12. Крук В.Б., Лепихова Т.Г., Важнев В.П. Очистка синтетических алмазов от примесей // Синтетические алмазы.-1974.-Вып.2.-С.11-13.
13. Богатырёва Г.П., В.Б.Крук, Невструев Г.Ф., Билоченко В.А. Термохимическая очистка алмазных микропорошков // Сверхтвердые материалы.-1982.-№ 3.-С.29-32.
14.Kalalova E., Kovarova Z. Pouziti ionexu Ostion KS v procesu regenerace katalyticky aktivnich kovu z vyroby sintetickych diamantu // Chem. prumysl.-1984.-Sv.34.-S.241-243.
15. Panczyk J., Majewski J., Kuyawski E., Brandel W., Brzozowski E., Pankowska Sposob oddzielania zanieczyzczen od diamantu // Патент ПНР №112068 опубликован 30.12.81.
16.Yamaguchi Shigeto, Setaka Nobuo Synthesis of diamond // J.Electroch. Soc.-1980.-vol.127, №1.-Р.245-246.
17.Pinneo J.M. Method for suppressing growth of graphite and other non-diamond carbon species during formation of synthetic diamond // US Patent № 4849199 from 18.07.89.
19. Гричук И.М. Способ извлечения алмазов из продуктов синтеза // Патент Российской Федерации № 2027666 от 27.01.95.
20.Nakachiro Y., Wakabayashi S., Waiporo D., Kusaka E., Ninae M., Wakamatsu T. Action some depresants on removal untransformed graphite flotation method in prosses of diamond synthesis // J.Mining and Mater. Process Inst. Japan 1995, v.111,- № 2, P.92-96.
21. Albrecht S., Kessler G., Herrman E., Grosse G. Verfaren zum Trennen von Kohlenstoffphasen // Patent DDR №224575, aus 10.07.85.
22. Сандомирская О.А., Беженарь Н.П., Шишкин В.А. Очистка поверхности поликристаллов сверхтвердых материалов от графита // Сверхтвёрдые материалы.- 1982.-№6.-С.12-14.
23. Федосеев Д.В., Толмачёв Ю.Н., Буховец В.Л., Внуков С.П. О кинетике окисления алмаза и графита в тлеющем разряде // Ж. физ. химии 1979.-Т.53.-№ 8.-С.2189.
24.E.I. du Pont de Nemours and Co. Selective oxidation of graphite from mixture thereof with diamond // Irish Patent № 29574 from 4.11.70.
25. Павлов Е.В., Скрябин Ю.А. Способ удаления примеси неалмазного углерода и устройство для его осуществления // Патент Российской Федерации № 2019502 от 15.09.94
27.Albrecht S., Ke b ler G., Herman E., Gro b e G. Verfahren zum Trennen von Kohlenstofffphasen // Patent DDR № 224575 aus 10.07.85.
28.Kuroyama Y., Araki M, Method for purifying diamond // US Patent № 4578260 from Mar. 25, 1986.
29. Исаев Р.Н. Способы извлечения алмазов из различных материалов и методы их очистки // Сверхтвердые материалы.- 1989.-№ 2, С.30-34.
30. Богатырёва Г.П., Крук В.Б., Сохина Л.А. Определение содержания алмазов в алмазосодержащих материалах // Синтетические алмазы.- 1974.- вып.5.-С.19-21.
31.Marchywka M.J. Electrochemical process and product therefrom // US Patent № 5269890 from 14.12.93.
32.Wu Mu-Sheng Process for recovering synthetic diamonds from pressed runs // US Patent № 3969489 from Jul.13,1976.
34.Schlimmer J.F., Karlsson B.A., Process using an acidic medium containing nitric acid // US Patent № 532449 6 from Jun. 28, 1994.
35. Богатырёва Г.П., Крук В.Б. О гидрофильности синтетических алмазов // Синтетические алмазы.-1977.- вып.№1, С.10-12.
36. Богатырёва Г.П. Исследование гидрофильности и гидрофобности поверхности синтетических алмазов // Сверхтвёрдые материалы.-1980.-№ 2, С.23-27.
Физические свойства алмаза
Минерал алмаз по сути представляет собой одну из многочисленных модификаций углерода. Физические свойства алмаза определяются внутренним строением кристалла.
Как и другие минералы, физические свойства алмаза оцениваются по следующим критериям:
Твердость алмаза
По шкале Мооса твердость алмаза является максимальной и равна 10.
Следующим после алмаза по твердости в шкале идет корунд со значением 9. Но его абсолютное значение твердости в 150 раз меньше чем у алмаза – что говорит об абсолютном лидерстве алмаза в этом отношении.
Существуют и другие способы определения твердости, но оценка по Моосу (царапание минерала другим минералом-эталоном) оказалась наиболее простой и наименее разрушительной методикой, которая широко используется и в настоящее время.
Твердый — значит не сломать?
Твердость алмаза не одинакова в разных направлениях кристалла. На этом основана распиловка, огранка и шлифовка алмазов. Высокая твёрдость обусловливает исключительную износостойкость алмаза на истирание. Одновременно с твердостью, алмаз является достаточно хрупким, что несколько ограничивает его применение. Под воздействием сильного удара алмаз легко раскалывается по плоскостям, параллельным граням правильного октаэдра.
Плотность (удельный вес) алмаза
Удельный вес (плотность) алмаза находятся в промежутке 3,417-3,55 гр/см3. Это достаточно много, и высокая плотность в том числе влияет на прочность данного минерала.
Удельный вес тела есть отношение его веса к весу чистой воды равного объема.
Таким образом, при одинаковых объемах, алмаз весит примерно в 3,52 раза больше чем вода.
Коэффициент преломления и дисперсии алмаза
Характерный блеск и «огонь» ограненных и отполированных алмазов (бриллиантов) обусловлен очень высоким показателем преломления (от 2,417 до 2,421) и сильной дисперсией (0,0574).
Для справки: светопреломление – это отклонение направления светового луча при вхождении в другую среду, где свет резко меняет свою скорость. Дисперсия – это различия в показателе преломления в зависимости от цвета (длины волны) применяемого освещения.
Рис.1: Схематичное изображение дисперсии:
Рис.2: Игра «огня» в бриллианте
Алмаз имеет показатель преломления 2,42, что является самым высоким среди всех драгоценных камней, используемых в ювелирном деле. Именно поэтому мы имеем удовольствие наблюдать такие свойства камня бриллиант, как сверкающий, алмазный блеск.
Уникальное сочетание дисперсии с высоким преломлением и твердостью алмаза, позволяющего отполировать его грани без малейших изъянов, составляет именно тот уникальный набор свойств, который позволил занять алмазу вершину в мире драгоценностей.
Другие физические свойства алмазов
Алмаз характеризуется аномально высокой теплопроводностью, которая составляет 900—2300 Вт/(м·К) и является наивысшей среди всех твердых тел. Это свойство позволяет рассматривать алмаз в качестве перспективного полупроводника (конечно, при условии, что будут разработаны достаточно дешевые методы производства синтетических алмазов). Существующие в настоящее время кремниевые полупроводники могут работать до 100°С, в то время как алмазные микросхемы будут работоспособны при гораздо более высоких температурах.
Из прочих свойств можно отметить, что алмаз не растворяется в кислотах и щелочах, является диэлектриком, обладает очень низким коэффициентом трения по металлу на воздухе (0,1) что объясняется образованием на поверхности алмаза тонких плёнок адсорбированного газа, играющих роль своеобразной смазки. Под действием дневного света и особенно ультарфиолетовых лучей большинство алмазов начинает светиться голубым, желтым и зеленым цветом, под действием катодных лучей проявляется люминесценция бледно-голубым цветом, под действием рентгеновских лучей – синеватым. Алмазы обладают свойством прилипать к некоторым жировым смесям. Это свойство широко используется для извлечения алмазов на обогатительных фабриках.
Температура плавления алмаза составляет 3700—4000 °C при давлении 11 ГПа. На воздухе алмаз начинает горение при 850°C. В струе чистого кислорода горит слабо-голубым пламенем при 720—800 °C, полностью превращаясь в углекислый газ. Нагревание алмаза без доступа воздуха приводит к его частичному переходу в графит при температурах выше 1500°С. При нагреве до 2000 °C без доступа воздуха алмаз переходит в графит за 15-30 минут.