в чем причина аллотропии углерода
Аллотропия углерода
Аллотропия углерода.
Аллотропия углерода:
Аллотропия – это явление существования двух и более простых веществ одного и того же химического элемента, но различных по своему строению и соответственно свойствам. Все формы и модификации таких веществ называют аллотропными.
Аллотропные модификации углерода наиболее распространенные среди других химических элементов и по своим свойствам наиболее радикально отличаются друг от друга: от мягкого к твёрдому, непрозрачного к прозрачному, абразивного к смазочному, недорогого к дорогому.
| Химическая связь | C-C | C=C | C ≡C |
| Энергия связи, кДж/моль | 348 | 612 | 838 |
| Гибридное состояние атома углерода | sp 3 | sp 2 | sp |
В итоге углерод образовывает самой большое количество аллотропических модификаций линейного или циклического строения.
Классификация аллотропных форм углерода:
По характеру связей между атомами аллотропические модификации углерода можно разделить:
– sp 3 формы – алмаз (кубический), лонсдейлит (гексагональный алмаз),
– sp формы – карбин (a-карбин и b-карбин),
– смешанные sp 2 /sp формы: графин (graphyne),
– другие формы: С1, С2 (диуглерод), С3, С8, М-углерод.
В чем причина аллотропии углерода
Сергей Евгеньевич Евсюков, кандидат химических наук,
руководитель лаборатории фирмы “instrAction GmbH” (Людвигсхафен, Германия).
Значение углерода в современной науке и технике трудно переоценить. П.Уокер, бывший редактором книжной серии “Chemistry and Physics of Carbon”, 30 лет назад писал, что прогресс в разработке новых углеродных материалов будет продолжаться как глава всеобщей истории материаловедения и называл углерод “старым, но всегда новым материалом”. Это выражение, не потерявшее своей актуальности и сегодня, многократно подтверждалось в течение всех минувших лет, и особенно последних десяти.
При попытке понять это возникают два важных вопроса:
— сколько независимых аллотропных форм элементарного углерода может существовать в природе,
— по каким критериям их следует выделять из множества других углеродных материалов?
Из приведенных понятий аллотропии, полиморфизма и политипизма видно, что они перекрываются и потому трудно вычленить аллотропию, особенно для углерода. Видимо, буквальное понимание того определения, которое дано У.Эддисоном [4], и есть результат открытия огромного и непрерывно увеличивающегося числа аллотропных форм углерода. Не станет ли яснее ситуация, если помимо пространственного расположения атомов углерода учитывать тип химических связей между ними, т.е. тип гибридизации валентных орбиталей [5]? Мы использовали именно это дополнение в качестве отличительной черты аллотропных форм углерода и получили удобную классификационную схему, а затем и третичную диаграмму, которые объединяют в себе все существующие углеродные материалы и те, что пока относят к гипотетическим [6].
Рис. 1. Схематическое изображение трех основных аллотропных форм углерода.
Алмаз и графит на протяжении многих лет были предметом детальных исследований и поэтому всесторонне изучены и охарактеризованы. Но однозначных и строгих доказательств индивидуальности карбина и его строения до сих пор, к сожалению, не получено. Он не включен в список терминов, недавно рекомендованных IUPAC для описания углерода как твердого тела. Однако существует большое количество публикаций о карбине, есть критические обзоры накопленных экспериментальных данных [8], разработаны новые подходы к синтезу и методы анализа линейных форм углерода. Заметно возрос в последние годы и интерес к ним. На основании всего этого можно ожидать, что существование карбина вскоре будет непреложно установлено.
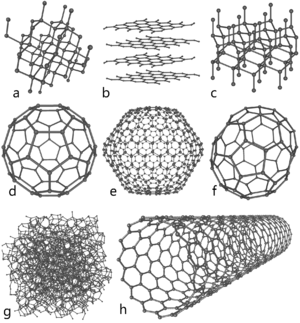
В первую группу следует включить “аморфный”, алмазоподобный и стеклообразный углерод, а также сажу, кокс и подобные им материалы. Такие формы со смешанным ближним порядком состоят из более или менее случайно организованных атомов углерода различной гибридизации. К этой же группе могут быть отнесены также многочисленные гипотетические структуры (рис. 2): графины, некоторые полициклические модификации в виде трехмерных углеродных сеток, “металлический углерод” и сходные с ними структуры на основе алленовых (=C=C=) или диацетиленовых (–CBC–CBC–) фрагментов, которые расположены между ортогональными полиеновыми или полидиацетиленовыми цепочками. “Супералмаз” и слоисто-цепочечный углерод (т.е. гибридные карбино-алмазные структуры, в сущности представляющие собой частный случай одномерного “супералмаза”) тоже относятся к смешанным формам углерода. Методологические основы синтеза таких форм подробно рассмотрены в исчерпывающих обзорах Ф.Дидериха и И.Рубина [10, 11].
Рис. 2. Смешанные гипотетические формы: плоскостной “графин”; трехмерная сетка “металлического углерода”; “супералмаз” и карбино-алмазный гибрид (слоисто-цепочечный углерод).
Рис. 3. Промежуточные формы углерода: углеродные моноциклы и замкнуто-каркасные структуры.
Рис. 4. Гипотетические формы в виде полициклических сеток
с напряженными трех- и четырехчленными циклами.
Можно представить и другие, еще более сложные углеродные материалы, состоящие из структурных элементов как смешанного, так и промежуточного типа. Подобные матералы могут быть получены, например, полимеризацией фуллереновых молекул и углеродных нанотрубок, а также при взаимных превращениях различных форм углерода: карбина в алмаз или графит, фуллеренов в алмаз, графит или карбин.
Таким образом, разделение углеродных форм и материалов в соответствии с типом гибридизации валентных орбиталей их атомов представляется наиболее простой и удобной схемой классификации. Согласно этой схеме, все многообразие форм углерода можно условно разбить на две группы: архетиповые аллотропные с целым показателем степени гибридизации (алмаз, графит, карбин) и переходные. Последние включают смешанные формы, содержащие структурные элементы всех архетиповых модификаций в различных комбинациях, и промежуточные формы с дробным показателем степени гибридизации (моноциклы, фуллерены, нанотрубки и др.).
Можно надеяться, что недалекое будущее принесет еще много неожиданных и поразительных открытий в науке об углероде, элементе, на котором основана жизнь на Земле.
2. Kroto H.W., Heath J.R., O’Brien S.C. et al. // Nature. 1985. V.318. P.162-163.
3. Чернозатонский Л.А. // Природа. 1997. №1. С.96-99.
4. Эддисон У. Аллотропия химических элементов. Пер. с англ., М., 1966.
5. Terms concerned with CARBON as chemical element and its reactivity // Proc. 5th London Int. Carbon Graphite Conf. (Sept. 18–22. 1978). 1979. V.3. P.103-108.
6. Heimann R.B., Evsyukov S.E., Koga Y. // Carbon. 1997. V.35. P.1654-1658.
7. Ман Л.И., Малиновский Ю.А., Семилетов С.А. // Кристаллография. 1990. Т.35. С.1029-1039.
8. Carbyne and Carbynoid Structures / Ed. R.B. Heimann, S.E. Evsyukov, L. Kavan. Dordrecht, 1999.
9. Касаточкин В.И. Переходные формы углерода // Структурная химия углерода и углей /Ред. В.И. Касаточкин. М., 1969. С.7-16.
10. Diederich F., Rubin Y. // Angew. Chem. Int. Ed. Engl. 1992. V.31. P.1101-1123.
11. Diederich F. // Nature. 1994. V.369. P.199-207.
12. Fullerenes. Chemistry, Physics, and Technology / Ed. K.M. Kadish, R.S. Ruoff. N. Y., 2000.
15. Hoffmann R., Hughbanks R., Kertesz M., Bird P.H. // J. Am. Chem. Soc. 1983. V.105. P.4831-4832.
16. Мельниченко В.М., Никулин Ю.Н., Сладков А.М. Слоистая структура алмаза // Природа. 1984. №7. С.22-30.
Химия соединений: свойства аллотропных модификаций углерода
Аллотропия — это возможность существования вещества в виде нескольких модификаций, отличающихся друг от друга физически и химически. Аллотропия возможна для элементов, характеризующихся способностью атомов к образованию гомогенных цепей. Наибольший интерес для современной химии представляют свойства аллотропных модификаций углерода, в основном из-за перспектив получения большего количества видоизменённых форм с полезными свойствами.
Аллотропные преобразования и переходы
Наиболее характерны аллотропные преобразования для неметаллических веществ (кроме галогенов (хлор, бром, йод) и инертных газов (аргон, ксенон и неон)), полуметаллов и, реже всего, для металлов. Переходы элемента в иную форму, отличающуюся от его стандартной модификации, происходят при изменении условий окружающей среды. Основными факторами, влияющими на аллотропные преобразования, являются изменения давления и температуры, которые могут воздействовать на элементы как поодиночке, так и комплексно. Примерами элементов, обладающих аллотропией, и их модификациями являются:
Любое изменение может быть обратимым (т. е. при возвращении к нормальным условиям вещество переходит в свою стандартную форму), энантиотропным, или же необратимым, монотропным. К энантиотропным переходам относятся превращения серы из ромбической в моноклинную или же переход белого пластичного олова (бета-олова) в белое хрупкое (гамма-олово). Монотропное видоизменение происходит, например, при модификации белого фосфора в чёрный.
Аллотропия углерода
Углерод, как активный элемент с четырьмя свободными связями, способен образовывать два основных типа соединений: кристаллические — твёрдые и аморфные — мягкие или пластичные вещества. Высокое содержание аморфного углерода наблюдается в таких веществах, как различные виды угля (антрацит, ископаемый, древесный и активированный), техуглероде, саже, коксе и углеродной нанопене. Кристаллические формы углерода, в свою очередь, подразделяются по особенностям пространственного строения кристаллической решётки:
Все аллотропные модификации углерода имеют существенные различия между собой начиная от способа их получения (например, естественный и искусственный), условий их формирования (температурные параметры и показатели давления) и заканчивая их применением.
Видоизмененные формы углерода
Основные критерии, указывающиеся в сводных таблицах примеров аллотропных модификаций, — это строение решётки, основные свойства (или так называемые полезные свойства, характеризующие ценность модификации для промышленности или науки) и отрасли применения материала.
| Название модификации | Строение решётки | Характеристика | Применение |
| Алмаз | Тетраэдрическая | Самое твёрдое вещество по шкале Мооса (10 баллов). Обладает высокой теплопроводностью, износостойкостью и модулем упругости. Способен к люминесценции | В качестве абразива, сдерживающего вещества в экспериментах с высоким давлением и в ювелирной промышленности |
| Лонсдейлит | Тетраэдрическая | 8 баллов по шкале Мооса. Прозрачен, индекс преломления составляет от 2,40 до 2,41 | В связи с чрезвычайной трудоёмкостью получения не имеет практического применения |
| Графит | Тригональная | Мягкий минерал, проводящий электричество. Не плавится, обладает химической активностью (реагирует с металлами, солями и кислородом) | Наиболее известен как материал для карандашного стержня, однако, также используется для изготовления электродов, плавильных тиглей, наполнителя для пластмасс и много другого |
| Графен | Тригональная | Двухмерная модификация углерода, представленная гексагональной кристаллической решёткой толщиной в 1 атом | Используется при создании транзисторов |
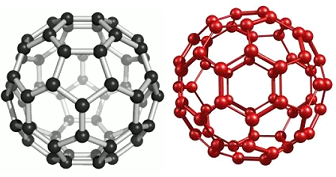
| Фуллерены | Тригональная | Состоят из молекул углерода в форме выпуклых многогранников | Применяются в лазерных технологиях, при получении искусственных алмазов и создании лекарств нового поколения |
| Наноалмазы | Тетраэдрическая | Наноструктуры с кристаллической решёткой по типу алмаза | В космической и медицинской отраслях промышленности |
| Карбин | Линейная | Мелкокристаллический порошок чёрного цвета со свойствами полупроводника. Кристаллическая решётка карбина состоит из множества линейных цепочек углерода, расположенных параллельно друг другу | Используется в фотоэлементах и в медицине для создания искусственных вен и артерий |
| Стеклоуглерод | Имеет аморфное строение | За счёт сложного, смешанного состава, характеризуется электропроводностью графита и твёрдостью, схожей с твёрдостью стекла. Устойчив к коррозии в агрессивных средах | Как материал для электродов и тиглей |
Исследование модификаций углерода позволяет не только получать конструкционные материалы с заданными свойствами, но и предсказывать возможность существования новых форм с уникальными характеристиками.
Так, например, одной из самых последних гипотез, стало предположение о получении Т-углерода, гораздо более легкого чем алмаз и обладающего 65% его твердости, что позволит использовать минерал в аэрокосмической отрасли.
Таким образом, в ближайшем будущем ожидается появление новых видоизмененных форм одного из самых распространенных элементов на земле. Однако уже известные его аллотропные модификациии, всё ещё будут использоваться в промышленности и науке за счёт особенностей своего строения, химических и физических свойств.
Характеристика аллотропных модификаций углерода
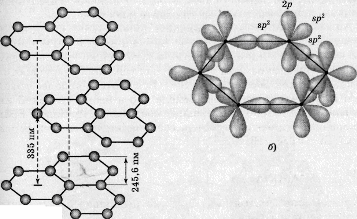
Рис. 1. Фрагмент слоистой структуры графита (а) и схема перекрывания электронных облаков
(б) шести атомов углерода, образующих правильный шестиугольник
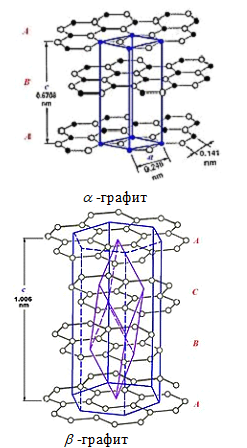
Различают две модификации графита: α-графит (гексагональный) и β-графит (ромбоэдрический). Различаются упаковкой слоёв. У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника (укладка …АВАВАВА…), а у β-графита каждый четвёртый слой повторяет первый. Ромбоэдрический графит удобно представлять в гексагональных осях, чтобы показать его слоистую структуру.
β-графит в чистом виде не наблюдается, так как является метастабильной фазой. Однако, в природных графитах содержание ромбоэдрической фазы может достигать 30%. При температуре 2500-3300 К ромбоэдрический графит полностью переходит в гексагональный.
Рис. 2. Модификации графита: α-графит (гексагональный) и β-графит (ромбоэдрический)
(Материал взят из: ru.wikipedia.org/wiki/%).
Графит — распространенный в природе минерал. В промышленности его получают из кокса или из газообразных углеводородов. При температуре 2700 °С и давлении 11—12 ГПа графит превращается в алмаз.
Графен очень тверд и одновременно гибок. За графеном великое будущее в области электроники, космонавтики, медицине и других областях.
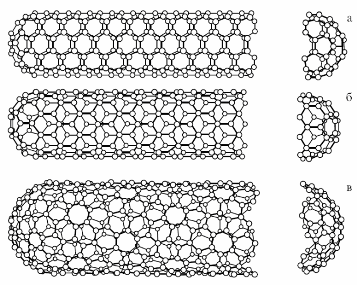
Углеродные нанотрубки — это протяжённые цилиндрические структуры диаметром от одного до нескольких десятков нанометров и длиной до нескольких cантимметров состоящие из одной или нескольких свёрнутых в трубку графеновых плоскостей и заканчивающиеся обычно полусферической головкой, которая может рассматриваться как половина молекулы фуллерена. Получают углеродные нанотрубки путем приведения в контакт смеси метана и водорода с катализатором.
Рис. 4. Примеры возможных структур нанотрубок, зависящих от способа сворачивания графитового листа: а – кресельная структура; б – зигзагообразная структура; в – хиральная структура.
Углеродные нанотрубки вместе с фуллеренами и мезопористыми углеродными структурами образуют новый класс углеродных наноматериалов, или углеродных каркасных структур, со свойствами, которые значительно отличаются от других форм углерода, таких как графит и алмаз.
Углеродные нановолокна (они же карбоновые нановолокна) — углеродные цилиндрические наноструктуры, представляющие собой сложенные стопкой слои графена в виде конусов, «чашек» или пластин.
Благодаря их исключительным свойствам и низкойстоимости, они в настоящее время все чаще и чаще используются в различных материалах, например таких как композиты, из которых делают кузова спортивных болидов и корпуса самолётов, ветряные турбины, высококачественное спортивное оборудование: рамы велосипедов, рукоятки теннисных ракеток и многое другое.
Астралены —фуллероидные соединения, представляющие собой многослойные полиэдральные структуры из атомов углерода размером 80,150 нм.
Астралены рассматриваются как перспективный наноматериал. Сейчас изучаются следующие области применения:
•Добавка-модификатор для полимерных и неорганических композиционных материалов, а также композиционных сплавов. В частности, его добавляют (0,0001-0,001%) в бетон в качестве наномодификатора.
Места применения астраленов:
•Антифрикционная добавка к конструкционным материалам и смазкам.
•Элемент холодных катодов.
•Элемент нелинейно-оптических систем, в том числе широкополосных ограничителей лазерного излучения.
•Компонент фотохимических генераторов синглетного кислорода.
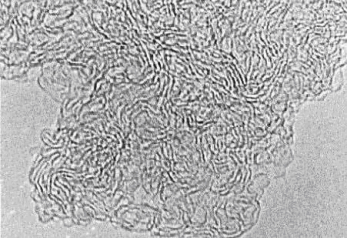
Рис. 7. Изображение трансмиссионной электронной микроскопии (ТЭМ) стеклоуглерода (SIGRADUR® K).
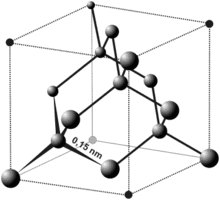
Рис.9. Элементарная ячейка алмаза (Материал из Википедии: wikipedia.org/wiki/Алмаз)
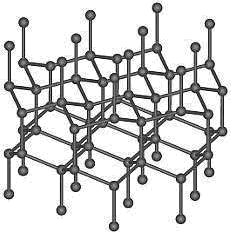
Рис.10. Структура лонсдейлита
Аморфный углерод (кокс, бурые и каменные угли, сажа, активный уголь) состоит из мельчайших кристаллов, имеющих структуру графита.
Классификация аллотропов углерода по характеру химической связи между атомами:
sp 3 формы:
Алмаз (куб);
Лонсдейлит (гексагональный алмаз).
sp 2 формы:
Графит;
Графены;
Фуллерены (C20+);
Нанотрубки;
Нановолокна;
Астралены;
Стеклоуглерод;
Колоссальные нанотрубки.
sp формы:
Карбин.
Смешанные sp 3/ sp 2 формы:
Аморфный углерод;
Углеродные нанопочки;
Углеродная нанопена.
Другие формы: C1 — C2 — C3 — C8.
Например, диуглерод — двухатомная нейтральная частица, образованная двумя атомами углерода (C2), и детектируемая спектрометрически в электрической дуге (вместе с некоторыми фуллеренами), в кометах и в синих языках пламени.
Аллотропия углерода
Углерод — вещество с самым [источник не указан 804 дня] большим числом аллотропических модификаций (более 8 уже обнаружены).
Аллотропные модификации углерода по своим свойствам наиболее радикально отличаются друг от друга, от мягкого к твёрдому, непрозрачного к прозрачному, абразивного к смазочному, недорогого к дорогому. Эти аллотропы включают аморфные аллотропы углерода (уголь, сажа), нанопена, кристаллические аллотропы — нанотрубка, алмаз, фуллерены, графит, лонсдейлит и церафит.
Содержание
Классификация
Классификация аллотропов углерода по характеру химической связи между атомами:
Алмаз
Алмаз является одним из наиболее известных аллотропов углерода, чья твёрдость и высокая степень рассеивания света делает его полезным в промышленном применении и в ювелирных изделиях. Алмаз — самый твёрдый известный природный минерал, что делает его отличным абразивом и позволяет использовать для шлифовки и полировки. В природной среде нет ни одного известного вещества, способного поцарапать даже мельчайший фрагмент алмаза.
Рынок алмазов промышленного класса несколько отличен от рынков других драгоценных камней. Используемые в промышленности алмазы ценятся главным образом за их твёрдость и теплопроводность, из-за чего другие геммологические характеристики алмазов, в том числе чистота и цвет, по большей части излишни. Это помогает объяснить, почему 80 % добываемых алмазов (что эквивалентно примерно 100 млн. каратам или 20000 кг в год), непригодно для использования в качестве драгоценных камней и известны как борт, предназначенные для промышленного использования. В дополнение к добываемым алмазам, находят промышленное применение и искусственные синтетические алмазы, используемые практически сразу же после их изобретения в 1950 г., а ещё 400 миллионов каратов (80000 кг) синтетических алмазов выпускаются ежегодно для промышленного использования — почти в четыре раза больше массы природных алмазов, добытых за тот же период.
Основным промышленным применением алмазов является резка, сверление (в наконечниках свёрл и буров), шлифовка (резка алмазными гранями) и полировка. Большинство используемых в этих технологиях алмазов не требует крупных образцов; фактически, большинство алмазов качества драгоценных камней, могут использоваться в промышленности. Алмазы вставляются в наконечники буров или режущие кромки пилы или измельчаются в порошок для использования процессах шлифования и полирования. Специализированное применение включает в себя использование в лабораториях в качестве сдерживающих веществ при экспериментах с высоким давлением, в высокопроизводительных подшипниках и ограниченное применение в специализированных окнах.
С продолжающимся увеличением в производстве синтетических алмазов, их будущее применение становится более осуществимым. Накопление большого запаса — это возможность использовать алмазы в качестве полупроводников при изготовлении микрочипов или использовать для поглощения тепла в электронике. Значительные достижения в исследованиях в Японии, Европе и Соединённых Штатах позволяют использовать возможности, предоставляемые уникальными свойствами алмазного вещества, в сочетании с повышением качества и количества, обеспечиваемыми производителями синтетических алмазов.
Каждый атом углерода в алмазе ковалентен с четырьмя другими атомами углерода в тетраэдре. Эти тетраэдры вместе образуют трёхмерную сеть из слоёв шестичленных колец атомов. Эта устойчивая сеть ковалентных связей и трёхмерное распределение связей является причиной такой твёрдости алмазов.
Графит
Графит (назван Абрахамом Готтлобом Вернером в 1789 г, (с греческого графен — «тянуть/писать», использовался в карандашах) — один из самых обычных аллотропов углерода. Характеризуется гексагональной слоистой структурой. Встречается в природе. Твердость по шкале Мооса 1. Его плотность — 2.3, она меньше чем у алмаза. Приблизительно при 700 °C горит в кислороде, образовывая углекислый газ. По химической активности более реакционен чем алмаз. Это связано с проникновением реагентов между гексагональными слоями атомов углерода в графите. Не взаимодействует с обычными растворителями, кислотами или расплавленными щелочами. Однако, хромовая кислота окисляет его до углекислого газа. Получают нагреванием смеси пека и кокса при 2800 °C; из газообразных углеводородов при 1400—1500 °C при пониженных давлениях с последующим нагреванием образовавшегося пироуглерода при 2500−3000 °C и давлении около 50 МПа с образованием пирографита. В отличие от алмаза, графит обладает электропроводностью и широко применяется в электротехнике. Графит является самой устойчивой формой углерода при стандартных условиях. Поэтому в термохимии он принят за стандартное состояние углерода. Применяется для изготовления плавильных тиглей, футеровочных плит, электродов, нагревательных элементов, твердых смазочных материалов, наполнителя пластмасс, замедлителя нейтронов в ядерных реакторах, стержней карандашей, при высоких температурах и давлениях (более 2000 °C и 5 ГПа) для получения синтетического алмаза.
Порошок графита используется как сухая смазка. Однако в вакууме он заметно теряет смазочные свойства, это связано с тем, что смазочные свойства графита связаны с адсорбрцией воздуха и воды между слоями в графите, в отличие от других слоистых сухих смазок, типа дисульфида молибдена. При большом количестве кристаллографических дефектов, которые связывают слои в структуре, графита, он также теряет смазывающие свойства и становится подобным пиролитическому графиту.
Природные и кристаллические графиты редко используются в чистой форме из-за их скалываемости, хрупкости и противоречивых механических свойств.
Его чистые структурно изотропные синтетические формы, как например пиролитический графит и углеродистые графитовые волокна, представляют чрезвычайно прочный, огнеупорный (до 3000 °C) материал, используемый для защиты носовых конусов ракет, в конструкциях сопел твердотопливных двигателей ракеты, высокотемпературных реакторов, тормозных колодок и электрических моторных щеток.
Вспучивающиеся или растяжимые графиты используются в печах нагрева для герметизации ее элементов. В процессе нагрева графит вспучивается (расширяется и обжигается) и герметизирует области контакта. Типичная температура начала расширения (область температур) — между 150 и 300 °C. Электропроводность графита связана с делокализацией электронов пи — связей выше и ниже плоскостей расположения атомов углерода. В отличие от алмаза, в котором все четыре внешних электрона каждого атома углерода ‘локализованы’ между атомами в ковалентной связи, в графите, каждый атом связан ковалентной связью только с 3 из его 4 внешних электронов. Поэтому каждый атом углерода вносит один электрон в делокализованную систему электронов. Эти электроны находятся в зоне проводимости. Однако электропроводность графита ориентирована по поверхности слоев. Поэтому графит проводит электричество по плоскости слоя атомов углерода, но не проводит в направлении под прямым углом к плоскости.