в чем особенность теплового движения молекул в твердых телах
В чем особенность теплового движения молекул в твердых телах
Любое вещество состоит из мельчайших частиц — молекул. Молекула — это наименьшая частица данного вещества, сохраняющая все его химические свойства. Молекулы расположены в пространстве дискретно, т. е. на некоторых расстояниях друг от друга, и находятся в состоянии непрерывного беспорядочного (хаотичного) движения.
Поскольку тела состоят из большого числа молекул и движение молекул беспорядочно, то нельзя точно сказать, сколько ударов будет испытывать та или иная молекула со стороны других. Поэтому говорят, что положение молекулы, её скорость в каждый момент времени случайны. Однако это не означает, что движение молекул не подчиняется определённым законам. В частности, хотя скорости молекул в некоторый момент времени различны, у большинства из них значения скорости близки к некоторому определённому значению. Обычно, говоря о скорости движения молекул, имеют в виду среднюю скорость (v$cp ).
Нельзя выделить какое-то определённое направление, в котором движутся все молекулы. Движение молекул никогда не прекращается. Можно сказать, что оно непрерывно. Такое непрерывное хаотическое движение атомов и молекул называют — тепловое движение. Такое название определяется тем, что скорость движения молекул зависит от температуры тела. Чем больше средняя скорость движения молекул тела, тем выше его температура. И наоборот, чем выше температура тела, тем больше средняя скорость движения молекул.
Броуновское движение
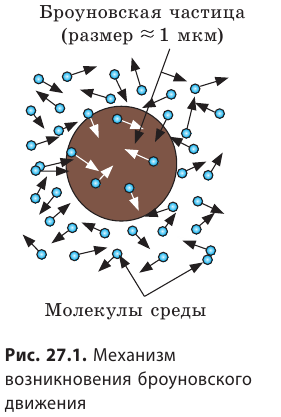
Движение молекул жидкости было обнаружено при наблюдении броуновского движения — движения взвешенных в ней очень мелких частиц твердого вещества. Каждая частица беспрерывно совершает скачкообразные перемещения в произвольных направлениях, описывая траектории в виде ломаной линии. Такое поведение частиц можно объяснить, считая, что они испытывают удары молекул жидкости одновременно с разных сторон. Различие в числе этих ударов с противоположных направлений приводит к движению частицы, поскольку ее масса соизмерима с массами самих молекул. Движение таких частиц впервые обнаружил в 1827 г. английский ботаник Броун, наблюдая под микроскопом частицы цветочной пыльцы в воде, почему оно и было названо — броуновское движение.
Конспект урока «Тепловое движение. Броуновское движение».
Движение молекул в газах, жидкостях и твёрдых телах
Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Например, лёд, вода и водяной пар. Часто плазму считают четвёртым состоянием вещества.
Агрегатные состояния вещества (от латинского aggrego – присоединяю, связываю) – состояния одного и того же вещества, переходы между которыми сопровождаются изменением его физических свойств. В этом и заключается изменение агрегатных состояний вещества.
Во всех трёх состояниях молекулы одного и того же вещества ничем не отличаются друг от друга, меняется только их расположение, характер теплового движения и силы межмолекулярного взаимодействия.
Движение молекул в газах
В газах обычно расстояние между молекулами и атомами значительно больше размеров молекул, а силы притяжения очень малы. Поэтому газы не имеют собственной формы и постоянного объёма. Газы легко сжимаются, потому что силы отталкивания на больших расстояниях также малы. Газы обладают свойством неограниченно расширяться, заполняя весь предоставленный им объём. Молекулы газа движутся с очень большими скоростями, сталкиваются между собой, отскакивают друг от друга в разные стороны. Многочисленные удары молекул о стенки сосуда создают давление газа.
Движение молекул в жидкостях
Время оседлой жизни уменьшается с повышением температуры. Расстояние между молекулами жидкости меньше размеров молекул, частицы расположены близко друг к другу, а межмолекулярное притяжение велико. Тем не менее, расположение молекул жидкости не является строго упорядоченным по всему объёму.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, как текучесть. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Движение молекул в твёрдых телах
Молекулы и атомы твёрдого тела расположены в определённом порядке и образуют кристаллическую решётку. Такие твёрдые вещества называют кристаллическими. Атомы совершают колебательные движения около положения равновесия, а притяжение между ними очень велико. Поэтому твёрдые тела в обычных условиях сохраняют объём и имеют собственную форму.
Движение молекул в физике в газах, жидкостях и твёрдых телах с примерами
Содержание:
Движение молекул:
Почему запах духов распространяется по всей комнате? Могут ли «срастись» два кусочка металла? От чего зависит скорость движения атомов и молекул? На эти и другие вопросы вы сможете ответить, прочитав этот параграф.
Тепловое движение
В соответствии с современными представлениями, атомы и молекулы, из которых состоит вещество, находятся в беспрерывном хаотическом движении. Такое движение называется тепловым.
Тепловое движение невозможно увидеть невооруженным глазом, ведь размеры молекул очень малы.
Однако существует много физических явлений, объяснить которые можно только опираясь на тот факт, что молекулы постоянно двигаются.
Определение диффузии
Бесспорным доказательством движения молекул служит физическое явление, хорошо известное вам из курса природоведения,— диффузия (от лат. diffusio — распространение, растекание).
Напомним, что диффузией называют взаимное проникновение соприкасающихся веществ друг в друга, происходящее в результате теплового (хаотического) движения молекул (атомов).
Диффузия в газах и жидкостях
Вспомните, что происходит, если где-то в комнате разлить ароматное вещество, например духи,— его запах в скором времени будет ощущаться повсюду. Это значит, что молекулы ароматного вещества, двигаясь, попадают в промежутки между молекулами воздуха, которым заполнена комната, т. е. наблюдается диффузия. Именно в результате диффузии в газах мы ощущаем запах свежеиспеченного хлеба из булочной или запах прогретой солнцем травы.
Диффузию можно наблюдать и в жидкостях. Проведем такой опыт. В прозрачный сосуд с чистой водой с помощью воронки нальем раствор медного купороса так, чтобы жидкости не смешались (рис. 2.15). Сначала мы наблюдаем резкую границу между водой и раствором медного купороса. Оставив сосуд в покое на несколько дней, мы увидим, что вся жидкость в сосуде приобрела бирюзовый цвет (рис. 2.16). Причем перемешивание жидкостей произошло без вмешательства извне. Схематически процесс диффузии изображен на рис. 2.17. Многочисленные опыты свидетельствуют, что диффузия в жидкостях протекает значительно медленнее, чем в газах. Еще медленнее происходит диффузия в твердых телах. Почему? Ответ на этот вопрос следует искать в особенностях расположения молекул газов, жидкостей и твердых тел.
Как связаны скорость движения молекул и температура
Приготовим два сосуда, как показано на рис. 2.15. Один из сосудов поставим в теплое место, второй — в холодное. Посмотрев через некоторое время на сосуды, мы убедимся, что в теплом растворе диффузия произошла намного быстрее.
В случае повышения температуры скорость диффузии в газах также увеличивается.
Зависимость скорости диффузии от температуры особенно заметна для твердых тел. Так, английский металлург Вильям Роберт Остин провел следующий опыт. Он наплавил тонкий диск золота на свинцовый цилиндр (рис. 2.18, а) и на несколько дней поместил этот цилиндр в печь, где поддерживалась температура около 400 °С. Оказалось, что золото продиф-фундировало через весь цилиндр (рис. 2.18, б); тем временем при комнатной температуре диффузия практически не наблюдалась.
Таким образом, мы выяснили, что чем выше температура вещества, тем быстрее происходит диффузия, т. е. молекулы быстрее двигаются.
Довольно сложные эксперименты показывают, что при любой температуре в веществе есть молекулы, двигающиеся довольно медленно, и молекулы, скорость которых высока. Если количество молекул вещества, имеющих высокую скорость, увеличивается, т. е. увеличивается средняя скорость молекул, то это значит, что температура вещества также увеличивается.
Диффузия в природа и ее применение в технике
Явление диффузии очень распространено в природе. Благодаря диффузии углекислый газ попадает в листву растений; кислород из воздуха — на дно водохранилищ; питательные вещества впитываются в кишечнике; кислород из легких попадает в кровь, а из крови — в ткани и т. д.
Диффузию широко применяют в технике. Одним из примеров является диффузное сваривание металлов. Куски металлов крепко прижимают друг к другу, нагревают до высокой
температуры, но ниже температуры плавления. В месте соединения происходит диффузия, и куски металлов как будто срастаются.
Атомы и молекулы, из которых состоит вещество, находятся в беспрерывном хаотическом движении. Такое движение называется тепловым, поскольку увеличение температуры вещества соответствует увеличению средней скорости движения его молекул (атомов).
Одним из доказательств движения частиц вещества является физическое явление, которое называется диффузией. Диффузия — взаимное проникновение соприкасающихся веществ друг в друга, происходящее в результате теплового хаотического движения молекул (атомов).
Движение и взаимодействие молекул
Что такое броуновское движение
Броуновское движение — хаотическое движение видимых в микроскоп малых макрочастиц, взвешенных в жидкости или газе, которое происходит под действием ударов молекул.
Это явление названо в честь шотландского ботаника Роберта Броуна (1773–1858), который первым наблюдал его в 1827 г. Рассматривая в микроскоп взвешенные в воде частички пыльцы, Броун заметил, что они непрерывно движутся, постоянно изменяя скорость.
Причина броуновского движения — хаотическое движение молекул жидкости или газа. Двигаясь, молекулы среды непрерывно бомбардируют взвешенную в ней макрочастицу (рис. 27.1). Если суммарная сила ударов с одной стороны случайно окажется больше, чем с другой, то макрочастица может начать движение; потом другие толчки изменят ее скорость.
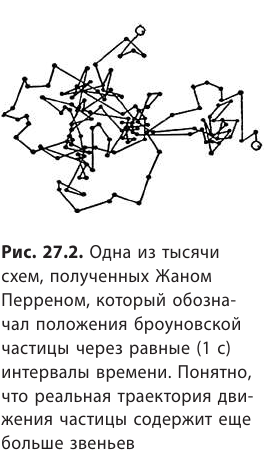
Теория броуновского движения, созданная А. Эйнштейном и польским физиком M. Смолуховским в 1905–1906 гг. и экспериментально подтвержденная французским физиком Ж. Перреном (рис. 27.2), окончательно закрепила победу атомистики.
Что такое диффузия и где ее применяют
Непрерывное хаотическое движение молекул происходит внутри любого макроскопического тела. В курсе физики 7 класса вы изучали диффузию — еще одно явление, обусловленное таким движением (от лат. diffusio — распространение, растекание).
Диффузия — процесс взаимного проникновения молекул одного вещества между молекулами другого, происходящий вследствие теплового движения молекул.
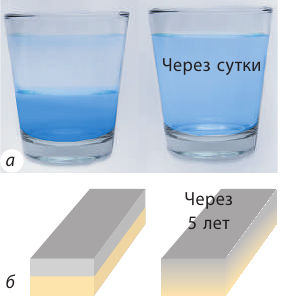
Если в стакан с водой налить подкрашенный сахарный сироп, спустя некоторое время вода в стакане окрасится и станет сладкой (рис. 27.3, а).
Рис. 27.3. Диффузия в жидкостях и твердых телах. Вследствие теплового хаотического движения молекул сироп смешался с водой в течение суток (а), две отшлифованные и прижатые друг к другу пластины свинца и золота «срослись» на 1 мм в течение 5 лет (б)
Диффузия в жидкости происходит довольно медленно, а в твердых телах она медленнее в сотни и тысячи раз (рис. 27.3). В газах диффузия протекает гораздо быстрее, чем в жидкостях, но все равно: если бы не было конвекции, запах духов распространялся бы в комнате часами. Отметим, что в любых средах скорость диффузии увеличивается с повышением температуры и давления.
Диффузные процессы очень важны для получения и обработки некоторых материалов. Диффузия в твердых телах обеспечивает соединение металлов при сварке, пайке, никелировании. С помощью диффузии поверхностный слой металлических изделий насыщают углеродом, обеспечивая их прочность (рис. 27.4).
Рис. 27.4. Цементация — процесс насыщения поверхностного слоя стали углеродом. если изготовить деталь из низкоуглеродистой стали, а затем поместить ее в высокотемпературную смесь, содержащую углерод, то благодаря диффузии поверхностный слой стали обогатится углеродом. Полученная деталь одновременно будет твердой (снаружи — крепкий чугун) и не будет разрушаться при ударных нагрузках (внутри — упругая сталь)
Разновидностью диффузии является осмос (от греч. osmos — толчок, давление) — процесс односторонней диффузии сквозь полупроницаемую перегородку (мембрану) молекул растворителя в сторону большей концентрации растворенного вещества. Например, если острым ножом отрезать дольку лимона, то сок практически не выделится; если посыпать дольку сахаром, то сок появится. Выделяясь из лимона, сок как бы стремится разбавить концентрированный раствор сахара, образовавшийся на срезе.
В природе благодаря осмосу питательные вещества и вода проникают из почвы в корни растений, из пищеварительного тракта — в организмы живых существ и непосредственно в клетки; кислород из легочных альвеол поступает в кровь и т. п. В промышленности осмос используют для очистки воды, производства напитков, получения некоторых полимеров.
Как быстро движутся молекулы
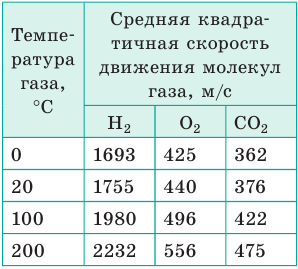
Молекулы в газах движутся очень быстро — со скоростью пули (см. таблицу), но далеко «улететь» не могут, поскольку ежесекундно испытывают более миллиарда столкновений с другими молекулами. Поэтому траектории движения молекул представляют собой сложные ломаные линии, подобные траектории движения броуновской частицы.
Обратите внимание! В веществе всегда есть молекулы, движущиеся медленно, и молекулы, скорость движения которых огромна. В результате столкновений скорости молекул непрерывно изменяются. Описать движение даже одной молекулы невозможно, да и не нужно. Важно знать, к какому результату приводит движение всей совокупности молекул данного объекта.
Как была измерена скорость движения молекул
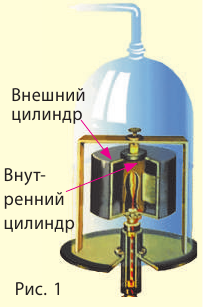
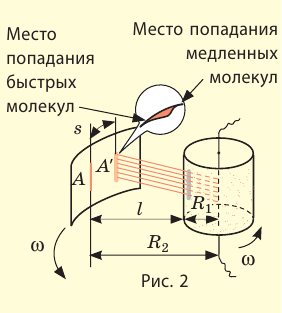
Впервые скорость движения молекул измерил немецкий физик Отто Штерн (1888–1969) в 1920 г. Для опыта Штерн изготовил устройство (см. рис. 1), состоящее из двух жестко связанных пустых цилиндров, надетых на общую ось; стенка внутреннего цилиндра имела щель. Вдоль оси была натянута металлическая нить, покрытая слоем серебра. Воздух из цилиндров был откачан. Когда по нитке пропускали ток, серебро испарялось и внутренний цилиндр заполнялся атомами Аргентума, часть которых проходила сквозь щель и оседала на внутренней стенке внешнего цилиндра. В результате напротив щели образовывалась тонкая полоска серебра (А на рис. 2).
При вращении цилиндров полоска серебра становилась размытой и образовывалась не напротив щели, а на определенном расстоянии s от полоски А (полоска A’). Ведь пока атомы Аргентума проходили расстояние l (см. рис. 2), цилиндры поворачивались. Чем быстрее двигались атомы, тем ближе к полоске А они оседали.
Зная радиусы цилиндров, угловую скорость ω их вращения и измерив расстояние s, Штерн определил скорости v движения атомов Аргентума. Действительно, время движения атомов от щели до внешнего цилиндра равна 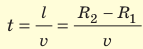
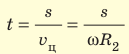
Таким образом, 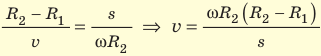
Как и почему взаимодействуют молекулы
Убедиться в том, что молекулы притягиваются друг к другу, достаточно просто. Попробуйте, например, разорвать стальную проволоку или разломить кирпич — это будет сложно, хотя предметы состоят из отдельных частиц. Тот факт, что твердые тела и жидкости не распадаются на отдельные молекулы, превращаясь в газ, тоже говорит о том, что между молекулами существуют силы притяжения. Вместе с тем молекулы отталкиваются друг от друга. В этом легко убедиться, попробовав сжать ту же проволоку или тот же кирпич, — вряд ли вам это удастся.
МКТ утверждает: между молекулами одновременно существуют как силы притяжения, так и силы отталкивания. Основная причина наличия этих сил — электрическое притяжение и отталкивание заряженных частиц, образующих атом: положительно заряженное ядро одного атома притягивается к отрицательно заряженному электронному облаку другого атома; вместе с тем и ядра атомов отталкиваются друг от друга, и электронные облака. Если расстояние r между молекулами меньше размеров d самих молекул (r d) начинают преобладать силы притяжения и молекулы притягиваются друг к другу. Таким образом, на расстоянии r=d молекулы находятся в состоянии устойчивого равновесия: при отклонениях молекулы от этого положения межмолекулярные силы стремятся вернуть ее в состояние равновесия.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Движение молекул
Вы будете перенаправлены на Автор24
Кинетическая энергия молекулы
В газе молекулы совершают свободное (изолированное от других молекул) движение, лишь время от времени сталкиваясь друг с другом или со стенками сосуда. До тех пор, пока молекула совершает свободное движение, у нее имеется только кинетическая энергия. Во время столкновения у молекул появляется и потенциальная энергия. Таким образом, полная энергия газа представляют сумму кинетической и потенциальной энергий ее молекул. Чем разреженное газ, тем больше молекул в каждый момент времени пребывает в состоянии свободного движения, имеющих только кинетическую энергию. Следовательно, при разрежении газа уменьшается доля потенциальной энергии в сравнении с кинетической.
Средняя кинетическая энергия молекулы пpи равновесии идеального газа обладает одной очень важной особенностью: в смеси различных газов средняя кинетическая энергия молекулы для различных компонентов смеси одна и та же.
Например, воздух представляет собой смесь газов. Средняя энергия молекулы воздуха для всех его компонентов пpи нормальных условиях, когда воздух еще можно рассматривать как идеальный газ, одинакова. Данное свойство идеальных газов может быть доказано на основании общих статистических соображений. Из него вытекает важное следствие: если два различных газа (в разных сосудах) находятся в тепловом равновесии друг с другом, то средние кинетические энергии их молекул одинаковы.
В газах обычно расстояние между молекулами и атомами значительно больше, чем размеры самих молекул, силы взаимодействия молекул не велики. Вследствие чего газ не имеет собственной формы и постоянного объема. Газ легко сжимается и может неограниченно расширяться. Молекулы газа движутся свободно (поступательно, могут вращаться), лишь иногда сталкиваясь с другими молекулами и стенками сосуда, в котором находится газ, причем движутся с очень большими скоростями.
Движение частиц в твердых телах
Строение твёрдых тел принципиально отлично от строения газов. В них межмолекулярные расстояния малы и потенциальная энергия молекул сравнима с кинетической. Атомы (или ионы, или целые молекулы) нельзя назвать неподвижными, они совершают беспорядочное колебательное движение около средних положений. Чем больше температура, тем больше энергия колебаний, а следовательно, и средняя амплитуда колебаний. Тепловыми колебаниями атомов объясняется и теплоемкость твёрдых тел. Рассмотрим подробнее движения частиц в кристаллических твердых телах. Весь кристалл в целом представляет собой очень сложную связанную колебательную систему. Отклонения атомов от средних положений невелики, и поэтому можно считать, что атомы подвергаются действию квазиупругих сил, подчиняющихся линейному закону Гука. Такие колебательные системы называются линейными.
Готовые работы на аналогичную тему
Существует развитая математическая теория систем, подверженных линейным колебаниям. В ней доказана очень важная теорема, суть которой состоит в следующем. Если система совершает малые (линейные) взаимосвязанные колебания, то путем преобразования координат ее формально можно свести к системе независимых осцилляторов (у которых уравнения колебаний не зависят друг от друга). Система независимых осцилляторов ведет себя подобно идеальному газу в том смысле, что атомы последнего тоже можно рассматривать как независимые.
Именно используя представление о независимости атомов газа, мы приходим к закону Больцмана. Этот очень важный вывод представляет простую и надежную основу для всей теории твёрдого тела.
Число осцилляторов с заданными параметрами (координаты и скорости) определяется так же, как и число молекул газа в заданном состоянии, по формуле:
Закон Больцмана (1) в теории твёрдого тела не имеет ограничений, однако формула (2) для энергии осциллятора взята из классической механики. Пpи теоретическом рассмотрении твёрдых тел нужно опираться на квантовую механику, для которой характерна дискретность изменения энергии осциллятора. Дискретность энергии осциллятора становится несущественной только пpи достаточно высоких значениях его энергии. Это значит, что (2) можно пользоваться лишь пpи достаточно высоких температурах. Пpи высоких температурах твёрдого тела, близких к температуре плавления, из закона Больцмана вытекает закон равномерного распределения энергии по степеням свободы. Если в газах на каждую степень свободы в среднем приходится количество энергии, равное (1/2) kT, то у осциллятора одна степень свободы, кроме кинетической, имеет потенциальную энергию. Поэтому на одну степень свободы в твёрдом теле пpи достаточно высокой температуре приходится энергия, равная kT. Исходя из этого закона, нетрудно рассчитать полную внутреннюю энергию твердого тела, а вслед за ней и его теплоемкость. Моль твердого тела содержит NA атомов, а каждый атом имеет три степени свободы. Следовательно, в моле содержится 3 NA осцилляторов. Энергия моля твердого тела
а молярная теплоемкость твердого тела пpи достаточно высоких температурах
Это закон Дюлонга и Пти: все простые (одноатомные) твёрдые тела в области высоких температур имеют одну и ту же, не зависящую от температуры, молярную теплоемкость, равную 3R.
Опыт подтверждает этот закон.
Жидкости занимают промежуточное положение между газами и твердыми телами. Молекулы жидкости не расходятся на большие расстояния, и жидкость в обычных условиях сохраняет свой объем. Но в отличие от твердых тел молекулы не только совершают колебания, но и перескакивают с места на место, то есть совершают свободные движения. При повышении температуры жидкости кипят (существует так называемая температура кипения) и переходят в газ. При понижении температуры жидкости кристаллизуются и становятся твердыми веществами. Существует такая точка в поле температур, в которой граница между газом (насыщенным паром) жидкостью исчезает (критическая точка). Картина теплового движения молекул в жидкостях вблизи температуры затвердевания очень похожа на поведение молекул в твердых телах. К примеру, коэффициенты теплоемкости прочти совпадают. Так как теплоемкость вещества при плавлении изменяется слабо, то можно сделать вывод, что характер движения частиц в жидкости близок движению в твердом теле (при температуре плавления). При нагревании свойства жидкости постепенно изменяются, и она становится более похожа на газ. У жидкостей средняя кинетическая энергия частиц меньше потенциальной энергии их межмолекулярного взаимодействия. Энергия межмолекулярного взаимодействия в жидкости и твердых телах отличаются несущественно. Если сравнить теплоту плавления и теплоту испарения, то увидим, что при переходе из одного агрегатного состояния в другое теплота плавления существенно ниже, теплоты парообразования. Адекватное математическое описание структуры жидкости может быть дано лишь с помощью статистической физики. Например, если жидкость состоит из одинаковых сферических молекул, то ее структуру можно описать радиальной функцией распределения g(r), которая дает вероятность обнаружения какой-либо молекулы на расстоянии r от данной, выбранной в качестве точки отсчета. Экспериментально эту функцию можно найти, исследуя дифракцию рентгеновских лучей или нейтронов, можно провести компьютерное моделирование этой функции, используя механику Ньютона.
Кинетическая теория жидкости была разработана Я.И. Френкелем. В этой теории жидкость рассматривается, как и в случае твердого тела, как динамическая система гармонически осцилляторов. Но в отличие от твердого тела положение равновесия молекул в жидкости имеет временный характер. Поколебавшись около одного положения, молекула жидкости перескакивает в новое положение, расположенное по соседству. Такой перескок происходит с затратой энергии. Среднее время «оседлой жизни» молекулы жидкости можно рассчитать как:
\[\left\langle t\right\rangle =t_0e^<\frac
У молекулы воды, например, при комнатной температуре, одна молекула совершает около 100 колебаний и перескакивает в новое положение. Силы притяжения между молекулам жидкости велики, чтобы сохранялся объем, но ограниченность оседлой жизни молекул ведет к возникновению такого явления, как текучесть. Во врем колебаний частицы около положения равновесия они непрерывно соударяются друг с другом, поэтому даже малое сжатие жидкости приводит к резкому «ожесточению» соударений частиц. Это означает резкое повышение давления жидкости на стенки сосуда, в котором ее сжимают.
Согласно закону Дюлонга и Пти моль химически простых веществ при температурах, близких к температуре плавления, имеет теплоемкость:
Удельная теплоемкость меди:
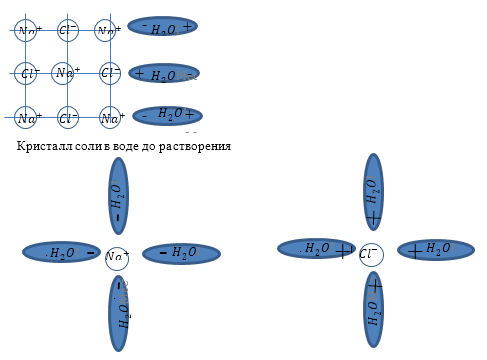
Задание: Объясните упрощённо с точки зрения физики процесс растворения соли (NaCl) в воде.
Между ионами Na+ и Cl— хлора и полярными молекулами воды возникает ионно-дипольная связь. Она оказывается прочнее, чем ионные связи в молекулах поваренной соли. В результате этого процесса связь между ионами, расположенными на поверхности кристаллов NaCl, ослабляется, ионы натрия и хлора отрываются от кристалла, а молекулы воды образуют вокруг них так называемые гидратные оболочки. Отделившиеся гидратированные ионы под влиянием теплового движения равномерно распределяются между молекулами растворителя.