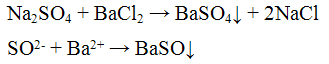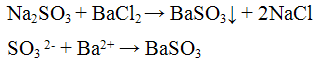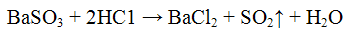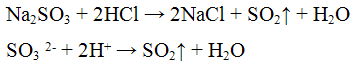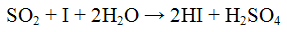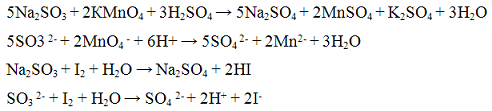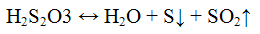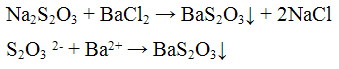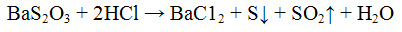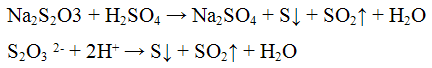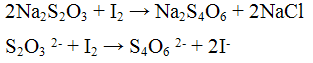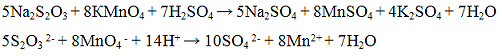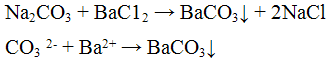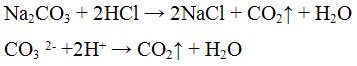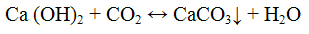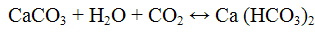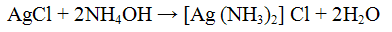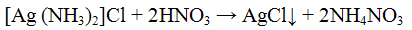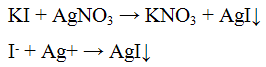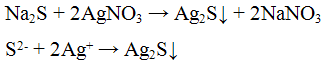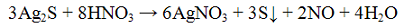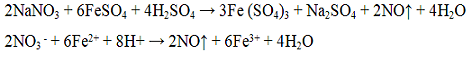в чем можно растворить нерастворимый в воде сульфит бария
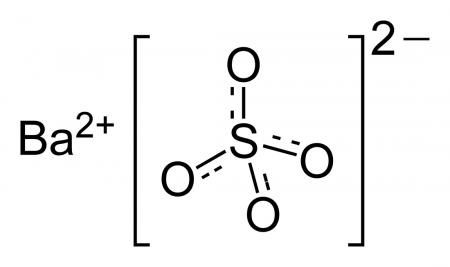
Сульфат бария
| Сульфат бария | |
|---|---|
 | |
 | |
| Систематическое наименование | Сульфат бария |
| Хим. формула | BaSO4 |
| Рац. формула | BaSO4 |
| Состояние | твёрдый |
| Молярная масса | 233.43 г/моль |
| Плотность | 4.5 г/см³ |
| Температура | |
| • плавления | 1580 °C |
| • разложения | 2912 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0,0002448 г/100 мл (20 °C) 0,000285 г/100 мл (30 °C) |
| Рег. номер CAS | 7727-43-7 |
| PubChem | 24414 |
| Рег. номер EINECS | 231-784-4 |
| SMILES | |
| RTECS | CR0600000 |
| ChEBI | 133326 |
| ChemSpider | 22823 |
| Токсичность | не токсичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат бария (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Содержание
Получение
Сульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
Последняя реакция используется также для получения пероксида водорода.
В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и декантируется.
Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Химические свойства
Сульфат бария нерастворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов.
Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
BaSO4 + 4C → BaS + 4CO
При температурах выше 1600 °C разлагается:
2BaSO4 → 2BaO + 2SO2 + O2
Токсичность
Сульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих смесей, используемых в качестве белых пигментов:
Употребляется как клеевая краска, так как нерастворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сероводорода.
Другие применения
Сульфат бария используется для различных промышленных целей:
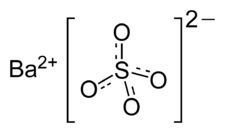
Сульфат бария
| Сульфат бария | |
  | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфат бария |
| Химическая формула | BaSO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердый |
| Отн. молек. масса | 233.43 а. е. м. |
| Плотность | 4.5 г/см³ |
| Термические свойства | |
| Температура плавления | 1580 °C |
| Химические свойства | |
| Растворимость в воде | 0.000115 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7727-43-7 |
Сульфа́т ба́рия (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Содержание
Получение
Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Химические свойства
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
При температуре свыше 1600 °C разлагается:
Токсичность
Сульфат бария не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и именно поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в растворе соляной кислоты, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («бариевую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих часть смесей, используемых в качестве белых пигментов:
Употребляется как клеевая краска, так как не растворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сернистого водорода.
Пиротехника
Сульфат бария используется как цветовой компонент для пиротехнических средств, так как ионы бария способствуют окрашиванию пламени в зеленый цвет. В настоящее время для этих целей в основном используют нитрат бария, за счет того, что он является сильным окислителем и способствует энергичному горению пиротехнической смеси.
Другие применения
Сульфат бария используется для различных промышленных целей:
В чем можно растворить нерастворимый в воде сульфит бария
Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для начала запишем молекулярные формулы данных веществ: ,
,
,
,
Сульфат бария является нерастворимой солью, поэтому не будет вступать в реакцию с приведенными веществами.
Перманганат калия не вступает в РИО с гидрокарбонатом калия и гидроксидом калия, так как имеют одинаковый катион. С сульфитом натрия реакция невозможна, так как образуются растворимые соли.
Гидрокарбонат калия и гидроксид калия тоже имеют общий ион, но реакция между ними возможна с образованием средней соли карбоната калия и будет относиться к РИО. С сульфитом натрия реакция невозможна, так как образуются растворимые соли.
Сульфит натрия не реагирует с гидроксидом калия по причине образования в ходе реакции растворимых веществ.
Таким образом, вариант ответа только один:
→
→
→
Лабораторная работа № 7.
Ход работы:
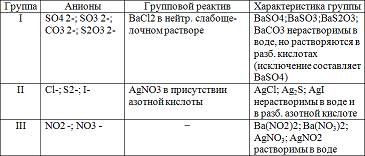
Задание 1: Проделать частные реакции анионов I, II, III групп. Результаты работы оформить в виде таблицы:
Реакции сульфит-иона SO3 2-.
Реакция с хлоридом бария ВаС12.
Хлорид бария ВаС12 с сульфит- ионами SO3 2- образует кристаллический осадок сульфит бария BaSO3 белою цвета:
Осадок сульфита бария растворяется в соляной и азотной кислотах с выделением оксида серы (IV), обладающего характерным запахом:
Реакция с кислотами. Кислоты разлагают все сульфиты с выделением оксида серы (IV):
Выделяющийся оксид серы (IV) обесцвечивает растворы йода или перманганата калия, например:
Эта реакция используется для определения общего количества SO? о сыром очищенном, сульфитированом картофеле.
Реакции тиосульфат — иона S2O3 2-. Тиосерная кислота H2S2O3 неустойчива, разлагается на оксид серы (IV), серу и воду:
Осадок тиосульфата бария растворяется при нагревании в минеральных кислотах с выделением серы:
Реакция с кислотами. Минеральные кислоты разлагают тиосульфаты, при этом выделяются в виде осадка бледно-желтого цвета и оксид серы (IV);
Эта реакция лежит в основе иодометрического метода определения содержания сахара в продуктах питания
Угольная кислота дает два типа солей: карбонаты и гидрокарбонаты (НСО3). Карбонаты щелочных металлов и аммония растворимы в воде. Нерастворимые в воде карбонаты растворяются в уксусной и минеральных кислотах.
Реакция с хлоридом бария ВаС12. Хлорид бария ВаС12 с ионами СО3 2- дает осадок белого цвета, растворимый в минеральных и уксусной кислотах:
Реакция с кислотами. Карбонаты разлагаются разбавленными кислотами с выделением оксида углерода (IV) по уравнению:
Выделяющийся оксид углерода (IV) открывают по помутнению известковой или баритовой воды
Не следует продолжительное время пропускать оксид углерода (IV) через известковую пли баритовую воду, так как избыток СO2 превращает карбонаты в растворимые гидрокарбонаты
Реакции анионов второй аналитической группы: Сl-, I-, S2-.
Реакция с нитратом серебра AgNO3. Нитрат серебра AgNO3 с ионами Сl- образует белый творожистый осадок хлорида серебра:
Осадок хлорида серебра хорошо растворяется в растворе гидроксида аммония:
При подкислении азотной кислотой аммиачного раствора хлорида серебра вновь выпадает белый творожистый осадок хлорида серебра.
Реакция с нитратом серебра AgNO3,
Нитрат серебра AgNO3 с ионами I- образует желтый творожистый осадок иодида серебра:
Осадок нерастворим в минеральных кислотах и растворе аммиака.
Реакции сульфид — иона S2-.
Реакция с нитратом серебрa AgNO3. Нитрат серебра AgNO3 с попами S2- образует черный осадок сульфида серебра:
Осадок сульфида серебра нерастворим в растворе NH4OH, но растворяется при нагревании в растворе азотной кислоты HNO3
Реакция с кислотами. Разбавленные кислоты HCl, H2SO4 разлагают сульфиды с выделением сероводорода H2S:
Сероводород можно обнаружить по запаху (тухлых яиц) и по почернению бумажки, пропитанной солью свинца Эта реакция используется для определения сероводорода в мясных полуфабрикатах и полуфабрикатах из соленой рыбы. Присутствие сероводорода указывает на глубокий распад белков.
Выделяющийся оксид азота (II) образует с FeSO4 непрочное комплексное соединение [Fe(NO)]SO4 бурого цвета.
Реакция с дифениламином.
Контрольные вопросы:
1. Почему анионы I руины нельзя осаждать ВаСl2 в кислой среде?
2. Почему анионы II группы необходимо осаждать AgNO3 в присутствии HNO3?
3. Чем отличаются анионы III группы от анионов I и II групп?
5. Какие анионы служат окислителями, и какие восстановителями?
Дата добавления: 2015-11-10 ; просмотров: 8485 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Частные реакции анионов первой аналитической группы. Действие группового реагента
Групповым реагентом является хлорид бария в нейтральном или слабощелочном растворе. Хлорид бария со всеми аннонами первой аналитической группы дает осадки белого цвета, за исключением хромата бария ВаСrО4 — желтого цвета. Кроме того, все осадки, за исключением BaSO4, растворяются в азотной кислоте. Осадок бората бария Ва(ВО2)2 выпадает только из концентрированных растворов, осадок тиосульфата бария BaS2O3 образуется только при прибавлении избытка ВаСl2.
Реакции обнаружения сульфат-иона SO 2- 4
1. Групповой реагент хлорид бария ВаСl2 образует с растворами, содержащими сульфат-ионы, белый осадок BaSO4, практически нерастворимый в кислотах:
Реакция является фармакопейной.
2. Соли свинца (II) осаждают из растворов сульфатов белый осадок PbSO4:
Осадок PbSO4 растворяется при нагревании в щелочах и ацетате аммония:
Образующиеся плюмбиты и комплексная соль ацетата и сульфата свинца растворимы в воде.
Реакции обнаружения сульфит-иона SO 2- 3
1. Групповой реагент ВаСl2 с солями сернистой кислоты дает белый кристаллический осадок BaSO3:
BaSO3 растворяется в сильных кислотах, выделяя SO2:
2. Разбавленные минеральные кислоты разлагают соли сернистой кислоты с выделением оксида серы (IV), имеющего характерный запах жженой серы:
Оксид серы (IV) обнаруживают также по его способности обесцвечивать растворы йода или перманганата калия:
3. Раствор йода I2 обесцвечивается не только оксидом серы (IV), но и растворами сульфитов:
Реакции обнаружения тиосульфат-иона S2O 2- 3
Соли щелочных металлов этой кислоты устойчивы и являются сильными восстановителями.
1. Хлорид бария ВаСl2 образует с ионом S2O 2- 3 белый осадок тиосульфата бария BaS2O3:
Осадок растворим в кипящей воде и в разбавленных минеральных кислотах, кроме серной.
2. Минеральные разбавленные кислоты вытесняют из тиосульфатов тиосерную кислоту H2S2O3:
Тиосерная кислота разлагается:
От выделяющейся серы раствор мутнеет. Нагревание ускоряет реакцию. Выделение свободной серы отличает ион S2O 2- 3 от иона SO 2- 3. Реакция является фармакопейной.
3. Нитрат серебра AgNO3 дает в растворах солей тиосерной кислоты белый осадок Ag2S2O3:
Осадок постепенно буреет и в конце концов становится черным вследствие образования Ag2S:
Соль Ag2S2O3 растворима в избытке раствора тиосульфата натрия с образованием комплексного соединения:
При проведении этой реакции необходимо добавлять избыток нитрата серебра. Это одна из наиболее характерных реакций на тиосульфат-ион.
Ортоборная (борная) кислота Н3ВО3 представляет собой твердое вещество белого цвета. Соли борной кислоты неизвестны и являются производными либо метаборной кислоты НВО2, либо тетраборной Н2В4О7. Из борнокислых солей растворимы в воде только соли щелочных металлов, из которых самой важной является тетраборат натрия (бура) Na2B4O7 • 10Н2О. Бура как соль слабой кислоты гидролизуется, водный раствор ее имеет щелочную реакцию:
1. Хлорид бария ВаСl2 осаждает из концентрированных растворов буры белый осадок метабората бария Ва(ВО2)2:
Осадок метабората бария растворим в разбавленных уксусной, соляной и азотной кислотах.
2. Куркумовая бумага (бумага, пропитанная раствором красителя куркумина). Бумага, смоченная подкисленным раствором бората или борной кислоты, после высыхания окрашивается в красно-бурый цвет. Если на окрашенное место подействовать щелочью, то красно-бурый цвет меняется на сине-черный или серо-черный (в зависимости от концентрации борат-иона). Проведению этих реакций мешают окислители. Реакция очень характерна и является фармакопейной.
3. Этиловый спирт и концентрированная серная кислота с сухой борной кислотой или сухими боратами образуют борноэтиловый эфир, окрашивающий пламя в характерный зеленый цвет:
С метиловым спиртом образуется борнометиловый эфир:
Реакции мешают хлориды и бромиды меди, которые также окрашивают бесцветное пламя в зеленый цвет. Реакция является фармакопейной.
Реакции обнаружения фосфат-иона РО4 3-
Нерастворимые в воде фосфаты, гидрофосфаты и дигидрофосфаты хорошо растворяются в минеральных кислотах. Большинство из них растворяется также в уксусной кислоте.
1. Хлорид бария ВаСl2 образует с раствором Na2HPO4 белый осадок ВаНРО4, растворимый в кислотах (кроме H2SO4):
Если проводить реакцию в присутствии щелочей или аммиака, то ионы НРО4 2- превращаются в РО4 3- и осаждается средняя соль.
2. Магнезиальная смесь (водный раствор аммиака, хлорида аммония и хлорида магния) дает с ионом РО4 3- белый кристаллический осадок магнийаммоний фосфата MgNH4PO4:
Осадок легко растворяется в кислотах и не растворяется в растворе аммиака. Эта реакция характерна для фосфат-иона РО4 3- и является фармакопейной.
3. Молибдат аммония (NH4)2MoO4 в азотнокислых растворах фосфатов при нагревании дает желтый кристаллический осадок фосформолибдата аммония:
Осадок растворяется в щелочах и растворе аммиака, но не растворяется в азотной кислоте. Он растворяется также в избытке гидрофосфата натрия, поэтому к нагретому реагенту надо прибавлять исследуемый раствор, а не наоборот.
Присутствие ионов SO3 2- и S2O3 2- мешает реакции, так как эти ионы восстанавливают Mo(VI) и раствор окрашивается в синий цвет.
Эта реакция применяется для обнаружения фосфатов в моче и является фармакопейной.
4. Нитрат серебра AgNO3 образует с растворами солей фосфорной кислоты желтый осадок фосфата серебра, растворимый в азотной кислоте:
Осадок растворяется также в растворе гидроксида аммония с образованием комплексной соли:
Реакция является фармакопейной.
Реакции обнаружения карбонат-иона СO3 2-
1. Хлорид бария ВаСl2 дает с ионом СO3 2— белый осадок ВаСО3:
СO3 2— + Ва 2+ = ВаСО3.
Как и все карбонаты, ВаСО3 легко растворяется в уксусной и минеральных кислотах.
2. Кислоты. Важнейшей реакцией на карбонат-ион является реакция разложения карбонатов с помощью разбавленных минеральных кислот. При этом с шипением выделяются пузырьки диоксида углерода:
Выделяющийся углекислый газ можно легко обнаружить с помощью газоотводной трубки, опущенной в известковую воду. Выпадает белый осадок карбоната кальция:
Реакция является фармакопейной.
3. Сульфат магния образует в растворах карбонатов белый осадок карбоната магния:
Осадок растворим в кислотах. Гидрокарбонаты образуют осадок с MgSO4 только при кипячении.
Реакция является фармакопейной.
4. Фенолфталеин. Карбонаты и гидрокарбонаты щелочных металлов гидролизуются и имеют щелочную реакцию среды:
При добавлении фенолфталеина в водный раствор этих солей появляется розовая окраска.
Реакции обнаружения оксалат-иона С2О4 2-
Оксалат-ион С2О4 2- — анион щавелевой кислоты Н2С2О4. Щавелевая кислота представляет собой кристаллическое вещество белого цвета, хорошо растворимое в воде. Слабый электролит.
1. Хлорид бария ВаСl2 образует с С2О4 2- белый творожистый осадок оксалата бария ВаС2О4:
Осадок ВаС2О4 легко растворяется в соляной и азотной кислотах, а в уксусной кислоте растворяется при кипячении.
2. Хлорид кальция СаСl2 дает с ионом С2О4 2- белый мелкокристаллический осадок оксалата кальция СаС2О4:
не растворимый в уксусной кислоте даже при кипячении но легко растворяющийся в НСl и HNO3.
Эта соль входит в состав мочевых камней.
3. Перманганат калия КМnО4 в присутствии серной кислоты при слабом нагревании окисляет ионы С2О4 2- до диоксида углерода СО2, а сам восстанавливается до бесцветного иона Мn 2+ и раствор обесцвечивается:
Реакция широко используется в количественном анализе.
Реакции обнаружения хромат-иона СrО4 2-
О соединениях хрома написано в § 11.1.
1. Хлорид бария ВаСl2 с хромат-ионом образует желтый осадок хромата бария ВаСrО4:
Осадок растворим в минеральных кислотах, но не растворяется в уксусной кислоте. Дихромат-ионы Сr2О7 образуют желтый осадок с хлоридом бария только в присутствии ацетата натрия (см. § 10.3).
2. Нитрат свинца (II) Pb(NO3)2 дает с хромат-ионами осадок желтого цвета:
Осадок растворяется в азотной кислоте и щелочах.
3. Нитрат серебра AgNO3 при взаимодействии с хроматами щелочных металлов дает кирпично-красный осадок хромата серебра Ag2CrO4:
Осадок растворим в азотной кислоте и растворе аммиака, но не растворяется в уксусной кислоте.
4. Пероксид водорода в кислой среде окисляет дихромат-ионы Сr2О7 2- до надхромовои кислоты синего цвета:
В водных растворах надхромовая кислота очень неустойчива и разлагается с образованием солей хрома (III). Синий цвет раствора переходит в зеленый. При добавлении к водному раствору надхромовои кислоты амилового спирта С5Н11ОН или диэтилового эфира (С2Н5)2О кислота переходит при встряхивании в органический слой, который окрашивается в синий цвет.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Какие химические элементы способны к образованию анионов? Приведите примеры.
2. Как классифицируются анионы по своим ОВ-свойствам?
3. Какие анионы проявляют свойства как окислителя, так и восстановителя?
4. Как анионы подразделяются на группы?
5. Почему открытие анионов в отличие от катионов обычно ведут дробным методом?
6. Какова биологическая роль элементов, входящих в состав анионов: а) углерода и кремния; б) фосфора; в) кислорода; г) серы; д) фтора; е) хлора; ж) йода?
7. Перечислите важнейшие химические соединения анионов первой группы, применяемых в медицине.
8. Бариевая соль какого аниона первой аналитической группы не растворяется в кислотах?
9. Какой анион первой аналитической группы дает осадок желтого цвета с групповым реагентом?
10. С помощью какой реакции можно обнаружить сульфит-ион SO 2- 3 в присутствии карбонат-иона? Напишите уравнение реакции.
11. Какая реакция позволяет отличить тиосульфат-ион S2O 2- 3 от сульфит-иона SO 2- 3?
12. Какая реакция является характерной и одновременно фармакопейной для обнаружения: а) борат-ионов; б) фосфат-ионов?
13. Какие анионы могут мешать обнаружению карбонат-ионов? Как устранить мешающее действие некоторых анионов при обнаружении карбонат-иона?
15. Как взаимодействуют хроматы и дихроматы с пероксидом водорода?
Дата добавления: 2014-11-13 ; просмотров: 145 ; Нарушение авторских прав