в чем может проявляться цитопатическое действие вирусов
Цитопатический эффект, определение, классификация.
(Бабичев, стр. 306, Методичка, стр. 45)
Цитопатическое действие вирусов может проявляться в виде следующих изменений:
1. Равномерная мелкозернистая деструкция клеток (полиовирусы, вирусы Коксаки и др.).
2. Очаговая мелкозернистая дегенерация клеток (вирус гриппа, клещевого энцефалита и др.).
3. Гроздевидная дегенерация клеток (аденовирусы).
4. Крупнозернистая равномерная деструкция клеток (вирус герпеса).
5. Симпластообразование (респираторно-синцитиальный вирус, вирус кори и другие).
12. Методы типирования вирусов. (Бабичев, стр. 306)
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации;
5) нейтрализация в опытах на животных.
Кроме того, для идентификации вирусов применяют методы иммунофлуоресценции, ДНК – ДНК-(РНК – РНК) – гибридизации, а также ПЦР.
13. Сущность реакции гемадсорбции. (Бабичев, стр. 306, Методичка, стр. 46)
Гемадсорбция – это адсорбция эритроцитов на поверхности пораженных вирусом клеток.
Некоторые вирусы, в частности вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей).
При вирусной гемадсорбции эритроциты прочно фиксированы на клетках и сохраняются на них после 1-2-кратного отмывания. Адсорбируясь на поверхности пораженных вирусом клеток, эритроциты образую характерные скопления.
14. Сущность метода цветных проб. (Методичка, стр. 46)
Цветная реакция. В основу реакции положено то обстоятельство, что в процессе размножения и роста клеток в питательной среде накапливаются кислые продукты обмена веществ, снижающие рН среды.
В ткани, зараженной вирусом, наступает дегенерация клеток, в силу чего подавляется их метаболизм и не происходит изменение рН среды. Для выявления этих изменений в питательную среду добавляют индикатор феноловый красный. При рН выше 7 цвет индикатора красный, при рН 7 – оранжевый и при рН ниже 7 – желтый.
Если клетки не заражены вирусом (или он нейтрализован специфической сывороткой), рH питательной среды сдвигается в кислую сторону, и она становится желтой. В случае размножения вируса клетки дегенерируют, и среда сохраняет исходный красный цвет.
Метод цветных проб может быть использован для титрования вируса или вируснейтрализирующих антител.
15. Сущность метода бляшек. (Методичка, стр. 46)
Метод бляшек предложен Р. Дюльбекко для получения изолированных колоний вируса. В основе метода лежит появление в монослое зараженных вирусом клеток обесцвеченных участков, состоящих из дегенерированных клеток. Эти участки, получившие название бляшек, представляют собой колонии вируса, образующегося из одной вирусной частицы.
Метод заключается в следующем. В специальном флаконе на стенке выращивают монослой клеток, затем удаляют питательную среду. Клетки заражают вирусом и заливают агаром, содержащим индикатор нейтральный красный. Там, где происходит рост клеток, среда изменится в кислую сторону, и индикатор окрасится в розовый цвет. На тех участках, где клетки погибли под действием вируса, рН среды и, следовательно, цвет индикатора не изменяется. Такие островки неокрашенной среды имеют вид беловатых бляшек разной формы и величины, что зависит от вида вируса.
ЦИТОПАТИЧЕСКИЙ ЭФФЕКТ
Ц. э, заражённой культуры определяют визуально, гистохимич, методами, различными методами окраски. Феномен Ц. э. используют для диагностики, идентификации и титрования вирусов в культуре клеток.
Лит.: Руководство по ветеринарной вирусологии, под ред. В. Н. Сюрина, М., 1966; Сергеев В. А., Репродукция и выращивание вирусов животных, М., 1976.
Полезное
Смотреть что такое «ЦИТОПАТИЧЕСКИЙ ЭФФЕКТ» в других словарях:
ИНФЕКЦИОННЫЙ НЕКРОЗ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ — см. ИНФЕКЦИОННЫЙ НЕКРОЗ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ (ИНПЖ) остро протекающая вирусная болезнь молоди некоторых видов лососевых рыб. Она характеризуется нарушением координации движения, потемнением кожного покрова, поражением поджелудочной железы,… … Болезни рыб: Справочник
Вирусологи́ческие ме́тоды иссле́дования — методы изучения биологии вирусов и их идентификации. В вирусологии широко используются методы молекулярной биологии, с помощью которых удалось установить молекулярную структуру вирусных частиц, способы проникновения их в клетку и особенности… … Медицинская энциклопедия
Геморрагическая лихорадка Марбург — МКБ 10 A98.498.4 МКБ 9 078.89078.89 DiseasesDB … Википедия
Вирус Марбург — Геморрагическая лихорадка Марбург (синонимы: болезнь Марбурга, геморрагическая лихорадка Мариди; Marburg disease англ.) острая вирусная болезнь, характеризующаяся тяжёлым течением, высокой летальностью, геморрагическим синдромом, поражением… … Википедия
ИНФЕКЦИОННЫЙ ЛАРИНГОТРАХЕИТ ПТИЦ — Сгустки крови в трахее курицы при инфекционном ларинготрахеите. Сгустки крови в трахее курицы при инфекционном ларинготрахеите. инфекционный ларинготрахеит птиц (Laryngotracheitis infectiosa avium), контагиозная вирусная болезнь,… … Ветеринарный энциклопедический словарь
КОНТАГИОЗНАЯ ЭКТИМА ОВЕЦ И КОЗ — Рис. 1. Элементарные тельца вируса контагиозной эктимы овец и коз в мазке из везикулярной жидкости больной овцы (окраска по Морозову). Рис. 1. Элементарные тельца вируса контагиозной эктимы овец и коз в мазке из везикулярной жидкости больной овцы … Ветеринарный энциклопедический словарь
ЦПЭ — Центристская партия Эстонии полит., Эстония Источник: http://www.regnum.ru/expnews/252919.html ЦПЭ цитопатический эффект мед. Источник: http://microbiologu.ru/mikroorganizmyi/fiziologiya mikroorganizmov/kultivirovanie i indikatsiya vi 2.html ЦПЭ … Словарь сокращений и аббревиатур
ВИРУСНАЯ ГЕМОРРАГИЧЕСКАЯ СЕПТИЦЕМИЯ ФОРЕЛИ — см. ВИРУСНАЯ ГЕМОРРАГИЧЕСКАЯ СЕПТИЦЕМИЯ ФОРЕЛИ (VHS ВГС) контагиозная заразная болезнь. Кроме радужной форели (Salmo gairdneri), болеют и некоторые лососевые рыбы других видов. Характеризуется септическими (вирусемическими) процессами, а также… … Болезни рыб: Справочник
энзоотический гепатит рогатого скота — (Hepatitis enzootica bovum), лихорадка долины Рифт, природно очаговая, трансмиссивная болезнь, характеризующаяся некротическими поражениями печени, геморрагическим диатезом, гастроэнтеритом и абортами. Распространён в странах Восточной, Южной и… … Ветеринарный энциклопедический словарь
В чем может проявляться цитопатическое действие вирусов
Вирусы являются внутриклеточными инфекционными агентами. Весь репликативный цикл вируса осуществляется с исполь зованием метаболических и генетических ресурсов клеток. Поэтому патогенез вирусных инфекций, в первую очередь, следует рассматривать на молекулярном и клеточном уровнях (В.И. Покровский, О.И. Киселев, 2002). Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. Поэтому характер развития внутритканевых процес сов при вирусных инфекциях, с одной стороны, определяется, как правило, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты от вирусной инфекции. Последние не редко носят деструктивный характер и усугубляют течение забо левания и его последствия. Поэтому понимание патогенеза вирусных инфекций представляется исключительно важным для создания рациональных схем лечения, основанных на гармоничном сочетании симптоматического лечения и противовирусной химиотерапии.
В клинической практике важное значение имеют процессы, вызванные вирусной инфекцией, виремией – (степень «вирусной нагрузки» прямо коррелирует с явлениями общего токсикоза, тяжестью состояния пациента, лихорадкой; тесным взаимодействием с иммунной системой), реакция которой в значительной степени определяет характер течения инфекционного процесса и его исход; присоединением бактериальной инфекции и развитием осложнений. Смешанные инфекции представляют собой опасный путь развития процесса.
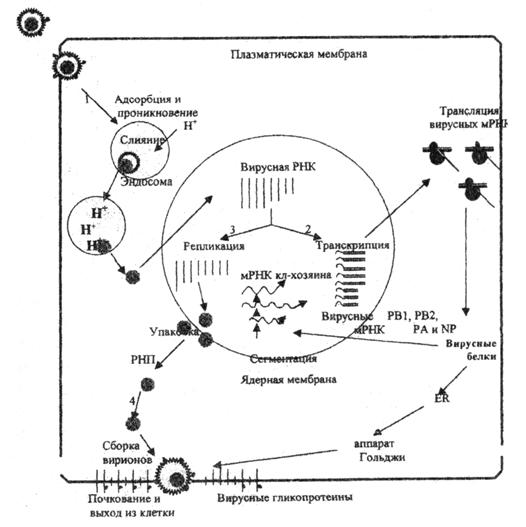
Стадии репликативного цикла вируса гриппа представлены на рис. 1. Такой же репликативный цикл свойствен большинству РНК- и ДНК-содержащих вирусов, кроме тех, кото рые обладают особыми механизмами хронизации процесса, латенции и способностью к интеграции в клеточный геном (например, ВИЧ, гепатит С, вирус папилломы и.т.). Ключевыми стадиями репликативного цикла вируса являются проникновение в клетки, декапсидация, активация процессов транскрипции и трансляции, собственно репликация вирусного генома и созревание зрелых вирусных частиц с выходом нового потомства инфекционного вируса.
Для проникновения вируса в клетку, необходимо: высокое сродство к вирусоспецифическому рецептору; множественность рецепторов; эффективность слияния вируса с клетками при инфицировании; способность к образованию синцития, к образованию гигантских синпластов, состоящих из множества слившихся клеток, в которых вирусный нуклеопротеид без эндоцитоза беспрепятственно переходит от одной зараженной клетки к множеству других через цитоплазму.
Такими свойствами из респираторных вирусов обладает респираторно-синцитиальный вирус, а среди ретровирусов – вирус иммунодефицита человека.
Стадии жизненного цикла вируса гриппа и соответствующие ингибиторы репродукции в известной степени могут быть экстраполированы на многие другие вирусы, за исключением тех, жизненный цикл которых включает интеграцию в клеточный геном. В процессе репликации вирусов обычно происходит селективная блокада трансляции клеточных мРНК и активация экспресси клеточных генов, кодирующих провоспапительные лимфокины. Многократные раунды репликации вирусного генома приводят к истощению энер гетических ресурсов клеток и пула предшественников азотистых оснований. Повышенное содержание провоспалительных лимфокинов приводит к развитию воспалительной реакции и локально му генерированию свободных радикалов, оказывающих, в свою очередь, повреждающее действие на клетки и ткани через перекисное окисление липидов клеточных мембран, инактивацию жизненно важных ферментов. Поэтому одним из важнейших факторов патогенности вирусов является их репликативный потенциал: чем активнее происходит репликация, тем сильнее цитопатическое действие вирусов на клетки и пораженную ткань (орган).
Значительный вклад в цитопатическое действие вирусов вносит репродукция вирусов в митохондриях, что сопровождается нарушением функций этих органоидов, падением продукции АТФ и индукцией опосредованного митохондриями пути апоптоза.
Впервые возможность репродукции вирусов в митохондриях была доказана выдающимся отечественным вирусологом В.М. Ждановым. Узкий тропизм вирусов, в известной степени, спасителен для организма, так как инфекционный процесс ограничен одним органом.
Это обстоятельство позволяет, проводит рациональную симптоматическую терапию, направленную на защиту данной ткани или органа и ориентировать противовирусные средства в данный орган, например, легкие.
Возбудители гриппа относятся к семейству ортомиксовирусов (Orthomyxo-viridae) и являются пневмотропными вирусами. Схематическое строение вируса гриппа представлено на рис. 2.1. Геном вируса складывается из 8-ми фрагментов однонитчатой РНК, которые кодируют
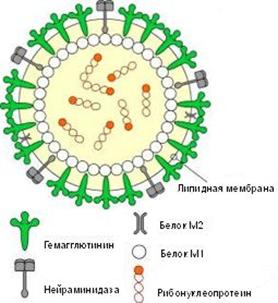
10 вирусных белков. Фрагменты РНК имеют общую белковую оболочку, соединяющую их, образуя антигенно-стабильный рибонуклеопротеид (S-антиген), который определяет принадлежность вируса к серотипу А, В или С. Снаружи вирус покрыт двойным липидным слоем с внутренней стороны которого находится слой мембранного белка.
Рис. 1. Репликативный цикл вируса гриппа (В.И.Покровский, О.И.Киселев, 2002)
Представлены 4 основные фазы репликативного цикла вируса гриппа: 1 – адсорбция и проникновение вируса в клетку хозяина; 2 – транскрипция вирусной РНК и трансляция вирусных белков; 3 – репликация вирусной РНК и 4 – самосборка вирионов и последующий выход их из клетки.
Над оболочкой вируса поднимаются два типа «шипов» (гликопротеины) – гемаглютинин (Н) и нейраминидаза (N) – поверхностные антигены вируса гриппа. Гемаглютинин – полипептид, назван так благодаря способности гемолизировать эритроциты. Он имеет высокую изменчивость и иммуногенность, обеспечивая прикрепление вируса к клетке. Нейраминидаза – этогликопротеидный комплекс, который определяет ферментативную активность, отвечает за способность вирусной частицы проникать в клетку хозяина и выходить из нее после размножения.
Рис. 2. Схематическое строение вируса гриппа
Гемаглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемаглютинина, а нейраминидаза обладает выраженным иммунодепресивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемаглютинины 1, 2, 3 типов и нейраминидазы 1, 2 типов содержат вирусы, которые поражают человека. Другие антигены характерные для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.).
Вирусы гриппа А. Эти возбудители более вирулентны и контагиозны, чем вирусы гриппа В и С. Это обусловлено тем, что вирус А содержит 2 типа нейраминидазы (N1, N2) и 4 –гемаглютинина (H0, H1, H2, H3); вирус В – 1 и 1 соответственно, поэтому он имеет лишь антигенные варианты внутри одного серотипа; вирус С содержит только гемаглютинин и не содержитнейраминидазу, но он имеет рецептор, который разрушает энзим. Вирусу С не свойственная изменчивость.
Одновременно циркулируют и имеют эпидемическое распространение 2 подтипа вируса гриппа А H3N2 и H1N1. На сегодняшний день во всем мире доминирует вариант А/Сидней/05/97, А/Берн/07/95 и А/Пекин/262/95. Характерной чертой современных вирусов гриппа А (H3N2) является изменение ряда их биологических свойств: тяжело размножаются в куриных эмбрионах, не агглютинируют эритроциты кур, взаимодействуют только с эритроцитами человека или морской свинки, имеют низкую иммуногенную активность.
Вирусы гриппа В выделяются только от людей. По вирулентности и эпидемиологической значимости они уступают вирусам гриппа А. По антигенным свойствам гемаглютинин инейраминидазу вируса В можно разделить на 5 подтипов. Их изменчивость носит более постепенный и медленный характер, что объясняет эпидемиологические особенности вируса гриппа В (эпидемии возникали 1 раз в 3-4 года до 1988 г.). В мире сейчас циркулируют 2 варианта вируса гриппа В: В/Пекин/184/93 (Европа, Америка, Африка, Австралия) и В/Виктория/2/87 (Юго-Восточная Азия). Характерной чертой современных вирусов гриппа А и В является их высокая чувствительность к ингибиторам гемаглютинирующей и инфекционной активности, которые содержатся в сыворотке крови нормальных животных.
Для вирусов гриппа С характерна значительно большая стабильность антигенных и биологических свойств. По ряду биологических характеристик эти возбудители отличаются от других представителей семейства ортомиксовирусов. Им присуща низкая репродуктивная активность в разных клеточных системах и наличие других, чем у вирусов гриппа А и В, рецепторов на поверхности эритроцитов. Рецептор-деструктирующая активность связана не с нейраминидазой, как у вирусов гриппа А и В, а с ферментом нейраминат-0-ацетилестеразою.
Сложность этиологии усиливают факты выделения от людей вирусов, которые не свойственные человеку. Гены вируса гриппа (H5N1), выделенные в 1997 году от человека в Гонконге, оказались подобными генам птичьего вируса, который преодолел межвидовой барьер. Оказалось, что человеческие и птичьи вирусы гриппа были реасортантами (рекомбинантные штаммы), которые получили внутренние гены РВ1 и РВ2 от перепелиного вируса гриппа А (H9N2) – штаммы А/перепел/Гонконг/61/97.
Вирус гриппа не растет на обычных питательных средах. Его можно выделить из материала, который получен от больного в первые дни болезни (смывы из носоглотки, мокроты), путем заражения культур или клеток куриных эмбрионов.
Традиционно считалось, что человеческий организм освобождается от возбудителя в ближайшие дни после выздоровления. Однако постепенно накапливались косвенные свидетельства, которые опровергают эту точку зрения. И в 1985 г. были получены прямые доказательства формирования длительной персистенции вируса гриппа. У одного человека удалось многократно выделять вирус гриппа в течение 9-ти месяцев и дольше. Возможность пожизненной персистенции вируса в организме человека продолжает изучаться.
1. Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. – СПб. – 2003.
2. Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. – Санкт-Петербург. – 2003.
3. Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. – Санкт-Петербург. – 2007. – 254 с.
4. Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. – М., 2006. –С. 226-247.
5. Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. – М., 2005. – С.159-175.
6. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). – М., 2005. – С. 287-292.
7. Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. – М., 2002.
8. Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. – М., – 2004. – С.5-9.
9. Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
10. Романцов М.Г., Ершов Ф.И. Часто болеющие дети: Современная фармакотерапия. – М., 2006. – 192 с.
11. Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. – СПб. – 2004. – С. 82-95.
12. Лекарственные средства в фармакотерапии патологии клетки / под редакцией Т.Г. Кожока.-М., 2007.
В чем может проявляться цитопатическое действие вирусов
У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Пик продукции цитокинов после стимуляции макрофагов наблюдается через 1-2,6,18-48 ч, а пик продукции интерферон-гамма наступает через 20 ч после первого выхода цитокина из клетки. Поскольку интерферон-гамма ингибирует миелопоэз, то нормализация числа нейтрофилов после элиминации инфекта связана с системой регуляции нейтропоэза. Через 6 ч после стимуляции интерферон-альфа для выполнения своих функций NK-rклетки (активность которых регулируется ИЛ-1, 4, 2) продуцируют гамма-интерферон, в результате чего происходит лизис инфицированных клеток.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
Исследование цитопатического действия вируса паротита на культуру клеток меланомы человека
Работа призёра открытой городской научно-практической конференции «Старт в медицину» в секции «Микробиология и эпидемиология»
Актуальность
Один из самых опасных видов рака – меланома, которая поражает не только кожу, но и другие органы и ткани, поэтому важно использовать современные и безопасные методы лечения рака. Одним из таких методов является онколитическая виротерапия. Онколитические вирусы обладают способностью непосредственно лизировать неопластические клетки.
Цель
Оценить цитопатическое действие живого вакцинного штамма вируса паротита «Ленинград-3» при заражении клеток метастатической меланомы.
Задачи
1. Оценить пермиссивность клеток меланомы человека к вакцинному штамму вируса паротита.
2. Оценить чувствительность клеток меланомы человека к вирус-опосредованному лизису.
3. Определить эффективность цитопатического действия вируса паротита на клетки меланомы человека.
4. Проанализировать жизнеспособность заражённых клеток меланомы человека.
Оснащение и оборудование, использованное в работе
• Вакцинный штамм вируса паротита «Ленинград-3» (L-3)
• Клеточная культура меланомы человека Mel Il
Описание
Исследования проводились на базе ФГБНУ НИИВС им. И. И. Мечникова, из банка которого были взяты клеточные линии меланомы, вируссодержащий материал и клетки фибробластов. Клеточные линии меланомы заражали аттенуированным штаммом L-3 вируса паротита с различной множественностью инфекции – 0,1; 0,5 и 1 инфекционные единицы (инф. ед.) на клетку.
Затем был проведён МТТ-тест для оценки выживаемости клеток через 24, 48, 72 и 96 часов после заражения. В лунки 96-луночного планшета вносили по 150 мкл ростовой среды. Клетки заражали вируссодержащим супернатантом с различными значениями MOI и инкубировали при +37 °C в атмосфере с содержанием 5% CO2 в течение 3–120 ч. Через каждые 24 ч в лунки добавляли 25 мкл раствора 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразола бромида (МТТ) и инкубировали 3 ч при +37 °C в атмосфере с содержанием 5% CO2. Далее среду удаляли и добавляли 60 мкл диметилсульфоксид (ДМСО) на лунку для растворения образовавшихся кристаллов формазана. Анализ оптической плотности проводили на микропланшетном детекторе.
Результаты
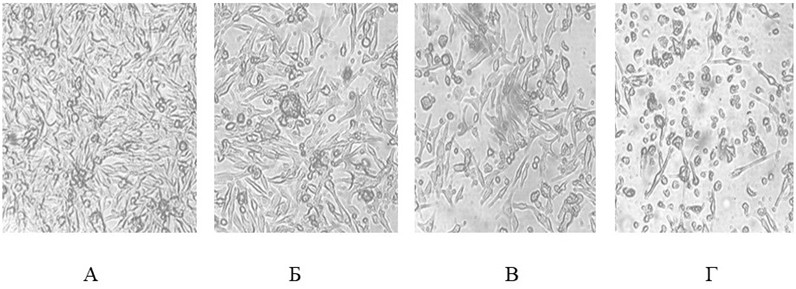
1. Цитопатическое действие вируса паротита L-3 на клетки наблюдали уже через 48–72 ч после заражения: снижение плотности монослоя и грануляция цитоплазмы клеток, постепенно сходящих с поверхности.
Клеточная линия Mel Il, заражённая аттенуированным штаммом L-3 вируса паротита с различной множественностью инфекции через 72 часа после заражения
(А – КК (незаражённая), В – 0,1 инф. ед. на клетку, Г – 0,5 инф. ед. на клетку, Д – 1 инф. ед. на клетку)
2. При дозе MOI 1.0 содержание жизнеспособных клеток было ниже, чем в случае MOI 0.1 на одном и том же временном интервале. Уже через 48 часов после заражения наблюдалась практически полная гибель клеток Mel Ibr, заражённых вирусом паротита L-3 при MOI 1.0, и оставалось около 30 % жизнеспособных клеток Mel Il, заражённых дозами вируса при MOI 1.0 или 0.1. Для клеток Mel Mtp и Mel Z на этом временном интервале цитотоксический эффект вируса паротита L-3 был менее выражен. Через 96 часов после заражения доля жизнеспособных клеток составляла 6,7 % и 12,2 % для Mel Ibr, 12,3 % и 24,4 % для Mel Il, 17,5 % и 32,3 % для Mel Mtp, 18,1 % и 56,8 % для Mel Z при MOI 1.0 и 0.1 соответственно.
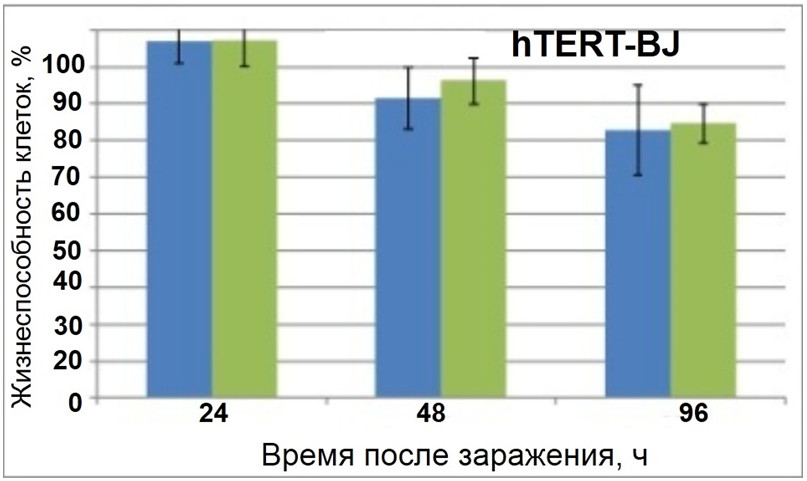
Жизнеспособность клеток фибробластов hTERT-BJ, инкубированных вирусом паротита L-3, c MOI 0.1 (зелёные столбцы) или 1.0 (синие столбцы)
Выводы
1. Вакцинный штамм вируса паротита L-3 эффективно реплицируется в четырех исследованных линиях клеток меланомы человека, но не в нормальных клетках фибробластов человека.
2. В результате вирусной инфекции наблюдается гибель злокачественных клеток.
3. Инфекция неопластических клеток онколитическими вирусами индуцирует антиопухолевый иммунитет.
4. Важно отметить, что клетки нормальных фибробластов были резистентны к заражению вирусом паротита в течение всего периода культивирования, что может быть связано с различной представленностью рецепторов для вируса паротита на поверхности клеток меланомы и нормальных фибробластов.
Перспективы использования результатов работы
Меланома устойчива к химиотерапии, лучевой и гормональной терапии, современным иммунотерапевтическим методам, поэтому очень важны новые подходы к терапии меланомы. Онколитические вирусы, включая живой аттенуированный вакцинный штамм вируса паротита, в последнее время все чаще рассматриваются в качестве перспективных терапевтических агентов.
Сотрудничество с вузом и учреждением при создании работы
1. ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет).
2. ФГБНУ НИИВС им. И. И. Мечникова.
Мнение автора
«Мне очень понравилось проводить научную работу на одну из актуальных тем в современном мире. Спасибо проекту «Медицинский класс в московской школе» и конференции «Старт в медицину» за то, что позволяете окунуться в научную деятельность, поближе познакомиться с интересующим направлением и получить полезный опыт!»