в чем измеряют атомы
Основы строения атома. Просто о сложном
Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Естественно, уважаемый читатель понимает, что в данной статье мы стараемся изложить все на максимально простом и интересном уровне, поэтому не «грузим» научными терминами. Тем, кто хочет изучить вопрос на более профессиональном уровне, советуем читать специализированную литературу. Тем не менее, сведения данной статьи могут сослужить хорошую службу в учебе и просто сделать Вас более эрудированными.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
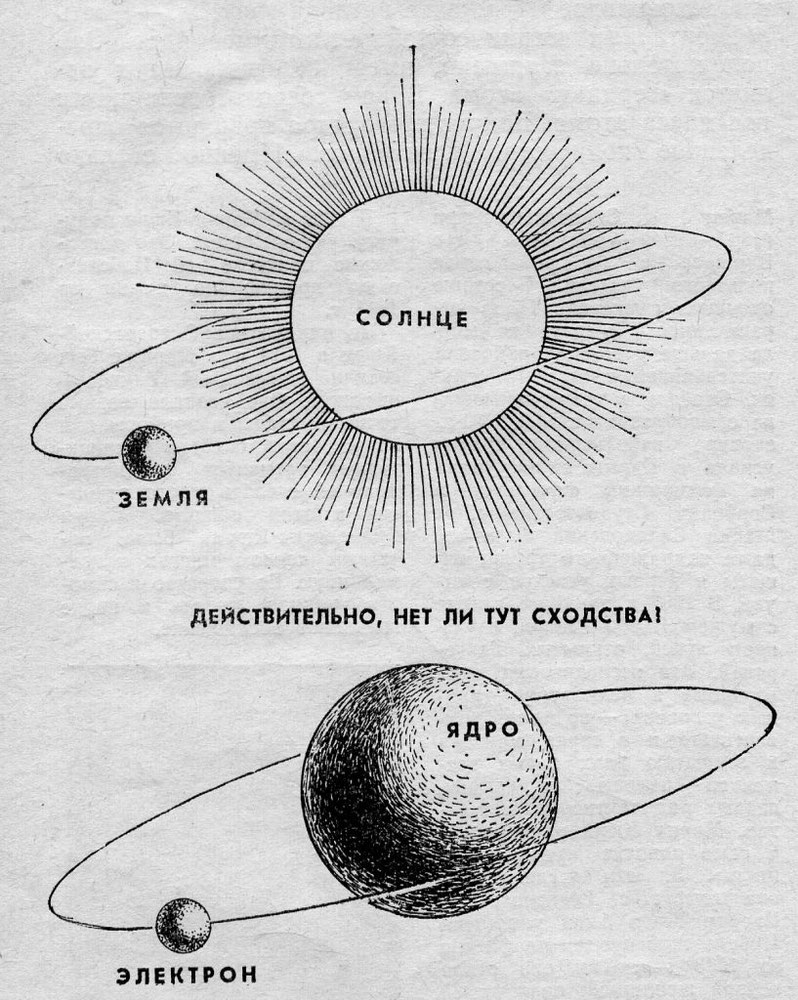
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
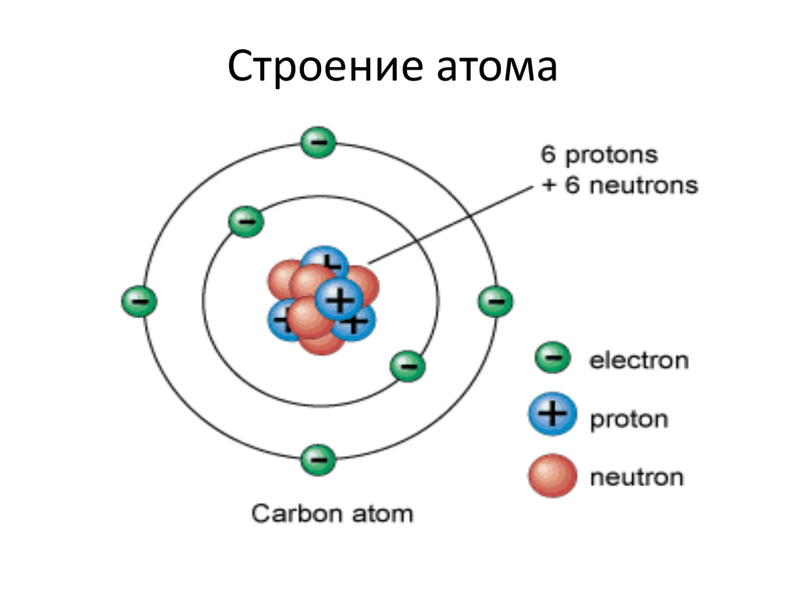
Ниже приведем элементарную схему строения атома углерода.
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие «моль». 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?

Откуда взялись атомы?
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.

Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Именно благодаря сильному взаимодействию, которое проявляется в масштабах атомных ядер и отвечает за притяжение между нуклонами, атом и является таким «крепким орешком».
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.

Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Атомы: строительные блоки молекул
Если молекулы – основные структуры, задействованные в химии – это слова, из которых состоят все окружающие нас материалы, тогда атомы – это буквы, строительные блоки молекул. Слова бывают разной длины, и типичная молекула тоже может содержать несколько атомов, или несколько сотен, или даже сто тысяч атомов. Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H2O содержит два атома водорода и один кислорода. Молекула столового сахара C12H22O11 содержит 12 атомов углерода, 11 кислорода и 22 водорода, организованных определённым образом.
Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).
На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
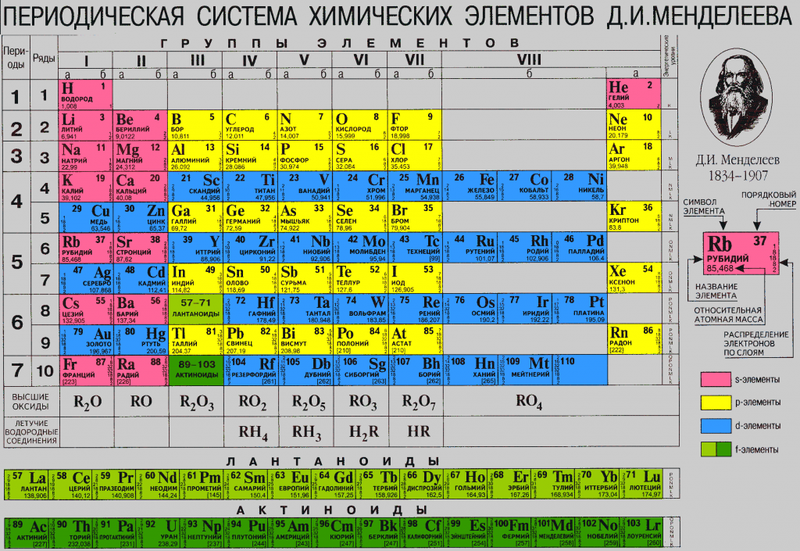
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
Рисованный атом
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра. Ядро – это скопление протонов (красные) и нейтронов (белые).
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их заряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Более реалистичный атом
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.

Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны. Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать. Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Атом и его химия
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?
В чем измеряют атомы
А́том (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического элемента, являющаяся носителем его свойств. [1] Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
Содержание
История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является неделимым.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Модели атомов
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1 ⁄12 от массы атома стабильного изотопа углерода 12 C.
Строение атома
Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11·10 −31 кг, отрицательным зарядом и размером, слишком малым для измерения современными методами. [4] Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726·10 −27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929·10 −27 кг). [5]
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5·10 −15 м, хотя размеры этих частиц определены плохо. [6]
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный + 2 ⁄3 или − 1 ⁄3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами. [7] [8]
Электроны в атоме
При описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
Свойства атома
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий). [9] Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов. [10] Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны. [11] [12]
Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1 ⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10 −24 г. [13] Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м. [14] Масса атома приблизительно равна произведению массового числа на атомную единицу массы [15] Самый тяжёлый стабильный изотоп — свинец-208 [11] с массой 207,9766521 а. е. м. [16]
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022·10 23 ). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г. [13]
Размер
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь (Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин. [17] В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо. [18] Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм). [19] Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода. [20] Одна капля воды содержит 2 секстиллиона (2·10 21 ) атомов кислорода, и в два раза больше атомов водорода. [21] Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода. [22] Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока. [23]
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля (field-emission electron microscope, FEEM). Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра. [24]
Радиоактивный распад
У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм [25] ).
Существуют три основные формы радиоактивного распада [26] [27] :
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа. [25]
Магнитный момент
Элементарные частицы обладают внутренним квантовомеханическим свойством известным как спин. Оно аналогично угловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной (

Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако, наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчиняться правилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — состояние со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов. [29]
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствии магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля. [29] [30]
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако, для некоторых элементов (таких как ксенон-129) возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами —состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии. [31] [32]
Энергетические уровни
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными. [33]
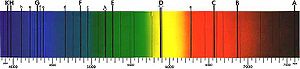
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра. [34] Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов. [35]
Когда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём. [36]
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона. [37]
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называется эффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена — Бака). [38] Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка. [39]
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот. [40]
Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки. [41]
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы. Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами. [42] [43]