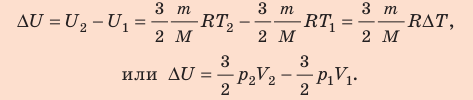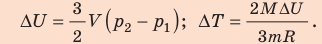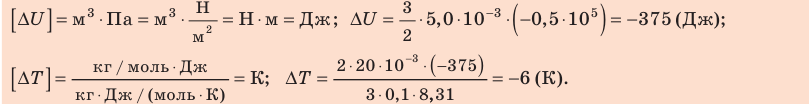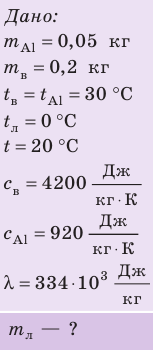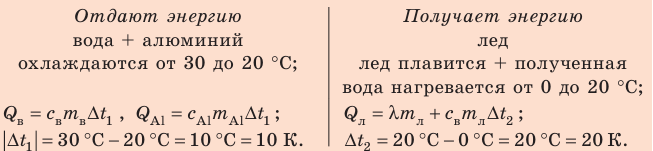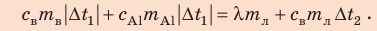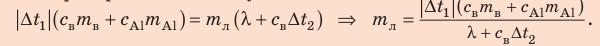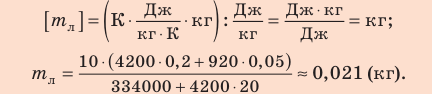в чем измеряется внутр энергия
Термодинамика. Внутренняя энергия.
Внутреннюю энергию тела составляют кинетическая энергия всех его молекул и потенциальная энергия их взаимодействия.
Внутренняя энергия входит в баланс энергетических превращений в природе. После открытия внутренней энергии был сформулирован закон сохранения и превращения энергии. Рассмотрим взаимное превращение механической и внутренней энергий. Пусть на свинцовой плите лежит свинцовый шар. Поднимем его вверх и отпустим. Когда мы подняли шар, то сообщили ему потенциальную энергию. При падении шара она уменьшается, т. к. шар опускается все ниже и ниже. Но с увеличением скорости постепенно увеличивается кинетическая энергия шара. Происходит превращение потенциальной энергии шара в кинетическую. Но вот шар ударился о свинцовую плиту и остановился. И кинетическая, и потенциальная энергии его относительно плиты стали равными нулю. Рассматривая шар и плиту после удара, мы увидим, что их состояние изменилось: шар немного сплющился, и на плите образовалась небольшая вмятина; измерив же их температуру, мы обнаружим, что они нагрелись.
Нагрев означает увеличение средней кинетической энергии молекул тела. При деформации изменяется взаимное расположение частиц тела, поэтому изменяется и их потенциальная энергия.
Таким образом, можно утверждать, что в результате удара шара о плиту происходит превращение механической энергии, которой обладал в начале опыта шар, во внутреннюю энергию тела.
Нетрудно наблюдать и обратный переход внутренней энергии в механическую.
Например, если взять толстостенный стеклянный сосуд и накачать в него воздух через отверстие в пробке, то спустя какое-то время пробка из сосуда вылетит. В этот момент в сосуде образуется туман. Появление тумана означает, что воздух в сосуде стал холоднее и, следовательно, его внутренняя энергия уменьшилась. Объясняется это тем, что находившийся в сосуде сжатый воздух, выталкивая пробку (т. е. расширяясь), совершил работу за счет уменьшения своей внутренней энергии. Кинетическая энергия пробки увеличилась за счет внутренней энергии сжатого воздуха.
Таким образом, одним из способов изменения внутренней энергии тела является работа, совершаемая молекулами тела (или другими телами) над данным телом. Способом изменения внутренней энергии без совершения работы является теплопередача.
Поскольку молекулы идеального газа не взаимодействуют друг с другом, их потенциальная энергия считается равной нулю. Внутренняя энергия идеального газа определяется только кинетической энергией беспорядочного поступательного движения его молекул. Для ее вычисления нужно умножить среднюю кинетическую энергию одного атома 


Внутренняя энергия идеального одноатомного газа прямо пропорциональна его температуре. Если воспользоваться уравнением Клапейрона-Менделеева, то выражение для внутренней энергии идеального газа можно представить в виде:

Следует отметить, что, согласно выражению для средней кинетической энергии одного атома 

Число степеней свободы — это число возможных независимых направлений движения молекулы.
Газ, каждая молекула которого состоит из двух атомов, называется двухатомным. Каждый атом может двигаться по трем направлениям, поэтому общее число возможных направлений движения — 6. За счет связи между молекулами число степеней свободы уменьшается на одну, поэтому число степеней свободы для двухатомной молекулы равно пяти.
Средняя кинетическая энергия двухатомной молекулы равна 

Формулы для внутренней энергии идеального газа можно обобщить:

где i — число степеней свободы молекул газа (i = 3 для одноатомного и i = 5 для двухатомного газа).
Для идеальных газов внутренняя энергия зависит только от одного макроскопического параметра — температуры и не зависит от объема, т. к. потенциальная энергия равна нулю (объем определяет среднее расстояние между молекулами).
Для реальных газов потенциальная энергия не равна нулю. Поэтому внутренняя энергия в термодинамике в общем случае однозначно определяется параметрами, характеризующими состояние этих тел: объемом (V) и температурой (T).
Содержание:
Внутренняя энергия:
Вы знаете, что движущееся тело обладает кинетической энергией. А если оно еще и взаимодействует с другим телом, то обладает потенциальной энергией. Оба вида энергии представляют собой механическую энергию. Они взаимно превращаемы: кинетическая энергия может переходить в потенциальную и наоборот. Кроме того, вы знаете, что любое тело имеет дискретную структуру, т. е. состоит из частиц (атомов, молекул). Частицы находятся в непрерывном хаотическом движении. А частицы жидкости и твердого тела еще и взаимодействуют между собой. Следовательно, частицы обладают кинетической, а частицы жидкости и твердых тел — еще и потенциальной энергией. Сумма кинетической и потенциальной энергий всех частиц тела называется внутренней энергией. Внутренняя энергия измеряется в джоулях. Чем отличается внутренняя энергия от механической? В чем ее особенности? Может ли механическая энергия переходить во внутреннюю?
Для ответа на эти вопросы рассмотрим пример. Шайба, двигавшаяся горизонтально по льду (рис. 1), остановилась. Как изменилась ее механическая энергия относительно льда?
Кинетическая энергия шайбы уменьшилась до нуля. Положение шайбы над уровнем льда не изменилось, шайба не деформировалась. Значит, изменение потенциальной энергии равно нулю. Означает ли это, что се механическая (кинетическая) энергия исчезла бесследно? Нет. Механическая энергия шайбы перешла во внутреннюю энергию шайбы и льда.
А может ли внутренняя энергия тела, как механическая, быть равной нулю? Движение частиц, из которых состоит тело, не прекращается даже при самых низких температурах. Значит, тело всегда (подчеркиваем, всегда) обладает некоторым запасом внутренней энергии. Его можно либо увеличить, либо уменьшить — и только!
Велико ли значение внутренней энергии тела? Энергия одной частицы, например кинетическая, в силу незначительности ее массы чрезвычайно мала. Расчеты для средней энергии поступательного движения молекулы кислорода показывают, что ее значение при комнатной температуре
Главные выводы:
Способы изменения внутренней энергии
Чтобы изменить механическую энергию тела, надо изменить скорость его движения, взаимодействие с другими телами или взаимодействие частей тела. Вы уже знаете, что это достигается совершением работы.
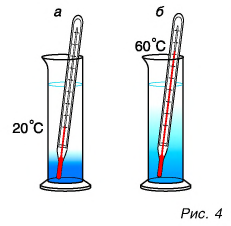
Как можно изменить (увеличить или уменьшить) внутреннюю энергию тела? Рассуждаем логически. Внутренняя энергия определяется как сумма кинетической и потенциальной энергий частиц. Значит, нужно изменить либо скорость движения частиц, либо их взаимодействие (изменить расстояния между ними). Очевидно, можно изменить и скорость, и расстояния между частицами одновременно. Изменить скорость частиц тела можно, увеличив или уменьшив его температуру. Действительно, наблюдения за диффузией показывают, что быстрота ее протекания увеличивается при нагревании (рис. 4, а, б).
Значит, увеличивается средняя скорость движения частиц, а следовательно, их средняя кинетическая энергия. Отсюда следует важный вывод: температура является мерой средней кинетической энергии частиц.
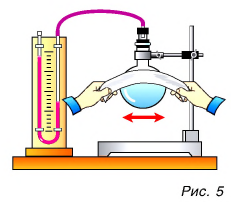
Как изменить кинетическую энергию частиц тела? Существуют два способа. Рассмотрим их на опытах. Будем натирать колбу с воздухом полоской сукна (рис. 5).
Через некоторое время уровень жидкости в правом колене манометра (см. рис. 5) опустится, т. е. давление воздуха в колбе увеличится. Это говорит о нагревании воздуха. Значит, увеличилась скорость движения и кинетическая энергия его молекул, а следовательно, и внутренняя энергия. Но за счет чего? Очевидно, за счет совершения механической работы при трении сукна о колбу. Нагрелась колба, а от нее — газ.
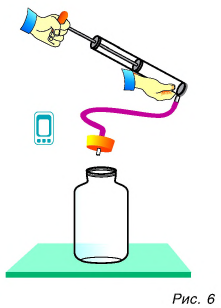
Проведем еще один опыт. В толстостенный стеклянный сосуд нальем немного воды (чайную ложку для увлажнения воздуха в нем. Насосом (рис. 6) будем накачивать в сосуд воздух. Через несколько качков пробка вылетит, а в сосуде образуется туман. Из наблюдений за окружающей средой мы знаем, что туман появляется тогда, когда после теплого дня наступает холодная ночь. Образование тумана в сосуде свидетельствует об охлаждении воздуха, т. е. об уменьшении его внутренней энергии. Но почему уменьшилась энергия? Потому что за ее счет совершена работа по выталкиванию пробки из сосуда.
Сравним результаты опытов. В обоих случаях изменилась внутренняя энергия газа, но в первом опыте она увеличилась, так как работа совершалась внешней силой (над колбой с газом), а во втором — уменьшилась, ибо работу совершала сила давления самого газа.
А можно ли, совершая работу, изменить потенциальную энергию взаимодействия молекул?
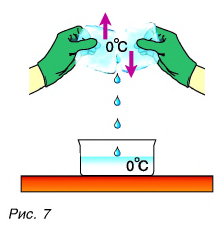
Опять обратимся к опыту. Два куска льда при О °C будем тереть друг о друга (рис. 7).
Лед превращается в воду, при этом температура воды и льда остается постоянной, равной О °C (см. рис. 7). На что тратится механическая работа силы трения?
Конечно же, на изменение внутренней энергии!
Но кинетическая энергия молекул не изменилась, так как температура не изменилась. Лед превратился в воду. При этом изменились силы взаимодействия молекул 
Совершение механической работы — один из способов изменения внутренней энергии тела.
А есть ли возможность изменить внутреннюю энергию тела, не совершая механическую работу?
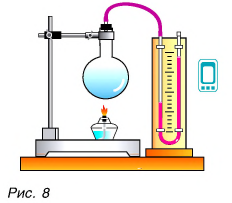
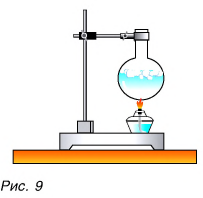
Да, есть. Нагреть воздух в колбе (рис. 8), расплавить лед (рис. 9) можно с помощью спиртовки, передав и воздуху, и льду теплоту. В обоих случаях внутренняя энергия увеличивается.
При охлаждении тел (если колбы со льдом и воздухом поместить в морозильник) их внутренняя энергия уменьшается. Теплота от тел передается окружающей среде.
Процесс изменения внутренней энергии тела, происходящий без совершения работы, называется теплопередачей (теплообменом).
Таким образом, совершение механической работы и теплопередача — два способа изменения внутренней энергии тела.
Величину, равную изменению внутренней энергии при теплопередаче, называют количеством теплоты (обозначается Q). Единицей количества теплоты, как работы и энергии, в СИ является 1 джоуль.
Для любознательных:
Физики XVIII в. и первой половины XIX в. рассматривали теплоту не как изменение энергии, а как особое вещество — теплород — жидкость (флюид), которая может перетекать от одного тела к другому. Если тело нагревалось, то считалось, что в него вливался теплород, а если охлаждалось — то выливался. При нагревании тела расширяются. Это объяснялось тем, что теплород имеет объем. Но если теплород — вещество, то тела при нагревании должны увеличивать свою массу. Однако взвешивания показывали, что масса тела не менялась. Поэтому теплород считали невесомым. Теорию теплорода поддерживали многие ученые, в том числе и такой гениальный ученый, как Г. Галилей. Позже Дж. Джоуль на основании проведенных им опытов пришел к выводу, что теплород не существует и что теплота есть мера изменения кинетической и потенциальной энергий движущихся частиц тела.
В дальнейшем выражение «сообщить телу количество теплоты» мы будем понимать как «изменить внутреннюю энергию тела без совершения механической работы, т. е. путем теплообмена». А выражение «нагреть тело» будем понимать как «повысить его температуру» любым из двух способов.
Главные выводы:
Основы термодинамики
МКТ стала общепризнанной на рубеже XIX и XX веков. Задолго до ее создания исследованием тепловых процессов занималась термодинамика — раздел физики, изучающий превращение внутренней (тепловой) энергии в другие виды энергии и наоборот, а также количественные соотношения при таких превращениях.
Внутренняя энергия и ее особенности
Внутренняя энергия макроскопического тела определяется характером движения и взаимодействия всех микрочастиц, из которых состоит тело (система тел). Таким образом, к внутренней энергии следует отнести:
Однако для описания тепловых процессов важно не столько значение внутренней энергии, как ее изменение. При тепловых процессах химическая, внутриатомная и внутриядерная энергии практически не изменяются. Именно поэтому внутренняя энергия в термодинамике определяется как сумма кинетических энергий хаотического (теплового) движения частиц вещества (атомов, молекул, ионов), из которых состоит тело, и потенциальных энергий их взаимодействия.
Внутреннюю энергию обозначают символом U.
Единица внутренней энергии в СИ — джоуль: [U]=1 Дж (J).
Особенности внутренней энергии идеального газа
Какие существуют виды теплопередачи
Теплопередача (теплообмен) — процесс изменения внутренней энергии тела или частей тела без совершения работы. Процесс теплопередачи возможен только при наличии разности температур. Самопроизвольно тепло всегда передается от более нагретого тела к менее нагретому. Чем больше разность температур, тем быстрее — при прочих равных условиях — протекает процесс передачи тепла.
| Виды теплопередачи | ||
|---|---|---|
| Теплопроводность | Конвекция | Излучение |
| Вид теплопередачи, при котором тепло переносится потоками жидкости или газа. Теплые потоки жидкости или газа имеют меньшую плотность, поэтому под действием архимедовой силы поднимаются, а холодные потоки — опускаются. Благодаря конвекции происходит циркуляция воздуха в помещении, нагревается жидкость в стоящей на плите кастрюле, существуют ветры и морские течения и т. д. В твердых телах конвекция невозможна. | Вид теплопередачи, при котором энергия передается посредством электромагнитных волн. Излучение — универсальный вид теплопередачи: тела всегда излучают и поглощают инфракрасное (тепловое) излучение. Это единственный вид теплообмена, возможный в вакууме (энергия от Солнца передается только излучением). Лучше излучают и поглощают энергию тела с темной поверхностью. | |
Как определить количество теплоты
Количество теплоты Q — это физическая величина, равная энергии, которую тело получает (или отдает) в ходе теплопередачи.
Единица количества теплоты в СИ — джоуль: [П] =1 Дж (J).
| Расчет количества теплоты при фазовых переходах | |
|---|---|
| Кристаллическое состояние ↔ Жидкое состояние | Жидкое состояние ↔ Газообразное состояние |
| Напомним: и при плавлении, и при кипении температура вещества не изменяется. | |
Пример решения задачи №1
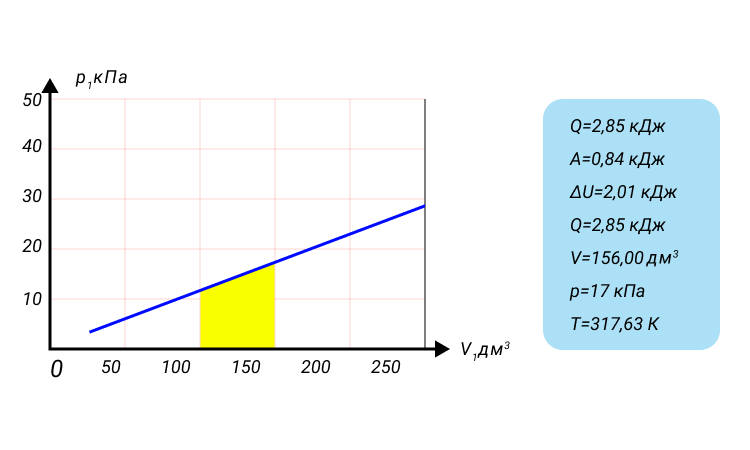
Неон массой 100 г находится в колбе объемом 5,0 л. В процессе изохорного охлаждения давление неона уменьшилось с 100 до 50 кПа. На сколько при этом изменились внутренняя энергия и температура неона?
Решение:
Неон — одноатомный газ; для таких газов изменение внутренней энергии равно:
Поскольку охлаждение изохорное, объем неона не изменяется: 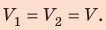
Проверим единицы, найдем значения искомых величин:
Анализ результатов. Знак «–» свидетельствует о том, что внутренняя энергия и температура неона уменьшились, — это соответствует изохорному охлаждению. Ответ: ∆U = –375 Дж; ∆T = –6 К.
Пример решения задачи №2
Внутренний алюминиевый сосуд калориметра имеет массу 50 г и содержит 200 г воды при температуре 30 °С. В сосуд бросили кубики льда при температуре 0 °С, в результате чего температура воды в калориметре снизилась до 20 °С. Определите массу льда. Удельные теплоемкости воды и алюминия: 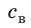
Анализ физической проблемы.
Калориметр имеет такое устройство, что теплообмен с окружающей средой практически отсутствует, поэтому для решения задачи воспользуемся уравнением теплового баланса. В теплообмене участвуют три тела: вода, внутренний сосуд калориметра, лед.
Решение:
Запишем уравнение теплового баланса:
После преобразований получим:
Проверим единицу, найдем значение искомой величины:
Ответ: 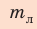
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Внутренняя энергия. Количество теплоты. Работа в термодинамике
Термодинамика опирается на общие закономерности тепловых процессов и свойств макроскопических систем. Выводы термодинамики эмпирические, то есть опираются на факты, проверенные опытным путем с использованием молекулярно-кинетической модели.
Для описания термодинамических процессов в системах, состоящих из большого числа частиц, используются величины, не применимые к отдельным молекулам и атомам: температура, давление, концентрация, объем, энтропия)
В термодинамике рассматриваются изолированные системы тел, находящиеся в термодинамическом равновесии. То есть в системах с прекращением всех наблюдаемых макроскопических процессов. Особую важность представляет свойство, которое получило название выравнивания температуры всех ее частей.
При внешнем воздействии на термодинамическую систему наблюдается переход в другое равновесное состояние. Он получил название термодинамического процесса. Когда время его протекания достаточно медленное, система приближена к состоянию равновесия. Процессы, состоящие из последовательности равновесных состояний, называют квазистатическими.
Внутренняя энергия. Формулы
Внутренняя энергия считается важнейшим понятием термодинамики. Макроскопические тела (системы) имеют внутреннюю энергию, состящую из энергии каждой молекулы. Исходя из молекулярно-кинетической теории, внутренняя энергия состоит из кинетической энергии атомов и молекул, а также потенциальной энергии их взаимодействия.
Например, внутренняя энергия идеального газа равняется сумме кинетических энергий частиц газа, которые находятся в непрерывном беспорядочном тепловом движении. После подтверждений большим количеством экспериментов, был получен закон Джоуля:
Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема.
Применение молекулярно-кинетической теории говорит о том, что выражение для определения внутренней энергии 1 м о л я одноатомного газа, с поступательными движениями молекул записывается как:
Зависимость от расстояния между молекулами у потенциальной энергии очевидна, поэтому внутренняя U и температура Т обусловлены изменениями V :
Определение внутренней энергии U производится с помощью наличия макроскопических параметров, характеризующих состояние тела. Изменение внутренней энергии происходит по причине действия на тело внешних сил, совершающих работу. Внутренняя энергия является функцией состояния системы.
Наличие знака перед работой говорит о работе газа в разных состояниях: положительная при расширении и отрицательная при сжатии. Переход из начального в конечное состояние работы газа может быть описан с помощью формулы:
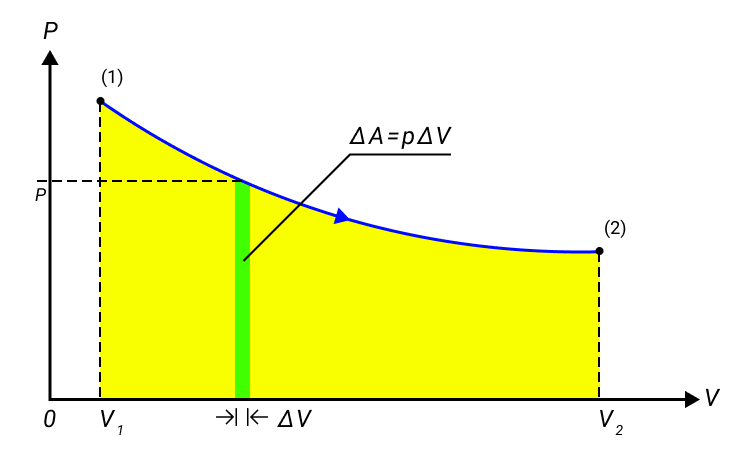
A = ∑ p i d V i или в пределе при ∆ V i → 0 :
Рисунок 1. Работа газа при расширении.
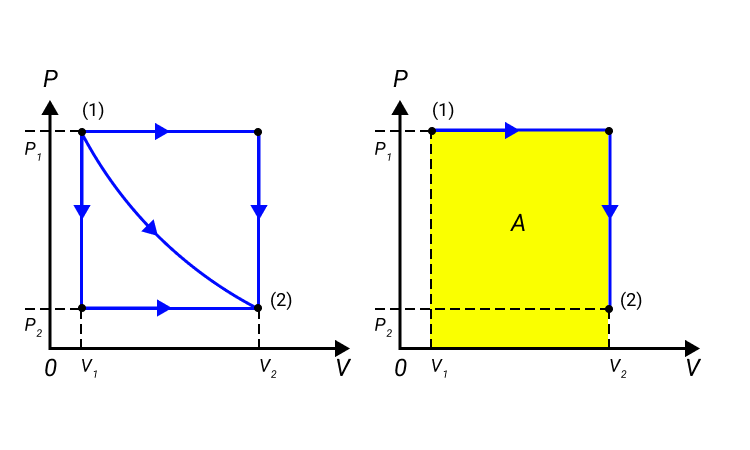
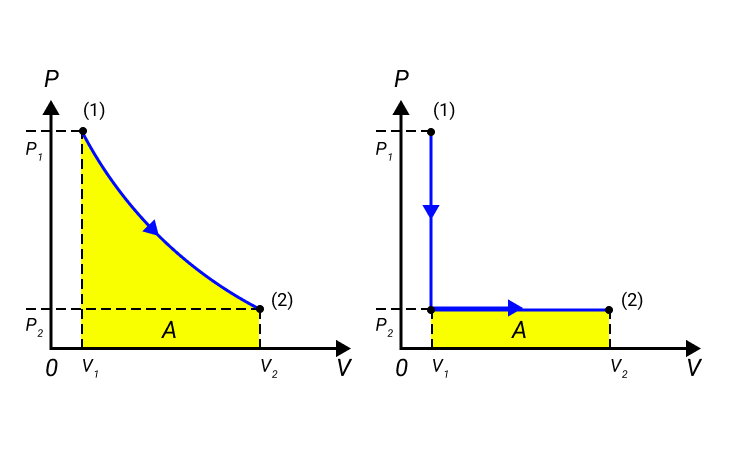
Обратимые и необратимые процессы
Рисунок 2. Три различных пути перехода из состояния ( 1 ) в состояние ( 2 ) . Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса.
Процессы из рисунка 2 возможно провести в обратном направлении. Тогда произойдет изменение знака А на противоположный.
Процессы, которые возможно проводить в обоих направлениях, получили название обратимых.
Жидкости и твердые тела могут незначительно изменять свой объем, поэтому при совершении работы разрешено им пренебречь. Но их внутренняя энергия подвергается изменениям посредствам совершения работы.
Процессы примеров не могут проводиться в противоположных направлениях, поэтому они получили название необратимых.
Рисунок 3. Упрощенная схема опыта Джоуля по определению механического эквивалента теплоты.
Изменение внутренней энергии возможно при наличии совершаемой работы и при теплообмене. Тепловой контакт тел позволяет увеличиваться энергии одного тела с уменьшением энергии другого. Иначе это называется тепловым потоком.
Количество теплоты
Рисунок 4. Модель работы газа.
Процесс передачи тепла тел возможен только при разности их температур.
Направление теплового потока всегда идет к холодному телу.