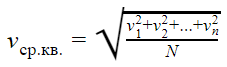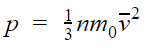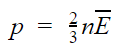в чем измеряется средняя квадратичная скорость молекул
Средняя квадратичная скорость молекул

Всего получено оценок: 64.
Всего получено оценок: 64.
Температура — это уровень внутренней энергии, заключённой в хаотическом движении молекул вещества. Скорость конкретной молекулы может иметь весьма широкий диапазон, однако скорость большинства молекул лежит в достаточно узких пределах, поэтому в молекулярной физике используется среднее значение этой скорости. Как же оно определяется?
Среднее значение физической величины
Большинство физических величин, характеризующих конкретный объект, имеет вполне определённое значение. Однако, если рассматривается несколько объектов, измеренная величина может быть различна для каждого объекта. И для моделирования поведения системы этих объектов требуется учитывать все значения.
С возрастанием числа объектов измерять параметры для каждого объекта становится всё сложнее. Но при этом зачастую оказывается, что все измеряемые значения лежат в некоторых пределах, причём систему можно достаточно точно моделировать, пренебрегая мелкими отличиями параметров каждого объекта.
Когда число объектов очень велико (например, число молекул в теле), этот метод является единственно возможным. Более того, значение, полученное для одного конкретного объекта, практически не играет роли.
В таких случаях используется специальное значение, при котором суммарная ошибка параметра для всех объектов будет наименьшей. Это значение называется средним значением физической величины. Среднее значение может рассчитываться несколькими способами.
Скорость молекул газа
Газ — это хороший пример системы, которая состоит из большого числа движущихся объектов (молекул), при этом скорость каждой отдельной молекулы не имеет значения, и единственный способ оценки молекулярных движений — использование средней скорости.
Простейший способ нахождения среднего значения — это суммирование всех значений и деление суммы на количество значений. Такое среднее называется средним арифметическим.
Для скорости молекул такое среднее не подходит. Скорости молекул имеют самые разные направления, и, какое бы направление мы не взяли, всегда окажется, что по этому направлению и против него движется одинаковое число молекул. Простая сумма скоростей будет равна нулю. Поэтому здесь используется среднее значение квадрата скорости молекул.
Особенности среднеквадратичного значения
Квадрат любого ненулевого числа положителен, поэтому значение в приведённой формуле также всегда будет положительным.
Ещё одно преимущество использования средней квадратичной скорости молекул состоит в том, что кинетическая энергия материальной точки находится по формуле:
Получается, что средняя квадратичная скорость молекул газа удобна для нахождения средней энергии молекулы, а она, в свою очередь, связана с макроскопическими параметрами — с температурой и давлением. Поэтому именно среднеквадратичная скорость используется в большинстве формул молекулярно-кинетической теории.

Что мы узнали?
Средняя квадратичная скорость молекул газа — удобный показатель, широко использующийся в молекулярно-кинетической теории для определения макроскопических параметров — температуры и давления.
Идеальный газ
Газ: агрегатное состояние
У веществ есть три агрегатных состояния — твердое, жидкое и газообразное.
Их характеристики — в таблице:
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Твердое
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около положения в кристаллической решетке
Жидкое
близко друг к другу
молекулы малоподвижны, при нагревании скорость движения увеличивается
Газообразное
занимает предоставленный объем
больше размеров молекул
хаотичное и непрерывное
В жизни мы встречаем вещества в газообразном состоянии, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояний точно три?
На самом деле есть еще четвертое — плазма. Звучит как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором, помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Модель идеального газа
В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса.
Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической).
В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный.
Свойства идеального газа
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
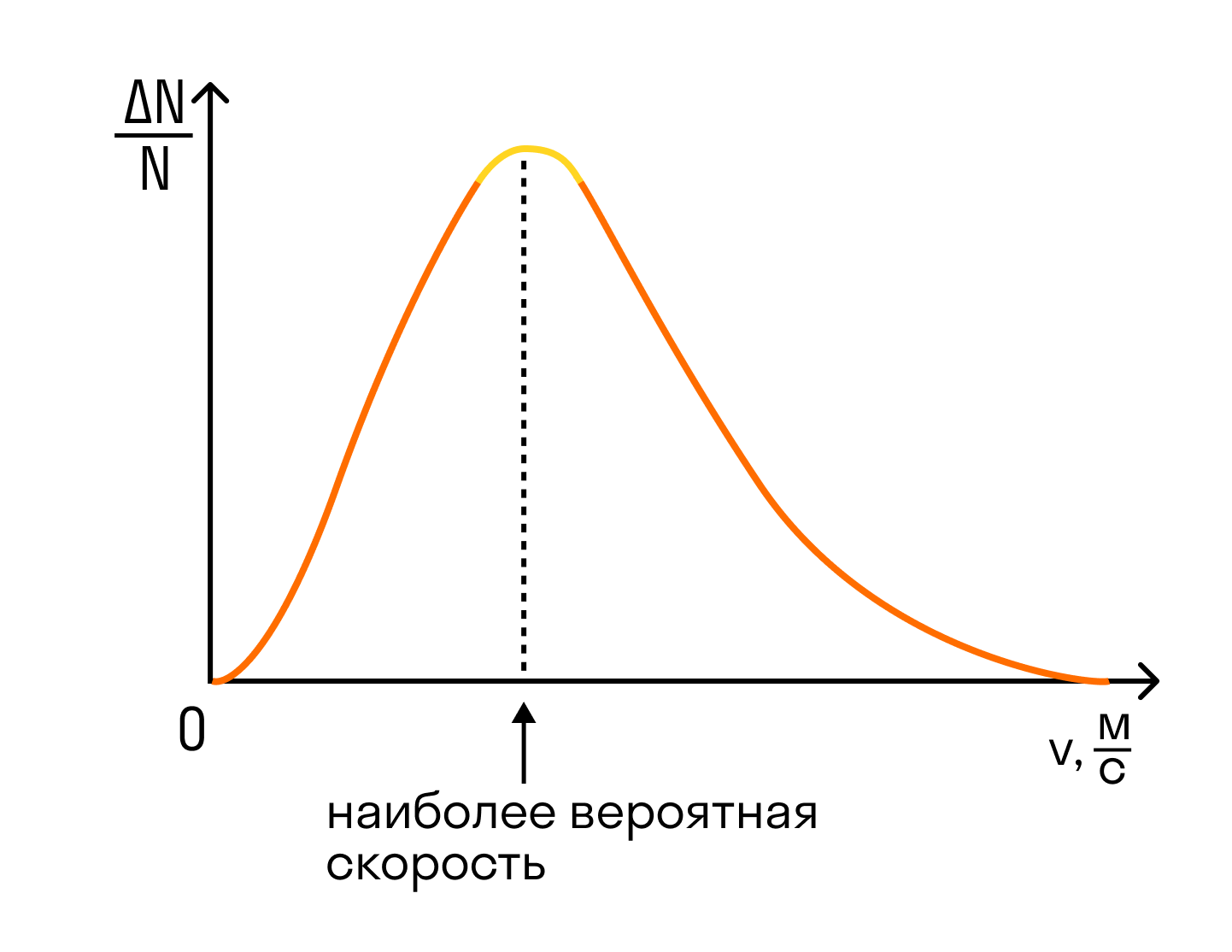
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.
Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Средняя квадратичная скорость
v1, v2, vn — скорости разных молекул [м/с]
N — количество молекул [-]
Давление идеального газа
Молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, за одну секунду на каждый квадратный сантиметр молекулы воздуха наносят столько ударов, что их количество выражается двадцатитрехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул на стенки сосуда приводит к значительному давлению. Представьте, что комар пытается толкать машину — она не сдвинется с места. Но если за работу возьмется пара сотен миллионов комаров, то машину получится сдвинуть.
Эксперимент
Чтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок. Так же и молекулы газа оказывают давление на стенки сосуда, в котором находятся.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
F — сила [Н]
S — площадь [м2]
То есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Рассмотрим аналогичный пример с двумя сосудами разной площади.
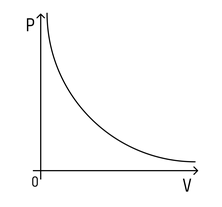
Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
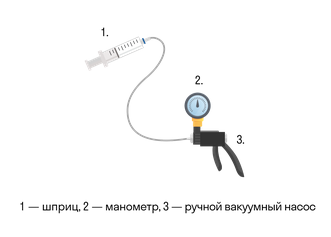
Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
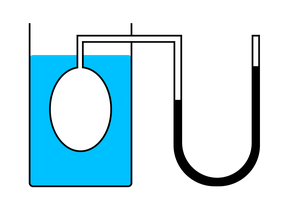
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным.
Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.
Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
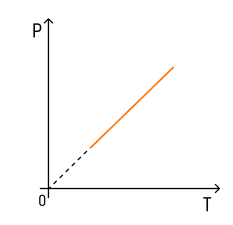
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:
Эта зависимость называется законом Шарля в честь ученого, открывшего ее.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
Основное уравнение МКТ
p = nkT
p — давление газа [Па]
T — температура газа [К]
m 0 — масса одной молекулы [кг]
v — средняя квадратичная скорость [м/с]
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v— и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
Кинетическая энергия
Ек = mv 2 /2
Ек — кинетическая энергия [Дж]
m — масса тела [кг]
v — скорость [м/с]
Для молекулы газа формула примет вид:
Средняя кинетическая энергия поступательного движения молекулы
Ек — средняя кинетическая энергия поступательного движения молекулы [Дж]
m0 — масса молекулы [кг]
v — скорость молекулы [м/с]
Из этой формулы можно выразить m0v 2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Основное уравнение МКТ
p — давление газа [Па]
n — концентрация [м-3]
E — средняя кинетическая энергия поступательного движения молекулы [Дж]
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Средняя скорость молекул
В физике выделяют 2 скорости, характеризующие движение молекул: средняя скорость движения молекул и средняя квадратичная скорость.
Средняя скорость движения молекул
Средняя скорость движения молекул называется также скоростью теплового движения молекул.
Формула средней относительной скорости молекул в физике представлена следующим выражением:
Средняя квадратичная скорость
Средняя квадратичная скорость движения молекул газа это следующая величина:
» open=» υ k υ = 1 N ∑ i = 1 N υ i 2
Формулу средней квадратичной скорости можно переписать так:
Проводя интегрирование, аналогичное интегрированию при получении связи средней скорости с температурой газа, получаем:
» open=» υ k υ = 3 k T m 0 = 3 R T μ
Именно средняя квадратичная скорость поступательного движения молекул газа входит в состав основного уравнения молекулярно-кинетической теории:
где n = N V – это концентрация частиц вещества, N – это количество частиц вещества, V – это объем.
Необходимо определить, как изменяется средняя скорость движения молекул идеального газа с увеличением давления в процессе, изображенном на графике (рисунок 1 ).
Запишем выражение для средней скорости движения молекул газа следующим образом:
» open=» υ = 8 k T πm 0
Из графика видно, что p
» open=» υ = 8 k T πm 0 = 8 C ρ π n n ρ = 8 C π
Ответ: В процессе, представленном на графике, с увеличением давления средняя скорость движения молекул не меняется.
Применим выражение для » open=» υ k υ :
» open=» υ k υ = 3 R T μ
Помимо этого, из уравнения Менделеева-Клайперона и зная, что m μ = N N A :
p = n N A R T → R T = p N A n
» open=» υ k υ = 3 p N A μ n
Определение средней квадратичной скорости молекул газа
Средняя квадратичная скорость молекул газа — что это за параметр
Молекулы любого газа пребывают в постоянном движении. Его можно охарактеризовать с точки зрения средней их скорости или средней квадратичной скорости. Первое понятие имеет специальный термин — скорость теплового движения. Второе — средняя квадратичная скорость — величина, для которой существует специальная формула.
Для того, чтобы полностью разобраться в понятии средней квадратичной скорости молекул газа, вводится условный участник процесса — идеальный газ.
Идеальный газ — это математическая модель, потенциальную энергию которой принимают за ноль, а кинетическую характеризуют в полном объеме. Идеальный газ подходит в качестве модели окружающих нас газов, например, обычного воздуха.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Средняя квадратичная скорость — физическая величина, отличная от средней арифметической скорости молекул, определяемая по формуле: корень квадратный из средней арифметической квадратов скоростей различных молекул.
Кинетическая энергия определяется скоростью движения молекул, поэтому зависит от температуры. Скорости молекул одного газа не одинаковы. Часть молекул движутся очень быстро, часть — с незначительной скоростью. Однако для большинства существует некое среднее значение. Если изобразить это на графике в виде параболы, такие молекулы со средней скоростью будут составлять ее верхнюю часть.
В единице объема газа содержится огромное число молекул. Поэтому, например, его давление на стенки сосуда — величина постоянная. В ином случае, если бы в единицу времени о стенку ударялось различное количество молекул, давление бы «скакало».
Из изложенного можно сделать вывод: скорость — свойство отдельной молекулы газа, а давление — характеристика их совокупности.
От каких величин зависит в идеальном газе
Для идеального газа средняя квадратичная скорость прямо пропорциональна его температуре и обратно пропорциональна молярной массе газа.
В математическом выражении данная зависимость выражается через корень квадратный:
где R — универсальная постоянная величина, Т — температура газа, μ — молярная масса.
Из формулы видно, что искомая величина (средняя квадратичная скорость) зависит от природных свойств газа и его температуры.
Формула средней квадратичной скорости молекул
Математическое выражение формулы выглядит следующим образом:
В формуле присутствуют следующие условные обозначения: V1, V2, Vn — скорости молекул, а N — их количество.
Формула может иметь и другой вид:
Как посчитать в зависимости от природы газа и температуры?
Проведенное интегрирование формулы, цель которого определить зависимость искомой единицы от природных свойств иттемпературы газа, приводит расчеты к формуле:
При поступательном движении молекул газа Vср кв — составляющая уравнения для молекулярно-кинетической теории.
Если n=N/V, где N — число частиц, а V — объем, то концентрация частиц n получает следующее формульное выражение:
Научно-исследовательская работа на тему «Определение средней квадратичной скорости молекул воздуха» (10 класс)
 |
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ВОЛГОГРАДСКОЙ ОБЛАСТИ
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ОКПО 02508493, ОГРН 1023402637565, ИНН/КПП 3442017140/ 344201001
«Определение средней квадратичной скорости
Студент группы Т-113
Волков Илья Владимирович,
Мельникова Ольга Павловна
Введение
Согласно молекулярно-кинетической теории воздух рассматривается как совокупность большого количества молекул. У газообразных веществ расстояния между молекулами значительно больше самих молекул, взаимное притяжение очень мало, молекулы движутся в различных направлениях и с различной скоростью. При движении молекулы испытывают около нескольких миллиардов столкновений в секунду, меняя при этом направление и скорость.
Изучая раздел «Молекулярная физика», мы рассматривали тему о значениях средних квадратичных скоростях молекул газов. В частности утверждалось, что скорость молекул в воздухе приблизительно 500 м/с, скорость молекул водорода составляет около 2 км/с.
Получали эти значения двумя способами:
· рассчитывали, используя формулу, где скорости молекул зависят от абсолютной температуры и молярной массы газов и считалось неправдоподобно большими, даже в конце 19-века;
· скорости измерил Отто Штерн в 1920 году с помощью известного опыта и подтвердил предсказания и расчёты молекулярно-кинетической теории.
Средние скорости молекул превышают скорость звука и достигают сотен метров в 1 с. Эти скорости удалось измерить благодаря тому, что макроскопическому телу (цилиндру в опыте Штерна) можно сообщить столь большую угловую скорость, что за время пролета молекул внутри цилиндра он поворачивается на заметную величину.
Актуальность вопроса состоит в том, можно ли применить физический эксперимент, с использованием приборов из лаборатории физики для определения средней квадратичной скорости молекул воздуха и сравнить их со значениями, полученными с помощью классической формулы.
Цель работы: определение средней квадратичной скорости молекул.
· Провести физический эксперимент;
· Рассчитать среднюю квадратичную скорость, с помощью данных полученных при физическом эксперименте;
· Рассчитать среднюю квадратичную скорость, с помощью классической формулы;
· Сравнить полученные значения.
Предмет исследования: молекулярная физика.
Объект исследования: средняя квадратичная скорость молекул воздуха.
Интересен вопрос о скорости движения молекул газа. В газе царит полный хаос, молекулы движутся по всем направлениям с самыми разными скоростями.
1. В газе есть молекулы с очень маленькими скоростями и с очень большими, но их сравнительно мало.
2. Средняя проекция скорости на любое направление для всего газа равна 0 (иначе, в газе существовали бы потоки).
3. Оказывается, у молекул есть средняя скорость (по модулю), которая зависит от температуры, и основная часть молекул имеет модуль скорости близкий к ней. Эту скорость мы не можем вычислить, но можем легко посчитать среднеквадратичную скорость движения молекул газа, которая отличается от средней скорости коэффициентом порядка 1.
Скорости молекул очень велики — порядка скорости артиллерийских снарядов — и несколько больше скорости звука в соответствующем газе. На первых порах такой результат вызвал замешательство среди физиков. Ведь если скорости молекул столь велики, то как объяснить, например, что запах духов, пролитых в комнате, распространяется довольно медленно; должно пройти несколько секунд, чтобы запах распространился по всей комнате. Однако объяснить этот факт оказалось довольно просто. Молекулы газа, несмотря на свои малые размеры, непрерывно сталкиваются друг с другом. Из-за большой скорости движения молекул число столкновений молекул воздуха в 1 с при нормальных атмосферных условиях достигает нескольких миллиардов.
Откуда, 



Сопоставляя выражения для скоростей, видим, что 




Из уравнения Клапейрона — Менделеева имеем
pV = 
R =
Подставив это значение в уравнение (1), получим:


Таким образом, для определения средней квадратичной скорости молекул газа достаточно знать его массу и объем, который занимает газ. Все эти величины можно определить экспериментальным путем.
1. Экспериментальным путём.
Оборудование: стеклянный шар для определения массы воздуха, резиновая трубка, винтовой зажим, весы, насос, мензурка.
Порядок выполнения работы
1. Определите по барометру атмосферное давление.
2. При помощи весов определите массу шара с воздухом, резиновой трубкой и винтовым зажимом.
3. Откачайте при помощи насоса часть воздуха из шара, перекройте резиновый шланг зажимом, и еще раз определите массу шара с резиновой трубкой и винтовым зажимом.
4. Определите массу откачанного из шара воздуха.
5. Опустите конец резиновой трубки в сосуд с водой и ослабьте винтовой зажим. Вода заполнит часть объема шара, которую занимал откачанный воздух.
6. Определите объем воды в шаре при помощи измерительного сосуда (мензурки).
8. Результаты измерений и вычислений запишите в таблицу:

0,05*


Посчитаем, например, среднюю скорость молекул газа в классной комнате:
T=294K ( t =21 C ), М=0,029 г/моль(табличное значение). С учетом этого имеем:



Таким образом, скорости молекул очень велики — порядка скорости артиллерийских снарядов — и несколько больше скорости звука в соответствующем газе. На первых порах такой результат вызвал замешательство среди физиков. Однако объяснить этот факт оказалось довольно просто. Молекулы газа, несмотря на свои малые размеры, непрерывно сталкиваются друг с другом.
Заключение
Интересен вопрос о скорости движения молекул газа. В газе царит полный хаос, молекулы движутся по всем направлениям с самыми разными скоростями.
В результате проведённого экспериментального исследования и расчёта, выяснилось, что для определения средней квадратичной скорости молекул газа достаточно знать его массу и объем, который занимает газ.
Скорости молекул очень велики — порядка скорости артиллерийских снарядов — и несколько больше скорости звука в соответствующем газе.
Использовались в работе следующие формулы:





Были получены следующие результаты: 502,7 м/с и 423,9 м/с.
Результат эксперимента и классического расчёта отличается из-за того, что вероятны погрешности при использовании простейших физических приборов для измерения массы, объёма и атмосферного давления: стеклянный шар для определения массы воздуха, весы, насос, мензурка и барометр, термометр.
В исследовательской работе подтвердилось, что средние скорости молекул превышают скорость звука и достигают сотен метров в 1 секунду.
Список используемой литературы
2. Гиршфельдер Дж., Кертисс Ч., Берд Р. Молекулярная теория газов и жидкостей. М.: ИЛ, 1961. — 931с.
3. Кикоин А. К., Кикоин И. К. Молекулярная физика. 2-е изд. М.: Наука, 1976.
4. Матвеев А. Н. Молекулярная физика. М.: Высшая школа, 1981. — 400 с.
5. Резибуа П., Де Ленер М. Классическая кинетическая теория жидкостей и газов. Пер. с англ. М.: Мир, 1980.
6. Телеснин Р. В. Молекулярная физика. 2-е изд. М.: Высшая школа, 1973.