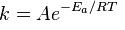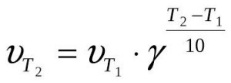в чем измеряется скорость гетерогенной химической реакции
Скорость гетерогенной химической реакции



В гетерогенной химической реакции взаимодействие реагентов происходит на поверхности раздела фаз.
Скорость гетерогенной реакции измеряется изменением количества какого-либо из веществ, вступающих в реакцию или образующихся в результате ее, за единицу времени на единице поверхности раздела фаз
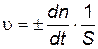 , , | (4.11) |
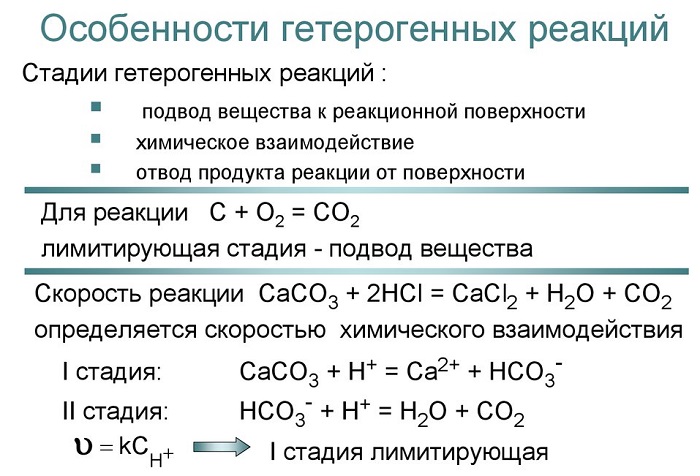
Гетерогенные химические реакции являются сложными, многостадийными процессами. В ходе гетерогенной реакции можно выделить три характерные стадии:
1. Подвод реагирующих веществ к поверхности раздела фаз.
2. Химическая реакция на поверхности раздела фаз.
3. Отвод продуктов реакции из реакционной зоны.
Скорость суммарного гетерогенного процесса определяется наиболее медленной (лимитирующей) стадией.
Если скорость переноса веществ больше, чем скорость химического превращения, т.е. наиболее медленной стадией является вторая стадия, то скорость протекания всего процесса определяется собственно химической реакцией и можно применить закон действующих масс.
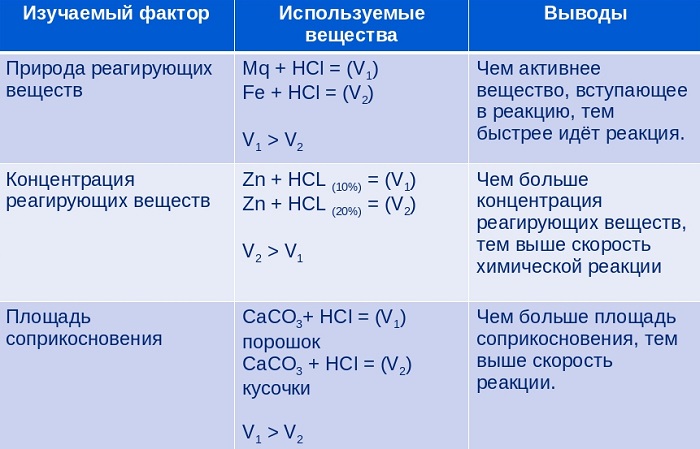
При этом надо иметь в виду, что реакция протекает на поверхности раздела фаз, поэтому общая скорость химической реакции будет зависеть от концентрации жидкого или газообразного вещества, а также от площади соприкосновения фаз. Концентрация твердого вещества не входит в выражение для скорости реакции.
При измельчении твердого вещества скорость реакции будет возрастать из-за увеличения площади поверхности. Например, скорость реакции
зависит от концентрации соляной кислоты и площади поверхности раздела фаз. Скорость реакции порошкообразного карбоната кальция с кислотой выше скорости взаимодействия мраморной крошки с кислотой из-за увеличения площади контакта.
Уравнение скорости в общем виде
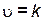
Порядок реакции m может совпадать со значением стехиометрического коэффициента, если лимитирующей стадией процесса является собственно простая химическая реакция.
Скорость реакции, ее зависимость от различных факторов
Теория к заданию 20 из ЕГЭ по химии
Скорость химических реакций, ее зависимость от различных факторов
Гомогенные и гетерогенные химические реакции
Химические реакции протекают с различными скоростями: с малой скоростью — при образовании сталактитов и сталагмитов, со средней скоростью — при варке пищи, мгновенно — при взрыве. Очень быстро проходят реакции в водных растворах, практически мгновенно. Смешаем растворы хлорида бария и сульфата натрия — сульфат бария в виде осадка образуется немедленно. Быстро, но не мгновенно, горит сера, магний растворяется в соляной кислоте, этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, налет на медных и бронзовых изделиях, медленно гниет листва, разрушаются зубы.
Предсказание скорости химической реакции, а также выяснение ее зависимости от условий проведения процесса — задача химической кинетики — науки о закономерностях протекания химических реакций во времени.
Если химические реакции происходят в однородной среде, например, в растворе или в газовой фазе, то взаимодействие реагирующих веществ происходит во всем объеме. Такие реакции, как вы знаете, называют гомогенными.
Скорость гомогенной реакции ($v_<гомог.>$) определяется как изменение количества вещества в единицу времени в единице объема:
Таким образом, скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени:
если объем системы не меняется. Если реакция идет между веществами, находящимися в разных агрегатных состояниях (например, между твердым веществом и газом или жидкостью), или между веществами, неспособными образовывать гомогенную среду (например, между несмешивающимися жидкостями), то она проходит только на поверхности соприкосновения веществ. Такие реакции называют гетерогенными.
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:
Если при какой-либо протекающей реакции экспериментально измерять концентрацию исходного вещества в разные моменты времени, то графически можно отобразить ее изменение с помощью кинетической кривой для этого реагента.
Скорость реакции не является постоянной величиной. Мы указывали лишь некоторую среднюю скорость данной реакции в определенном интервале времени.
Представьте себе, что мы определяем скорость реакции
Изменение количества вещества, по которому определяют скорость реакции, — это внешний фактор, наблюдаемый исследователем. По сути, все процессы осуществляются на микроуровне. Очевидно, для того, чтобы какие-то частицы прореагировали, они прежде всего должны столкнуться, причем столкнуться эффективно: не разлететься, как мячики, в разные стороны, а так, чтобы в частицах разрушились или ослабли старые связи и смогли образоваться новые, а для этого частицы должны обладать достаточной энергией.
В заключение сделаем вывод: многие возможные реакции практически не идут, т.к. высока энергия активации.
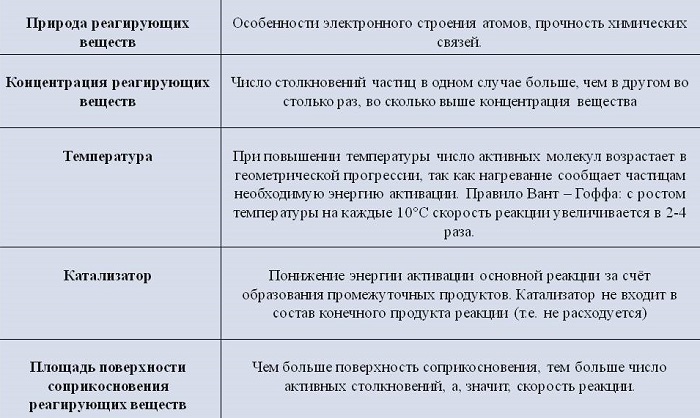
Скорость химической реакции зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в случае гетерогенных реакций. Рассмотрим влияние каждого из этих факторов на скорость химической реакции.
Температура
Вам известно, что при повышении температуры в большинстве случаев скорость химической реакции значительно возрастает. В XIX в. голландский химик Я. Х. Вант-Гофф сформулировал правило:
При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля активных молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции.
Математически эта зависимость выражается соотношением:
Однако для увеличения скорости реакции повышение температуры не всегда применимо, т.к. исходные вещества могут начать разлагаться, могут испаряться растворители или сами вещества.
Концентрация реагирующих веществ
Изменение давления при участии в реакции газообразных веществ также приводит к изменению концентрации этих веществ.
Чтобы осуществилось химическое взаимодействие между частицами, они должны эффективно столкнуться. Чем больше концентрация реагирующих веществ, тем больше столкновений и, соответственно, выше скорость реакции. Например, в чистом кислороде ацетилен сгорает очень быстро. При этом развивается температура, достаточная для плавления металла. На основе большого экспериментального материала в 1867 г. норвежцами К. Гульденбергом и П. Вааге и независимо от них в 1865 г. русским ученым Н. И. Бекетовым был сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Этот закон называют также законом действующих масс.
Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, т.к. они реагируют на поверхности, и их концентрации обычно являются постоянными.
Например, для реакции горения угля
выражение скорости реакции должно быть записано так:
т. е. скорость реакции пропорциональна только концентрации кислорода.
Если же уравнение реакции описывает лишь суммарную химическую реакцию, проходящую в несколько стадий, то скорость такой реакции может сложным образом зависеть от концентраций исходных веществ. Эта зависимость определяется экспериментально или теоретически на основании предполагаемого механизма реакции.
Действие катализаторов
Можно увеличить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации. Их называют катализаторами (от лат. katalysis — разрушение).
Катализатор действует как опытный проводник, направляющий группу туристов не через высокий перевал в горах (его преодоление требует много сил и времени и не всем доступно), а по известным ему обходным тропам, по которым можно преодолеть гору значительно легче и быстрее. Правда, по обходному пути можно попасть не совсем туда, куда ведет главный перевал. Но иногда именно это и требуется! Именно так действуют катализаторы, которые называют селективными. Ясно, что нет необходимости сжигать аммиак и азот, зато оксид азота (II) находит применение в производстве азотной кислоты.
Катализаторы — это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по окончании реакции остающиеся неизменными количественно и качественно.
Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом. Катализаторы широко используют в различных отраслях промышленности и на транспорте (каталитические преобразователи, превращающие оксиды азота выхлопных газов автомобиля в безвредный азот).
Различают два вида катализа.
Гомогенный катализ, при котором и катализатор, и реагирующие вещества находятся в одном агрегатном состоянии (фазе).
Гетерогенный катализ, при котором катализатор и реагирующие вещества находятся в разных фазах. Например, разложение пероксида водорода в присутствии твердого катализатора оксида марганца (IV):
Сам катализатор не расходуется в результате реакции, но если на его поверхности адсорбируются другие вещества (их называют каталитическими ядами), то поверхность становится неработоспособной, требуется регенерация катализатора. Поэтому перед проведением каталитической реакции тщательно очищают исходные вещества.
При производстве метанола используют твердый цинкохромовый катализатор ($8ZnO·Cr_2O_3×CrO_3$):
Вы, конечно, слышали и о других интересных веществах — ингибиторах (от лат. inhibere — задерживать). Они с высокой скоростью реагируют с активными частицами с образованием малоактивных соединений. В результате реакция резко замедляется и затем прекращается. Ингибиторы часто специально добавляют в разные вещества, чтобы предотвратить нежелательные процессы.
Например, с помощью ингибиторов стабилизируют растворы пероксида водорода, мономеры для предотвращения преждевременной полимеризации, соляную кислоту, чтобы была возможность ее транспортировки в стальной таре. Ингибиторы содержатся и в живых организмах, они подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться, например, радиоактивным излучением.
Природа реагирующих веществ (их состав, строение)
Значение энергии активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Если энергия активации мала ($ 120$ кДж/моль), то это означает, что лишь ничтожная часть столкновений между взаимодействующими частицами приводит к реакции. Скорость такой реакции поэтому очень мала. Например, протекание реакции синтеза аммиака при обычной температуре заметить практически невозможно.
Если энергии активации имеют промежуточные значения ($40–120$ кДж/моль), то скорости таких реакций будут средними. К таким реакциям можно отнести взаимодействие натрия с водой или этиловым спиртом, обесцвечивание бромной воды этиленом, взаимодействие цинка с соляной кислотой и др.
Поверхность соприкосновения реагирующих веществ
Скорость реакций, идущих на поверхности веществ, т.е. гетерогенных, зависит при прочих равных условиях от свойств этой поверхности. Известно, что растертый в порошок мел гораздо быстрее растворяется в соляной кислоте, чем равный по массе кусочек мела.
Увеличение скорости реакции объясняется, в первую очередь, увеличением поверхности соприкосновения исходных веществ, а также рядом других причин, например, разрушением структуры правильной кристаллической решетки. Это приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на гладкой поверхности.
В промышленности для проведения гетерогенных реакций используют кипящий слой, чтобы увеличить поверхность соприкосновения реагирующих веществ, подвод исходных веществ и отвод продуктов. Например, при производстве серной кислоты с помощью кипящего слоя проводят обжиг колчедана; в органической химии с применением кипящего слоя проводят каталитический крекинг нефтепродуктов и регенерацию (восстановление) вышедшего из строя (закоксованного) катализатора.
Скорость химической реакции — определение довольно древнее, но по-прежнему актуальное, так как является базовым понятием в химической науке и её прикладном значении. Сама возможность влияния человека на скорость и объем химического процесса позволила в свое время сделать резкий прорыв в этой и многих других областях, потому что больше не приходилось дожидаться результата так же долго, сколько он занимает в естественной природной среде.
Соответственно, наличие катализаторов позволяет ученым и сейчас ускорять прогресс науки, достигать поставленных задач. Такой раздел знаний изучает химическая кинетика — наука, определяющая закономерности влияния физических и химических условий на протекание химических реакций.
Скорость химической реакции — изменение количества одного из реагентов за промежуток времени в реакционном пространстве. Эта скорость является фундаментальным понятием химической кинетики. Она измеряется путём изменения концентрации одного из веществ. Как правило, рассчитывается в молях (классическая единица измерения) на литр за единицу времени.
Стоит сказать, что абсолютно все химические реакции рассматриваются только в системе, т. е. в совокупности отдельно взятых веществ и объектов.
Скорость реакции в гомогенной системе
В химии различают гомогенные (одинаковые фазы внешней среды) и гетерогенные (различающиеся фазы окружающей среды) реакции в зависимости от фаз среды.
Реакции в гомогенной системе происходят только в однородной фазе в общем объеме реакционной системы. Реакция происходит исключительно при взаимодействии растворов жидкостей или газов.
Скорость химической реакции в гомогенной системе — это изменение концентрации одного из веществ, участвующих в химической реакции, за единицу времени.
Ниже приведены примеры таких реакций и нужная формула:
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O.
Скорость реакции в гетерогенной системе
В гетерогенных же системах химические реакции протекают только на поверхности раздела разных фаз.
Поверхность раздела фаз — это граничная поверхность между двумя веществами, вступающими в реакцию, в контакт между собой.
Например, при взаимодействии железа с соляной кислотой: Fe + 2HCl → FeCl2 + H2.
Факторы, влияющие на скорость химической реакции
Как ранее было сказано, скорость химической реакции зависит от нескольких параметров:
соотношения концентраций реагентов;
природы взятых реагентов;
площади соприкосновения реагентов;
давления (применимо, если в случае реагентов взяты газообразные вещества).
Температура
Правилом Вант-Гоффа и уравнением Аррениуса определяется скорость взаимодействия реагентов. Сванте Аррениус искал взаимосвязь скорости и температуры. Он установил, что химические процессы поддаются равенству константы скорости:
Еа — min энергия для запуска реакции;
A — постоянная, указывающая на вероятность возможного взаимодействия молекул.
Удобно пользоваться и правилом Якоба Вант-Гоффа, смысл которого гласит, что увеличивается v реакции от двух до четырех раз при росте температуры на десять градусов (по Цельсию). Для простоты расчётов было создано уравнение:
Соотношение концентраций реагентов
Обусловленность скорости от концентрации реагентов в системе известна в науке, как закон действующих масс. Его открыли Като Гульдберг и Петер Вааге.
Скорость этих реакций выражается уравнением:
v — скорость взаимодействия веществ;
cA и cB — концентрации реагентов;
k —коэффициент скорости.
Катализаторы
Самым распространённым способом изменить скорость реакции является добавление к ней катализатора (ускорителя) или ингибитора (замедлителя).
Основное преимущество таких веществ в том, что они не являются расходным материалом и не влияют на равновесие в продуктах внутри системы.
Для простоты возьмем реакцию разложения пероксида водорода: 2Н2О2 = 2Н2О + О2.
Без дополнительных веществ эта простая реакция протекает довольно медленно, но если добавить оксид марганца (MnO2), то сразу заметим наличие газа (O2).
Природа веществ
Скорость реакции также зависит от природы взятых веществ. Здесь тоже не все так просто, ведь имеет вес почти каждая мелочь этого вещества: характер и прочность кристаллической решетки и химических связей, строение оболочки атомов и расположения на ней электронов (согласно периодическому закону Д. И. Менделеева о порядке веществ в таблице).
Для простоты объяснения приведем пример: согласно строению веществ, натрий (Na) гораздо легче отдает свои электроны, чем олово (Sn), соответственно, реагировать с одним и тем же веществом он будет быстрее.
Площадь соприкосновения реагентов
Что касается смесей твердых и жидких фаз, то тут для увеличения скорости реакции поможет увеличение площади соприкосновения этих веществ.
Приведем пример: если мы возьмем часть щелочного метала в водном растворе, то реакция пойдет достаточно быстро, однако, если мы сделаем из кусочка металла порошок, то скорость взаимодействия увеличится.
Давление
В случае химической реакции, реагентами которой являются газы, то изменить скорость взаимодействия можно увеличением давления в системе, потому что таким образом повышается и концентрация газа. Зависимость скорости от давления будет прямо пропорциональной.
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.