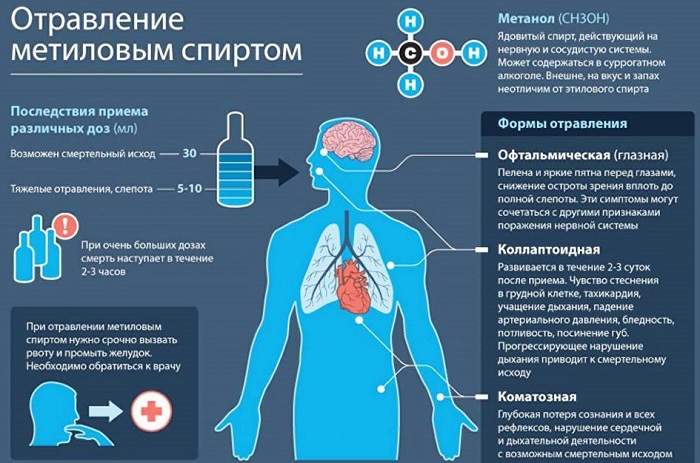
в чем измеряется метанол
Метанол
Метанол – один из наиболее важных по значению крупнотоннажных продуктов химической промышленности.
На сегодняшний день этот рынок напрямую зависит от мировой конъюнктуры, которая пока остается весьма благоприятной ввиду относительной дешевизны российского природного газа и электроэнергии.
В настоящее время РФ является одним из наиболее крупных игроков на мировом рынке метанола, занимая 4 е место по объемам его выпуска после.
Несмотря на экспортную направленность, многие российские производители метанола в последние годы стали больше внимания уделять глубине переработки продукта.
Переработка метанола в последующие продукты экономически более выгодна, чем продажа его в чистом виде.
Побочные реакции при производстве обуславливают бесполезный расход синтез-газа и удорожают очистку метанола.
Степень превращения СО за проход составляет 15-50%, при этом в контактных газах содержится только –4% метанола.
С целью возможно более полной переработки синтез-газа необходимо его возвращение в цикл после выделения метанола и воды.
При циркуляции в синтез-газе накапливаются инертные примеси, что приводит к снижению давления в системе и повлечет за собой снижение выхода и скорости процесса.
Поэтому концентрацию инертных примесей регулируют частичной отдувкой циркуляционного газа. Отдувка проводится с таким расчетом, чтобы количество инертов, поступающих со свежем синтез-газом, было равно количеству инертов, удаляемых с отдувкой.
Метанол это химическое вещество, называемое древесным или метиловым спиртом. Его получение не является сложным, поскольку он относится к одноатомным продуктам. Использование в алкогольных напитках может привести к пищевому отравлению. Он также может образовывать взрывоопасные смеси при температуре 8 градусов по Цельсию.
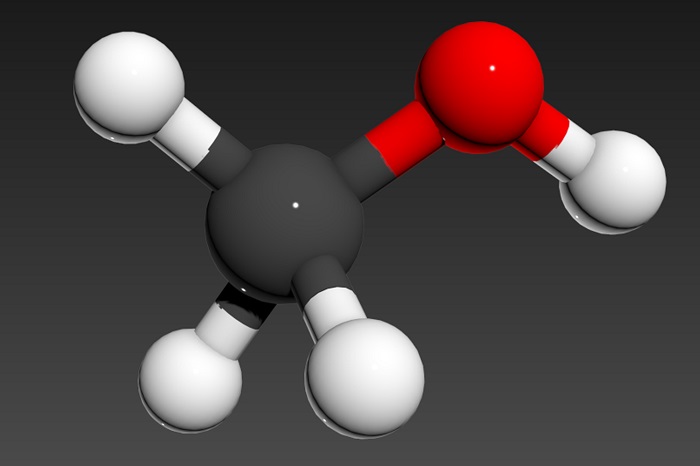
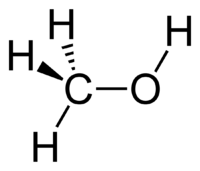
Молекулярная и структурная формула метанола
Чтобы правильно понимать суть происходящего, стоит обратить внимание на название вещества. В его составе 4 атома водорода и по одному атому углерода и кислорода.
Молекулярная формула выглядит так — CH3OH.
Структура отображается в таблице следующим образом:
Процент содержания массы
Молярный вес каждого по отдельности
История открытия
Впервые это вещество обнаружил Роберт Бойль. В 1661 г. он успешно завершил первую сухую перегонку древесины. В чистом виде метанол получилось выделить только через 170 лет.
В 1834 г. два французских химика установили его химическую формулу. А еще через 23 года впервые получили через омыление метилхлорида.
Производство метанола
Промышленность занимается его выпуском в крупных масштабах. Причем способов для этого довольно много. Одним из самых востребованных является синтезирование метана.
Процесс реакции связан с неполным окислением и образованием формы эфира. Еще один способ, разрешенный стандартами ГОСТ, связан с разложением солевых отложений муравьиной кислоты.
Применение метилового спирта
Органическая химия использует его как растворитель. Нефтегазовая и техническая промышленность с его помощью предотвращает появление кристаллических соединений. Это связано с низкой температурой порога замерзания.
В домашних условиях синтез подразумевает окрашивание с помощью лакокрасочных продуктов. Ведь их получение и начальная консистенция зависит от нескольких составляющих.
Насчет суррогатного алкоголя стоит понять одну простую вещь. При попадании в организм, вред неизбежен и необратим вообще. Вероятность отравления и смертельного исходя очень высока.
Физические свойства
По сути, метанол это бесцветная жидкость. Теплопроводные свойства древесного спирта в два раза меньше, чем у бензина. Участвует в образовании взрывоопасных веществ из-за собственной горючести. Температура кипения метанола 64,7 0 С.
Температура горения начинается от 460 градусов. Смешивается с различными жидкостями без каких-либо проблем. Таким способом получения добиваются образования веществ на жидкой основе, не содержащих алифатические углеводы. Азеотропные смеси появляются после тщательного смешивания с ацетоном или дихлорэтаном. Очень токсичен.
Химические свойства и реакции
Как и горючие смеси, метанол имеет собственное октановое число, даже в газообразном состоянии. Оно равняется 111 единицам, что допускает использование в двигателях внутреннего сгорания. Причем это получается даже в состоянии метилового спирта.
Также возможен вариант замены водорода щелочными металлами. Сложные эфиры получаются при взаимодействии с карбоновыми кислотами или минеральными. Положительно реагирует на галогениды фосфора.
Нахождение в природе
Очень редко такое вещество можно обнаружить в свободном состоянии. Даже если удается случайно наткнуться, то количество будет крайне мало. Зато компоненты для производства находятся практически везде. Это растительные масла, различные породы деревьев, почвы и даже минералов.
Класс опасности древесного спирта
Влияние на человеческий организм
Патологические изменения наступают после превышения допустимой нормы. Но слепота это только начало. Дальнейшие действия приведут к поражению участков головного мозга, полному нарушению работы мочевыводящих органов.
Заключение
В высокоразвитых странах метанол добавляют в топливо для автомобилей. Ведь благодаря его свойствам и взаимодействию с горючими веществами, получается экологически чистый продукт. В Российской Федерации использование в качестве товаров для потребителей запрещено по закону. Очень много случаев отравления с летальным исходом.
Метанол
| Метанол | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Метанол |
| Традиционные названия | Метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила |
| Химическая формула | СН3OH |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 32,04 г/моль |
| Плотность | 0,7918 г/см³ |
| Динамическая вязкость (ст. усл.) | 5.9×10 −4 Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | -97 °C |
| Температура кипения | 64,7 °C |
| Температура разложения | 320-380 °C |
| Температура вспышки | 11 °C |
| Температура воспламенения | 467 °C |
| Температура самовоспламенения | 436 °C |
| Пределы взрываемости | 6,0-34,7 % |
| Тройная точка | 175,45 K (−97,7°C) |
| Критическая точка | 513,15 K (240 °C), 7,85 МПа |
| Энтальпия образования (ст. усл.) | -201,6 кДж/моль |
| Удельная теплота испарения | 8.43 ккал/моль = 1,101 кДж/г Дж/кг |
| Удельная теплота испарения | 1190 кДж/кг (20 °C) |
| Давление пара | 11,8 кПа (при 20 °С) |
| Химические свойства | |
| pKa | |
| Структура | |
| Дипольный момент | 1,65 Д |
| Классификация | |
| Рег. номер CAS | 67-56-1 |
| SMILES | CO |
| Безопасность | |
| Токсичность |    |
С воздухом в объёмных концентрациях 6,72—36,5% образует взрывоопасные смеси (температура вспышки 15,6 °C). Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
Содержание
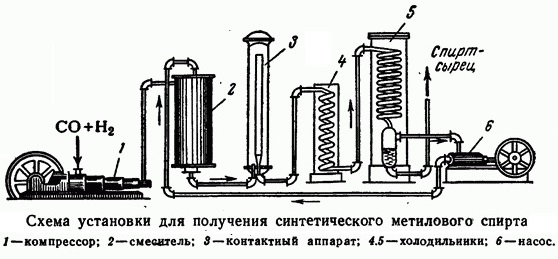
Получение
До 1960-х годов метанол синтезировали только на цинкхромовом катализаторе при температуре 300—400 °C и давлении 25—40 МПа (= 250—400 Бар = 254,9—407,9 кгс/см²). Впоследствии распространение получил синтез метанола на медьсодержащих катализаторах (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200—300 °C и давлении 4—15 МПа (= 40—150 Бар = 40,79—153 кгс/см²).
Современный промышленный метод получения — каталитический синтез из оксида углерода(II) (CO) и водорода (2H2) при следующих условиях:
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Также известны схемы использования с этой целью отходов нефтепереработки, коксующихся углей.
Молекулярная формула — CH4O или CH3—OH, а структурная: 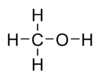

Производство метанола (в тыс. тон):
| год | США | Германия | Мир | Цена продажи($/т) |
|---|---|---|---|---|
| 1928 | 24 | 18 | 140 | 84,7 |
| 1936 | 97 | 93 | 305 | 88,9 |
| 1950 | 360 | 120 | 349 | 83,1 |
| 1960 | 892 | 297 | 3930 | 99,7 |
| 1970 | 2238 | нет данных | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
Крупнейшим производителем метанола в России является ОАО «Метафракс» в Губахе.
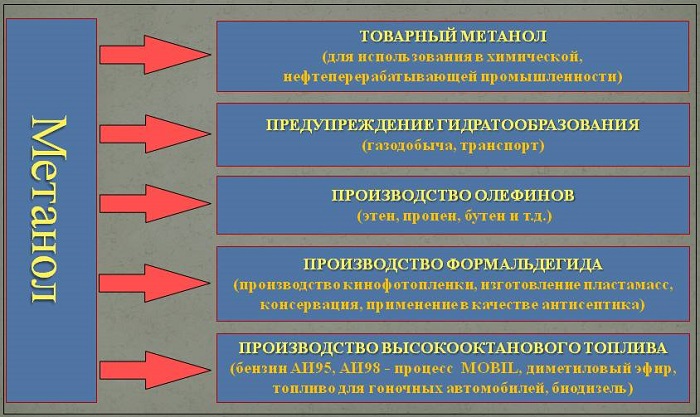
Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида, формалина, уксусной кислоты и ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства карбамидоформальдегидных и фенолформальдегидных смол. Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Используется в топливных элементах.
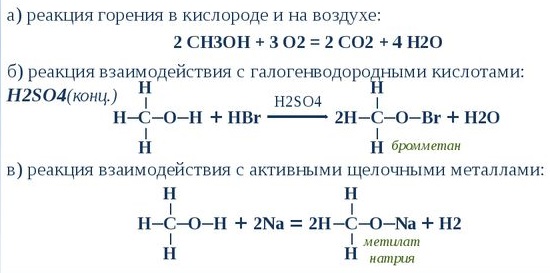
Благодаря высокому октановому числу, что позволяет увеличить степень сжатия до 16 и большей на 20 % энергетической мощностью заряда на основе метанола и воздуха, метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:
Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия.
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли).
Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H + ) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку.
Получение муравьиной кислоты окислением метанола:
Получение диметилового эфира дегидратацией метанола при 300—400 °C и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60 % или цеолитов — селективность процесса близка к 100 %. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53.
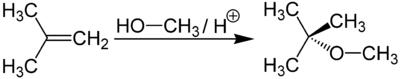
Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол).
Метил-трет-бутиловый эфир (C5H12O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15 %, в Польше — 5 %. В России в среднем составе бензинов содержание МТБЭ составляет до 12 % для АИ92 и до 15 % для АИ95, АИ98.
Гомологизация метанола
Гомологизация, то есть превращение органического соединения в свой гомолог путём внедрения одной или нескольких метиленовых групп, для спиртов была впервые осуществлена в 1940 году — на основе метанола каталитическим путём под воздействием высокого давления был синтезирован этанол [3] :
Побочными продуктами реакции в случае синтеза этанола будут ацетальдегид, этилен и диэтиловый эфир.
В 1940 году впервые была осуществлена катализируемая оксидом кобальта при давлении 600 атм реакция метанола с синтез-газом с образованием в качестве основного продукта этанола… Впоследствии эта реакция, названная гомологизацией, вызвала огромный интерес у химиков. Ее привлекательность связана с возможностью получения этилена из угольного сырья Применение в качестве катализаторов карбонила кобальта Со2(СО)8 позволило понизить давление до 250 атм, при этом степень превращения метанола составила 70 %, а основной продукт — этанол образовывался с селективностью 40 %. В дальнейшем были предложены более селективные катализаторы на основе соединений кобальта и рутения с добавками фосфиновых лигандов и было установлено, что реакцию можно ускорить с помощью введения промоторов — иодид-ионов. В настоящее время удалось достичь селективности по этанолу 90 %. Хотя механизм гомологизации до конца не установлен, можно считать, что он близок к механизму карбонилирования метанола.
Биометанол
Промышленное культивирование и биотехнологическая конверсия морского фитопланктона рассматривается как одно из наиболее перспективных направлений в области получения биотоплива. [5]
В начале 80-х рядом европейских стран совместно разрабатывался проект, ориентированный на создание промышленных систем с использованием прибрежных пустынных районов. Осуществлению этого проекта помешало общемировое снижение цен на нефть.
Первичное производство биомассы осуществляется путём культивирования фитопланктона в искусственных водоёмах, создаваемых на морском побережье.
Вторичные процессы представляют собой метановое брожение биомассы и последующее гидроксилирование метана с получением метанола.
Основными доводами в пользу использования микроскопических водорослей являются следующие:
С точки зрения получения энергии данная биосистема имеет существенные экономические преимущества по сравнению с другими способами преобразования солнечной энергии.
Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объемная и массовая энергоемкость (теплота сгорания) метанола (удельная теплота сгорания = 22,7 МДж/кг) на 40—50 % меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого рост мощности двигателя повышается на 10—15 %. Двигатели гоночных автомобилей работающих на метаноле с более высоким октановым числом чем бензин имеют степень сжатия, превышающую 15:1, в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11,5:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
| Топливо | Плотность энергии | Смесь воздуха с топливом | Удельная энергия смеси воздуха | Удельная теплота испарения | Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| Бензин | 32 МДж/л | 14,6 | 2,9 МДж/кг воздух | 0,36 МДж/кг | 91—99 | 81—89 |
| Бутиловый спирт | 29,2 МДж/л | 11,1 | 3,2 МДж/кг воздух | 0,43 МДж/кг | 96 | 78 |
| Этанол | 19,6 МДж/л | 9,0 | 3,0 МДж/кг воздух | 0,92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6,4 | 3,1 МДж/кг воздух | 1,2 МДж/кг | 156 | 92 |
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемoм в Европе. Сегодня в Китае используется более 1000 млн галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средств, а также высокоуровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива.
Свойства метанола и его реакции
Метанол — бесцветная жидкость с запахом, напоминающим запах этилового спирта, но более слабым. Ощущается как запах вина. Температура кипения 64,7°.
Удельный вес при 0°/0° = 0,8142 (Копп); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Шифф); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a ² =5,107 (Шифф); Критическая температура 241,9° (Шмидт). Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. Безводный метанол, растворяя небольшое количество медного купороса, приобретает голубовато-зеленое окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в метаноле; но он не растворяет CuSO4.7H2O (Клепль).
Метанол (в отличие от этанола) с водой не образует азеотропной смеси, в результате чего смеси вода-метанол могут быть разделены ректификационной перегонкой. Температура кипения водных растворов метанола:
| Methanol Mole % | Т_кип, 760 мм.рт.ст. °C |
|---|---|
| 0 | 100 |
| 5 | 92.8 |
| 10 | 88.3 |
| 15 | 84.8 |
| 20 | 82 |
| 25 | 80.1 |
| 30 | 78.2 |
| 35 | 76.8 |
| 40 | 75.6 |
| 45 | 74.5 |
| 50 | 73.5 |
| 55 | 72.4 |
| 60 | 71.6 |
| 65 | 70.7 |
| 70 | 69.8 |
| 75 | 68.9 |
| 80 | 68 |
| 85 | 67.1 |
| 90 | 66.3 |
| 95 | 65.4 |
| 100 | 64.6 |
Метанол дает со многими солями соединения, подобные кристаллогидратам (сольваты), например: CuSO4 ∙ 2СН3ОН; LiCl ∙ 3СН3ОН; MgCl2 ∙ 6СН3ОН; CaCl2 ∙ 4СН3ОН представляет собой шестисторонние таблицы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение ВаО ∙ 2СН3ОН ∙ 2Н2O получается в виде блестящих призм при растворении ВаО в водном Метаноле и испарении на холоде полученной жидкости при комнатной температуре (Форкранд).
С едкими щелочами метанол образует соединения 5NaOH ∙ 6СН3ОН; 3KOH ∙ 5СН3OH (Геттиг). При действии металлических калия и натрия легко дает алкоголяты, присоединяющие к себе кристаллизационный метанол и иногда воду.
При пропускании паров метанола через докрасна накаленную трубку получается C2H2 и др. продукты (Бертло). При пропускании паров метанола над накаленным цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn). Медленное окисление паров метанола при помощи раскаленной платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2СН3ОН+О2=2НСНО+2Н2О. При действии хлористого цинка и высокой температуры метанол дает воду и алканы, а также небольшие количества гексаметилбензола (Лебедь и Грин). Метанол, нагретый с нашатырем в запаянной трубке до 300°, дает моно-, ди- и триметиламины (Бертло).
При пропускании паров метанола над KOH при высокой температуре выделяется водород и образуются последовательно муравьинокислый, щавелевокислый и, наконец, углекислый калий.
Концентрированная серная кислота дает метилсерную кислоту CH3HSO4, которая при дальнейшем нагревании с Метанолом дает метиловый эфир (см.). При перегонке метанола с избытком серной кислоты в отгон переходит диметилсерная кислота (CH3)2SO4. При действии серного ангидрида SO3 получается CH(OH)(SO3H)2 и CH2(SO3H)2 (см. Метилен).
Метанол при действии соляной кислоты, пятихлористого фосфора и хлористой серы дает хлористый метил СН3Cl. Действием HBr и H2SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, метанол дает СО2, СО, муравьинометиловый эфир, метилсерную кислоту и метилаль СН2(ОСН3)2 (Ренар). При нагревании метанола с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и других искусственных пигментов.
Нахождение в природе
В свободном состоянии [9] метиловый спирт встречается в природе лишь изредка и в очень небольших количествах (например в эфирных маслах), но производные его распространены довольно широко. Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты С6H4(OH)COOCH3, масло жасмина — метиловый эфир антраниловой кислоты С6H4(NH2)COOCH3. Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например природных красителей, алкалоидов и т. п.
В промышленности метиловый спирт раньше получали исключительно путём сухой перегонки дерева. В жидких погонах, так называемом «древесном уксусе», наряду с уксусной кислотой (10 %), ацетоном (до 0,5 %), ацетальдегидом, аллиловым спиртом, метилацетатом, аммиаком и аминами содержится также 1,5-3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор известкового молока, задерживающий её в виде уксуснокислого кальция. Значительно труднее отделить метиловый спирт от ацетона, так как температуры кипения их очень близки (ацетон, т.кип.56,5°; метиловый спирт, т.кип. 64,7°). Все же путём тщательной ректификации на соответствующих колоннах в технике удается почти полностью отделить метиловый спирт от сопутствующего ему ацетона. Неочищенный метиловый спирт называется также «древесным спиртом».
Токсичность
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. [13] Полезный эффект в этом случае обеспечивается отвлечением АДГ I на окисление экзогенного этанола. [14]
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно. [13]