в чем измеряется квантовый выход
Внутренний и внешний квантовый выход излучения, коэффициент полезного действия (к. п. д.)
Активная область идеального светодиода испускает один фотон на каждый инжектированный в нее электрон, т.е. каждый электрон генерирует один световой квант (фотон). Поэтому квантовый выход излучения активной области идеального светодиода равен единице. Внутренний квантовый выход излучения светодиода (или его внутренняя эффективность) определяется отношением числа рожденных в его активной области фотонов к числу инжектированных в нее электронов в единицу времени (секунду), т. е.
где Pint —мощность оптического излучения из активной области светодиода,I—ток инжекции.
Желательно, чтобы все фотоны, испускаемые активной областью, выходили за пределы светодиода. Именно так и должно происходить в идеальных светодиодах, внешний квантовый выход излучения которых равен единице. Однако в реальных светодиодах часть фотонов все же остается внутри полупроводника.
• Они могут быть поглощены подложкой светодиода, если она обладает способностью поглощать излучение данной длины волны.
• Они могут столкнуться с металлической поверхностью контакта и также поглотиться ею, что неминуемо ведет к снижению квантового выхода.
Кроме того, существует полное внутреннее отражение, заключающееся в локализации света внутри структуры, что также снижает вероятность выхода фотонов за пределы полупроводника. Поэтому вводится коэффициент оптического вывода излучения, определяемый
как отношение числа фотонов, излученных светодиодом, к числу фотонов, образованных в активной области в единицу времени (секунду):
где Р — мощность оптического излучения, выходящего за пределы светодиода.
Этот параметр отражает качество светодиода. Без применения сложных и дорогих технологических процессов практически невозможно сделать светодиод с ηextract> 50%.
Внешний квантовый выход излучения светодиода определяется отношением числа фотонов, испущенных светодиодом к числу инжектированных электронов в единицу времени (секунду):
Коэффициент полезного действия (к. п. д.) светодиода определяется как
где I•V— электрическая мощность, подведенная к светодиоду.
Упражнение. Определение квантового выхода излучения светодиода
Рассматривается светодиод с пороговым напряжением, равным Vth= Ед/е = 2 В, и дифференциальным сопротивлениемRs= 20 Ом. Вольтамперная характеристика такого светодиода при прямом смещении имеет вид:V = Vth+ IRs.При пропускании через диод тока I = 20 мА его оптическая мощность составляет Р = 4 мВт приhv=Eg.Требуется определить внутренний и внешний квантовый выход излучения светодиода, а также его к. п. д. Предполагается, что ηextract= 50%.
Шуберт Ф. Светодиоды / Пер. с англ. под ред. А.Э. Юновича. — 2-е изд. – М.: ФИЗМАТЛИТ, 2008. – 496 с. – ISBN 978-5-9221-0851-5.
Большая Энциклопедия Нефти и Газа
Величина квантового выхода дает важную информацию о механизме фотохимической реакции. [1]
Величина квантового выхода зависит от концентрации люминесцирующего вещества в растворе, температуры, присутствия посторонних примесей. [2]
Величина квантового выхода в общем случае зависит от промежутка времени, в течение которого производят измерения. [3]
Величина квантового выхода зависит от концентрации люминесцирующего вещества в растворе, температуры, присутствия посторонних примесей. [4]
Падение величины квантового выхода при увеличении концентрации алюминия, усиливающееся с ростом концентрации растворителя, может быть объяснено фильтровыми э ( Мектами, связанными с увеличением интенсивности поглощения. Аналогичные зависимости наблюдаются также для процессов комплексообразо-вания галлия и индия. [5]
По величине квантового выхода фотохимические реакции можно разделить условно на три группы: 1) меньше единицы, 2) равен единице или несколько больше, 3) много больше единицы. Квантовый выход меньше единицы объясняется двумя основными причинами: потерями энергии на излучение или ее рассеянием по многим связям у сложных молекул и наличием обратных фотохимических реакций. Естественно, что обе эти причины снижают квантовый выход. [6]
Последнее объяснение понижения величины квантового выхода фотосинтеза казалось бы весьма вероятным, если бы экспериментальные кривые давали указания на то, что для фотосинтеза требуется определенный минимум колебательной энергии у молекулы, находящейся в электронно возбужденном состоянии. [7]
Полученные разными авторами величины квантового выхода реакции фоторазложения других диазосоединений также сильно отличаются друг от друга. [8]
Следует отметить, что величина квантового выхода сильно зависит как от материала частиц, так и от направления падающего излучения. Квантовый выход очень мал в припороговой области, а в наиболее интересной области вакуумного ультрафиолета может составлять один электрон на несколько квантов излучения. Поэтому фотоэмиссионная зарядка пылевых частиц особенно важна в космосе. [10]
Необходимо отметить, что величина квантового выхода фотосинтеза сильно варьирует в зависимости от состояния растений и от конкретных условий, в которых этот процесс осуществляется. В разных условиях проведения опытов могут получаться разные величины квантового выхода. Однако это не исключает необходимости выябнить, какое минимальное количество квантов требуется для восстановления одной молекулы углекислоты в оптимальных условиях протекания процесса фотосинтеза, ото может характеризовать количество элементарных фотохимических актов и поэтому имеет принципиально важное значение для изучения механизма фотосинтеза. Объектом в их опытах была одноклеточная водоросль хлорелла; работу проводили с такой густой суспензией водорослей, которая поглощала весь падающий на нее свет. [11]
Экспериментально показано, что величина квантового выхода сенсибилизованной фосфоресценции в пределах погрешности измерений не зависит ни от концентрации донора энергии, ни от концентрации акцептора. Величина квантового выхода зависит, естественно, от природы молекул донора и акцептора энергии. [12]
Для первой группы характерна зависимость величины квантового выхода от положения полосы флуоресценции: чем больше сдвиг в длинноволновую область, тем меньше квантовый выход. Отсутствие такой зависимости у родаминов второй группы, по-видимому, связано с тем, что у них арильные заместители понижают основность аминогруппы и тем самым уменьшают вероятность внутримолекулярного переноса заряда. [13]
Квантовый выход первичной фотохимической реакции
Кроме общего квантового выхода 
1. Первичный квантовый выход g1 равен отношению числа прореагировавших возбужденных молекул в первичном акте к числу поглощенных квантов.
2. Вторичный квантовый выход g2 является мерой развития вторичных реакций и равен отношению числа образовавшихся в процессе молекул продукта к числу молекул, прореагировавших в первичном акте. По определению, g = g1 g2.

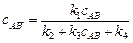
Отсюда скорость химической реакции 
Выразим первичный квантовый выход 

Из этого уравнения следует, что квантовый выход первичной фотохимической реакции всегда меньше единицы.
Пример фотохимической реакции – поглощение диоксида углерода и воды растениями (фотосинтез).
Реакция соответствует уравнению
Квантовый выход этой реакции равен 0,1 в расчете на одну молекулу диоксида. Реакция протекает за счет солнечной энергии, которая поглощается зеленым пигментом хлорофиллом, содержащимся в растениях. Фотосинтез – основа жизни на Земле, так как пополняет запасы кислорода и синтезирует органические вещества в клетках.
Другой важнейший пример – это реакция 
Рассмотрим экспериментальное определение квантового выхода реакции. Для этого введем такое понятие, которое называется тушением, это отношение числа поглощенных квантов света к числу испускаемых при дезактивации, т.е. 
Величину тушения найдем как

Если изобразить графически экспериментальные данные по тушению в координатах 
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
8 Фотохимические реакции. Основные законы фотохимии. Квантовый выход
Фотохимические реакции. Основные законы фотохимии. Квантовый выход. Общее уравнение скорости фотохимической реакции. Типы фотохимических процессов.
ОСНОВНЫЕ ЗАКОНЫ ФОТОХИМИИ. КВАНТОВЫЙ ВЫХОД.
Фотохимией называется раздел физической химии, изучающий закономерности протекания химических процессов, обусловленных действием света.
Основной процесс, проходящий под действием света, — фотодиссоциация, или возбуждение молекул.
Гротгус в России (1817) и Дрейпер в США (1839) независимо друг от друга сформулировали закон, согласно которому химически активны лишь те лучи, которые поглощаются реакционной смесью. Этот закон очевиден и не имеет исключений. Закон Гротгуса-Дрейпера непосредственно связывает химическое действие света с его поглощением веществом.
Ламберт (1760) установил, что ослабление интенсивности dI света, прошедшего через слой толщиной dl, прямо пропорционально толщине слоя и интенсивности падающего света I, а Бер (1853) показал, что поглощение тонким слоем прямо пропорционально числу частиц (молекул) или их концентрации в слое. Объединенный закон Ламберта-Бера можно записать в форме :
Рекомендуемые файлы
Вант-Гофф показал (1904), что количество химически измененного вещества прямо пропорционально количеству поглощенной веществом световой энергии. Количество энергии Q, поглощенной в единицу времени, может быть найдено из закона Ламберта-Бера :
Тогда скорость фотохимической реакции 
Наиболее интересным и важным законом, позволившим разобраться в механизме фотохимических реакций, является закон фотохимической эквивалентности Штарка-Эйнштейна (1912), который гласит, что каждому поглощенному кванту излучения hn соответствует одна измененная молекула.
Число квантов, поглощенных в единицу времени, равно na = Q/hn. Следовательно, изменению под действием света должны подвергнуться np = Q/hn молекул.
Опыт показывает, что во многих случаях число фотохимически прореагировавших молекул не равно числу поглощенных квантов. Поэтому для характеристики фотохимических реакций было введено понятие квантового выхода g. Квантовым выходом называется отношение числа прореагировавших молекул к числу поглощенных квантов :
g = 

Скорость химической реакции
— 



Это наиболее общее выражение для скорости фотохимической реакции, объединяющее все законы фотохимии и дающее теоретическую интерпретацию коэффициенту пропорциональности в уравнении (3).
ОСНОВНЫЕ ТИПЫ ФОТОХИМИЧЕСКИХ ПРОЦЕССОВ.
Как показывает опыт, все фотохимические реакции в зависимости от величины квантового выхода можно подразделить на четыре группы :
1. Реакции, в которых квантовый выход g = 1 (например, образование перекиси водорода);
2. Реакции, в которых g 1 (образование хлористого сульфурила, бромистого водорода, озона, разложение бромистого водорода, двуокиси азота, азометана, хлорноватистой кислоты);
4. Реакции, в которых g >> 1 (реакция взаимодействия хлора с водородом).
Отклонение квантового выхода от единицы не означает отклонения от закона фотохимической эквивалентности. Фотохимический процесс слагается из первичного процесса, протекающего в результате поглощения светового кванта и, как правило, приводящего к диссоциации молекулы и образованию свободных атомов и радикалов, и из вторичных процессов, протекающих в результате вступления в реакцию образовавшихся атомов и радикалов. Первичные фотохимические процессы, являющиеся истинно фотохимическими, всегда подчиняются закону эквивалентности Штарка-Эйнштейна. Таким образом, отклонение квантового выхода от единицы означает появление вторичных процессов, которые идут уже без поглощения света.
Квантовый выход реакций, протекающих в растворах или в газах при очень малых давлениях, очень часто оказывается меньше 1. При реакциях в растворах это происходит вследствие дезактивации возбужденных молекул в результате передачи энергии молекулам растворителя или в результате рекомбинации возникших при фотодиссоциации атомов и молекул, причем рекомбинация облегчается молекулами растворителя, играющими роль третьих частиц. Такое уничтожение реакционноспособных частиц получило название эффекта ячейки (клетки) Франка-Рабиновича.
Если реакция идет в газах, находящихся под малым давлением, то возникшие активные молекулы могут дезактивироваться путем испускания света до того, как они столкнутся с реагирующими молекулами.
В ряде случаев квантовый выход оказывается больше 1; особенно часто он равен 2 или 3. Примерами таких процессов могут служить реакции разложения в газовой фазе следующих веществ (g = 2):
Фотохимическое разложение бромистого и йодистого водорода представляет собой фотореакции, механизм которых наиболее известен.
В некоторых случаях квантовый выход может быть порядка десятков. Например, для реакции разложения перекиси водорода в воде квантовые выходы лежат в пределах от 7 до 500. Детальный механизм реакций, для которых g > 1, во многих случаях неизвестен.
К первичным фотохимическим процессам близки так называемые сенсибилизированные реакции, в которых участвуют не те молекулы, которые непосредственно поглощают лучистую энергию, а соседние молекулы, которые сами по себе нечувствительны к излучению данной частоты и получают энергию от непосредственно поглощающих её молекул. Примером такого процесса является диссоциация молекулярного водорода в присутствии паров ртути. Известно большое число сенсибилизированных реакций. Кроме паров ртути сенсибилизаторами могут быть галогены, хлорофилл, ионы железа и др.
В фотохимических реакциях равновесие смещается под действием света. Заметное нарушение равновесия можно наблюдать только тогда, когда квантовый выход реакции близок к единице.
Основные законы фотохимии. Квантовый выход
Фотохимические реакции. Основные законы фотохимии. Квантовый выход. Общее уравнение скорости фотохимической реакции. Типы фотохимических процессов
Гротгус в России (1817) и Дрейпер в США (1839) независимо друг от друга сформулировали закон, согласно которому химически активны лишь те лучи, которые поглощаются реакционной смесью. Этот закон очевиден и не имеет исключений. Обратное утверждение, что лучи, которые поглощаются при реакции, являются фотохимически активными, не верно, так как не все они вызывают фотохимическую реакцию. Закон Гротгуса – Дрейпера непосредственно связывает химическое действие света с его поглощением веществом.
Ламберт (1760) установил, что ослабление интенсивности dI света, прошедшего через слой толщиной dl, прямо пропорционально толщине слоя и интенсивности падающего света I, а Бер (1853) показал, что поглощение тонким слоем прямо пропорционально числу частиц (молекул) или их концентрации в слое. Объединенный закон Ламберта – Бера можно записать в форме
Вант-Гофф показал (1904), что количество химически измененного вещества прямо пропорционально количеству поглощенной веществом световой энергии. Количество энергии Q, поглощенной в единицу времени, может быть найдено из закона Ламберта – Бера:
Тогда скорость фотохимической реакции 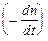
Наиболее интересным и важным законом, позволившим разобраться в механизме фотохимических реакций, является закон фотохимической эквивалентности Штарка – Эйнштейна (1912), который гласит, что каждому поглощенному кванту излучения hn соответствует одна измененная молекула. Закон Штарка – Эйнштейна – основной закон фотохимии.
Количество энергии, необходимое для фотопревращения одного моля вещества при данной длине волны, равно NA hn = 6,02×10 23 hn и носит название эйнштейн. Числовое значение одного эйнштейна зависит от частоты колебаний. Например, 1 эйнштейн при длине волны 700 нм равен 170,7 кДж/моль, а при длине волны 200 нм равен 598,3 кДж/моль.
Число квантов, поглощенных в единицу времени, равно na = Q/hn. Следовательно, изменению под действием света должны подвергнуться np = Q/hn молекул.
Опыт показывает, что во многих случаях число фотохимически прореагировавших молекул не равно числу поглощенных квантов. Поэтому для характеристики фотохимических реакций было введено понятие квантового выхода g. Квантовым выходом называется отношение числа прореагировавших молекул к числу поглощенных квантов:
g = 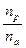
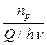
Скорость химической реакции
— 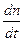
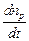
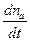
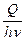
Это наиболее общее выражение для скорости фотохимической реакции, объединяющее все законы фотохимии и дающее теоретическую интерпретацию коэффициенту пропорциональности в уравнении (3).
Особенностью фотохимической активации является ее селективность. Поглощенные кванты света возбуждают и тем самым приводят в активное состояние отдельную связь или группу атомов в данной молекуле. В этом большое преимущество активации молекул светом по сравнению с термической активацией.
Кинетика фотохимических реакций описывается обычными дифференциальными уравнениями, выражающими закон действующих масс. Единственное отличие от обычных реакций с термическим возбуждением состоит в том, что скорость первичных фотохимических процессов не зависит от концентрации исходного вещества, а определяется только интенсивностью света.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет




