в чем измеряется коррозия металла
Скорость коррозии металла
Скорость коррозии металла
В случае равномерной коррозии скорость может быть определена по формуле:
v=Δm / S•t, где
Отметим, что весовой показатель не всегда удобен, особенно если сравнивается коррозия металлов разной плотности. В таких случаях лучше пользоваться глубинным показателем коррозии, т.е. средней глубиной проникновения коррозионного разрушения в металл.
Кроме скорости коррозии металла, к часто используемым показателям (критериям) коррозии относят:
Прямые показатели коррозии
Косвенные показатели коррозии
Глубинный показатель коррозии
∏=8,76•v/ρ, где
8,76 — коэффициент для перехода от измерения весового показателя скорости коррозии в расчете на 1 ч к глубинному показателю в расчете на 1 год (24 ч • 360=8760 ч);
v — скорость коррозии, г/(м 2 •ч);
ρ — плотность, г/см 3 ;
В том случае, если коррозия имеет местный характер, скорость ее не может быть точно охарактеризована весовым или глубинным показателем. При питтинговой коррозии необходимо определять максимальный глубинный показатель. При межкристаллитной коррозии и коррозионном растрескивании скорость коррозии количественно характеризуется механическим показателем коррозии, например, по потере прочности:
σ0 — предел прочности до коррозии;
σ1 — предел прочности после коррозии, рассчитанный по отношению к первоначальной площади сечения металлического образца;
В чем измеряется коррозия металла
Единая система защиты от коррозии и старения
Методы определения показателей коррозии и коррозионной стойкости
Unified system of corrosion and ageing protection. Metals and alloys. Methods for determination of corrosion and corrosion resistance indices
Дата введения 1987-01-01
1. РАЗРАБОТАН И ВНЕСЕН Государственным комитетом СССР по управлению качеством продукции и стандартам
Л.И.Топчиашвили, Г.В.Козлова, канд. техн. наук (руководители темы); В.А.Атанова, Г.С.Фомин, канд. хим. наук, Л.М.Самойлова, И.Е.Трофимова
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 31.10.85 N 3526
3. Стандарт полностью соответствует СТ СЭВ 4815-84, СТ СЭВ 6445-88
5. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
Номер пункта, приложения
6. ПЕРЕИЗДАНИЕ с Изменением N 1, утвержденным в октябре 1989 г. (ИУС 2-90)
Настоящий стандарт устанавливает основные показатели коррозии и коррозионной стойкости (химического сопротивления) металлов и сплавов при сплошной, питтинговой, межкристаллитной, расслаивающей коррозии, коррозии пятнами, коррозионном растрескивании, коррозионной усталости и методы их определения.
Показатели коррозии и коррозионной стойкости используют при коррозионных исследованиях, испытаниях, проверках оборудования и дефектации изделий в процессе производства, эксплуатации, хранения.
1. ПОКАЗАТЕЛИ КОРРОЗИИ И КОРРОЗИОННОЙ СТОЙКОСТИ
1.1. Показатели коррозии и коррозионной стойкости металла определяют в заданных условиях, учитывая их зависимость от химического состава и структуры металла, состава среды, температуры, гидро- и аэродинамических условий, вида и величины механических напряжений, а также назначение и конструкцию изделия.
1.2. Показатели коррозионной стойкости могут быть количественными, полуколичественными (балльными) и качественными.
1.3. Коррозионную стойкость следует, как правило, характеризовать количественными показателями, выбор которых определяется видом коррозии и эксплуатационными требованиями. Основой большинства таких показателей является время достижения заданной (допустимой) степени коррозионного поражения металла в определенных условиях.
Показатели коррозионной стойкости, в первую очередь время до достижения допустимой глубины коррозионного поражения, во многих случаях определяют срок службы, долговечность и сохраняемость конструкций, оборудования и изделий.
1.4. Основные количественные показатели коррозии и коррозионной стойкости металла приведены в таблице. Для ряда коррозионных эффектов (интегральных показателей коррозии) приведены соответствующие им скоростные (дифференциальные) показатели коррозии.
Основные количественные показатели коррозии и коррозионной стойкости
Коррозионный эффект (интегральный показатель коррозии)
Скоростной (дифференциальный) показатель коррозии
Показатель коррозионной стойкости
Глубина проникновения коррозии
Линейная скорость коррозии
Время проникновения коррозии на допустимую (заданную) глубину*
Потеря массы на единицу площади
Скорость убыли массы
Время до уменьшения массы на допустимую (заданную) величину*
Степень поражения поверхности
Время достижения допустимой (заданной) степени поражения*
Максимальная глубина питтинга
Максимальная скорость проникновения питтинга
Минимальное время проникновения питтингов на допустимую (заданную) глубину*
Максимальный размер поперечника питтинга в устье
Минимальное время достижения допустимого (заданного) размера поперечника питтинга в устье*
Степень поражения поверхности питтингами
Время достижения допустимой (заданной) степени поражения*
Глубина проникновения коррозии
Скорость проникновения коррозии
Время проникновения на допустимую (заданную) глубину*
Снижение механических свойств (относительного удлинения, сужения, ударной вязкости, временного сопротивления разрыву)
Время снижения механических свойств до допустимого (заданного) уровня*
Глубина (длина) трещин
Скорость роста трещин
Время до появления первой трещины**
Снижение механических свойств (относительного удлинения, сужения)
Время до разрушения образца**
Уровень безопасных напряжений** (условный предел длительной коррозионной прочности**)
Пороговый коэффициент интенсивности напряжений при коррозионном растрескивании**
Глубина (длина) трещин
Скорость роста трещин
Количество циклов до разрушения образца**
Условный предел коррозионной усталости**
Пороговый коэффициент интенсивности напряжений при коррозионной усталости**
Степень поражения поверхности отслоениями
Скорость проникновения коррозии
Суммарная длина торцов с трещинами
Глубина проникновения коррозии
При линейной зависимости коррозионного эффекта от времени соответствующий скоростной показатель находят отношением изменения коррозионного эффекта за определенный интервал времени к величине этого интервала.
При нелинейной зависимости коррозионного эффекта от времени соответствующий скоростной показатель коррозии находят как первую производную по времени графическим или аналитическим способом.
Показатели коррозионной стойкости при воздействии на металл механических факторов, в том числе остаточных напряжений, отмеченные в таблице знаком**, определяют непосредственно при коррозионных испытаниях.
Схема зависимости коррозионного эффекта (интегрального показателя) от времени
1.6. Допускается использование наряду с приведенными в таблице показателями других количественных показателей, определяемых эксплуатационными требованиями, высокой чувствительностью экспериментальных методов или возможностью использования их для дистанционного контроля процесса коррозии, при предварительном установлении зависимости между основным и применяемым показателями. В качестве подобных показателей коррозии с учетом ее вида и механизма могут быть использованы: количество выделившегося и (или) поглощенного металлом водорода, количество восстановившегося (поглощенного) кислорода, увеличение массы образца (при сохранении на нем твердых продуктов коррозии), изменение концентрации продуктов коррозии в среде (при их полной или частичной растворимости), увеличение электрического сопротивления, уменьшение отражательной способности, коэффициента теплопередачи, изменение акустической эмиссии, внутреннего трения и др.
Для электрохимической коррозии допускается использование электрохимических показателей коррозии и коррозионной стойкости.
При щелевой и контактной коррозии показатели коррозии и коррозионной стойкости выбирают по таблице в соответствии с видом коррозии (сплошная или питтинговая) в зоне щели (зазора) или контакта.
1.7. Для одного вида коррозии допускается характеризовать результаты коррозионных испытаний несколькими показателями коррозии.
При наличии двух или более видов коррозии на одном образце (изделии) каждый вид коррозии характеризуют собственными показателями. Коррозионную стойкость в этом случае оценивают по показателю, определяющему работоспособность системы.
1.8. При невозможности или нецелесообразности определения количественных показателей коррозионной стойкости допускается использовать качественные показатели, например, изменение внешнего вида поверхности металла. При этом визуально устанавливают наличие потускнения; коррозионных поражений, наличие и характер слоя продуктов коррозии; наличие или отсутствие нежелательного изменения среды и др.
Изменение внешнего вида допускается оценивать баллами условных шкал, например, для изделий электронной техники по ГОСТ 27597.
1.9. Допустимые показатели коррозии и коррозионной стойкости устанавливают в нормативно-технической документации на материал, изделие, оборудование.
2. ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЕЙ КОРРОЗИИ
2.1. Сплошная коррозия

— масса образца после испытаний и удаления продуктов коррозии, кг;
2.1.2. При образовании трудноудаляемых твердых продуктов коррозии или нецелесообразности их удаления количественную оценку сплошной коррозии проводят по увеличению массы. Увеличение массы на единицу площади поверхности вычисляют по разности масс образца до и после испытаний, отнесенной к единице площади поверхности образца. Для вычисления потери массы металла по увеличению массы образца необходимо знать состав продуктов коррозии.
Скорость коррозии металлов. Методы оценки коррозионных процессов
Скорость коррозии – многофакторный параметр, который зависит как от внешних условий среды, так и от внутренних свойств материала. В нормативно-технической документации существуют определенные ограничения по допустимым значениям разрушения металла при эксплуатации оборудования и строительных конструкций для обеспечения их безаварийной работы. В проектировании не существует универсального метода определения скорости коррозии. Это связано со сложностью учета всех факторов. Наиболее надежным методом является изучение истории эксплуатации объекта.
Критерии

В настоящее время в проектировании техники используют несколько показателей скорости коррозии:

Первый показатель по прямому методу оценки является наиболее распространенным.
Расчетные формулы
В общем случае весовые потери, определяющие скорость коррозии металла, находят по следующей формуле:
где q – уменьшение массы металла, г;
S – площадь поверхности, с которой произошел перенос материала, м2;
t – период времени, ч.
Для листового проката и изготовленных из него обечаек определяют глубинный показатель (мм/год):
m – глубина проникновения коррозии в металл.
Между первым и вторым показателями, описанными выше, существует следующая зависимость:
где ρ – плотность материала.
Основные факторы, влияющие на скорость коррозии

На скорость разрушения металла влияют следующие группы факторов:
Физико-химические свойства
Наибольшее значение среди внутренних факторов коррозии имеют следующие:
Влияние кислотности среды

В процессе химической коррозии концентрация ионов водорода оказывает влияние на следующие моменты:
При рН в интервале значений 4-10 единиц (кислый раствор) коррозия железа зависит от интенсивности проникновения кислорода к поверхности объекта. В щелочных растворах скорость коррозии сначала уменьшается из-за пассивации поверхности, а затем, при рН>13 увеличивается в результате растворения защитной оксидной пленки.
Для каждого вида металла существует своя зависимость интенсивности разрушения от кислотности раствора. Благородные металлы (Pt, Ag, Au) устойчивы к коррозии в кислой среде. Zn, Al быстро разрушаются как в кислотах, так и в щелочах. Ni и Cd устойчивы к щелочам, но легко корродируют в кислотах.
Состав и концентрация нейтральных растворов
Скорость коррозии в нейтральных растворах зависит в большей степени от свойств соли и ее концентрации:
Некоторые виды солей способны образовывать труднорастворимую пленку (например, фосфорнокислое железо). Это способствует защите металла от дальнейшего разрушения. Данное свойство используется при применении нейтрализаторов ржавчины.
Замедлители коррозии
Замедлители (или ингибиторы) коррозии различаются по механизму действия на окислительно-восстановительный процесс:
К последней группе относятся нейтрализаторы ржавчины, которые используются также для очистки от окислов. В их состав, как правило, входит ортофосфорная кислота. Под ее влиянием происходит фосфатирование металла – образование прочного защитного слоя нерастворимых фосфатов. Нейтрализаторы наносят пульверизатором или валиком. Через 25-30 минут поверхность приобретает бело-серый цвет. После высыхания состава наносят лакокрасочные материалы.
Механическое воздействие
Повышению коррозии в агрессивной среде способствуют такие типы механического воздействия, как:
Конструктивные факторы
При конструировании элементов, работающих в агрессивных условиях, необходимо учитывать, что скорость коррозии возрастает в следующих случаях:
Методы оценки
Существует несколько способов оценки скорости разрушения металлов в агрессивных средах:
Коррозия металлов. Виды коррозии металлов
Определение коррозии
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
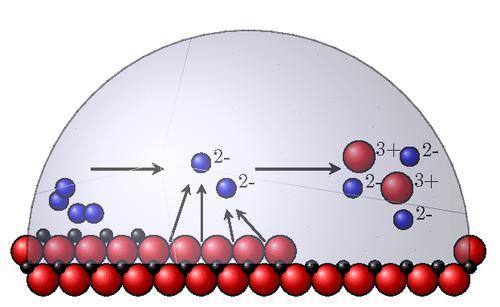
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H + +2e — = H2 разряд водородных ионов
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
K: O2 + 4H + + 4e — = 2H2O
Катодом является та поверхность, где больше приток кислорода.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов