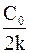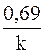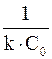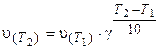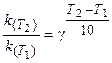в чем измеряется константа скорости химической реакции
Константа скорости вычисляется по формуле



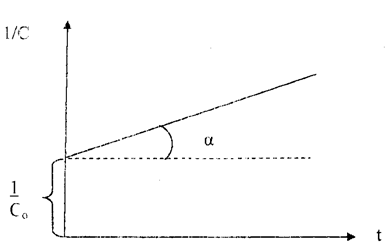
Рис. 40. Зависимость величины обратной концентрации реагента от времени для реакции второго порядка
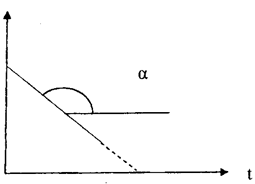
Рис. 39. Зависимость логарифма концентрации реагента от времени протекания для реакции первого порядка
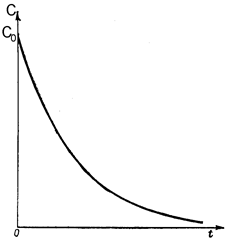
Рис. 38. Изменение концентрации исходного вещества от времени в реакции первого порядка
Рис. 37. Изменение концентрации исходного вещества от времени в реакции нулевого порядка
Математически данная линейная зависимость запишется следующим образом
где k – константа скорости, С0 – начальная молярная концентрация реагента, С – концентрация в момент времени t.
Из неё можно вывести формулу для расчёта константы скорости химической реакции нулевого порядка.
k = 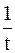
Время полупревращения для реакции нулевого порядка пропорционально концентрации исходного вещества
t½ =
Для реакций первого порядка кинетическая кривая в координатах С,t носит экспоненциальный характер и выглядит следующим образом (рис. 38) Математически данная кривая описывается следующим уравнением
На практике для реакций первого порядка кинетическую кривую чаще всего строят в координатах lnC, t. В этом случае наблюдается линейная зависимость lnС от времени (рис. 39)
Соответственно, величину константы скорости и время полупревращения можно рассчитать по следующим формулам
k = 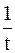

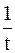
(при переходе от десятичного логарифма к натуральному).
t½ =
Второй отличительной особенностью реакций первого порядка является то, что t½ для них не зависит от начальной концентрации реагента, а определяется только константой скорости.
Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С, t (рис. 40). Математическое уравнение этой зависимости запишется следующим образом
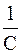
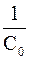
k = 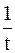
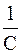
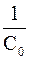
Период полупревращения реакций второго порядка обратно пропорционален начальной концентрации реагента
t½=
Это связано с тем, что скорость реакций второго порядка в сильной мере зависит от числа столкновений между молекулами реагирующих веществ в единицу времени, которое, в свою очередь, пропорционально числу молекул в единице объема, т.е. концентрации вещества. Таким образом, чем больше концентрация вещества в системе, тем чаще сталкиваются молекулы между собой и тем за меньший промежуток времени половина их успеет прореагировать.
Реакции третьего порядка, как уже было сказано ранее, встречаются крайне редко и не представляют практического интереса. Поэтому в связи с этим мы их не будем рассматривать.
Константа скорости реакции
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
См. также
Полезное
Смотреть что такое «Константа скорости реакции» в других словарях:
константа скорости реакции — – скорость химической реакции в условиях, когда произведение концентраций реагирующих веществ равно 1 моль/л. Общая химия : учебник / А. В. Жолнин [1] Константа скорости реакции – коэффициент пропорциональности в дифференциальном кинетическом… … Химические термины
константа скорости реакции — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN reaction constant … Справочник технического переводчика
константа скорости реакции — reakcijos greičio konstanta statusas T sritis chemija apibrėžtis Reakcijos, kurios reaguojančiųjų medžiagų koncentracijos lygios vienetui, greitis. atitikmenys: angl. rate constant; reaction constant rus. константа скорости реакции; удельная… … Chemijos terminų aiškinamasis žodynas
константа скорости реакции — reakcijos spartos konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Reakcijos, kurios reaguojančių medžiagų koncentracijos yra lygios vienetui, sparta. atitikmenys: angl. reaction rate constant vok. Reaktionskonstante, f rus.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
КОНСТАНТА СКОРОСТИ — химической реакции ее основная кинетическая характеристика; коэффициент пропорциональности в кинетическом уравнении, связывающем скорость реакции с концентрациями реагирующих веществ и их стехиометрическими коэффициентами. Для мономолекулярных… … Большой Энциклопедический словарь
константа скорости каталитической реакции — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN catalytic coefficient … Справочник технического переводчика
константа скорости — химическая реакции, её основная кинетическая характеристика; коэффициент пропорциональности в кинетическом уравнении, связывающем скорость реакции с концентрациями реагирующих веществ и их стехиометрическими коэффициентами. Для мономолекулярных… … Энциклопедический словарь
константа скорости химической реакции — [chemical reaction rate constant] изменение количества (концентрации) вещества, вступающего в реакцию или образующегося в ходе процесса, в единицу времени при данной температуре и концентрациях всех компонентов, равных единице: d[A]/dt =… … Энциклопедический словарь по металлургии
КОНСТАНТА СКОРОСТИ — хим. реакции, её основная кинетич. характеристика; коэф. пропорциональности в кинетич. ур нии, связывающем скорость реакции с концентрациями реагирующих в в и их стехиометрич. коэффициентами. Для мономолекулярных реакций К. с. имеет размерность с … Естествознание. Энциклопедический словарь
Константа скорости реакции
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
В зависимости от порядка реакции скорость реакции равна:
для порядков от 0 до 3:
[править] Зависимость скорости реакции от параметров активации
Зависимость скорости реакции от температуры, энтальпии активации и энтропии активации определяет ся следующим выражением для константы скорости реакции:
где Z — в первом приближении множитель, отражающий общее число столкновений между взаимодействующими частицами в единицу времени; T— абсолютная температура; R — молярная газовая постоянная; е — основание натуральных логарифмов, ΔH* — энтальпия активации, ΔS* — энтропия активации.
Из уравнения для k видно, что, поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры. Кроме того, чем больше энтальпия активации, тем значительнее влияние температуры на скорость реакции.
Что такое константа скорости химической реакции?
57.Как зависит скорость хим.реакции от температуры?Правило Вант-Гоффа,Уравнение Аррениуса.
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость большинства реакций изменяется в 2-4 раза.
Математически правило Вант-Гоффа выражается так:
γ-температурный коэффициент скорости реакции.
Значение γ для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2-4.
Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов.
Поскольку скорость реакции и константа скорости химической реакции прямопропорциональны, то выражение (3.6) часто записывают в следующем виде:
где k(T2), k(T1)- константы скорости реакции соответственно
при температурах T2 и T1;
Уравнение Аррениуса. В 1889 г. шведский ученый С. Арре-1иус на основании экспериментов вывел уравнение, которое на-звано его именем
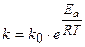
R-универсальная газовая постоянная, равная 8,314 Дж/моль×К.
В общем случае, если температура реакции изменяется от Т1 до Т2, уравнение (3.9) после логарифмирования примет вид:
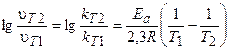
Это уравнение позволяет рассчитывать энергию активации реакции при изменении температуры от Т1 до Т2.
Скорость химических реакций возрастает в присутствии катализатора. Действие катализатора заключается в том, что он образует с реагентами неустойчивые промежуточные соединения (активированные комплексы), распад которых приводит к. образованию продуктов реакции. При этом энергия активации, понижается, и активными становятся молекулы, энергия которых была недостаточна для осуществления реакции в отсутствие, катализатора. В результате возрастает общее число активных£ молекул и увеличивается скорость реакции.
Изменение скорости реакции в присутствии катализатора выражается следующим уравнением:
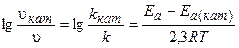
Скорость химической реакции
Говорить об осуществимости процесса можно по изменению энергии Гибсса системы. Но данная величина не отражает настоящую возможность протекания, механизм и скорость химической реакции.
Понятие скорости химической реакции
Для полноценного представления химической реакции, надо иметь знания о том, какие существуют временные закономерности при ее осуществлении, т.е. скорость химической реакции и ее детальный механизм.
Определение скорости химической реакции:
Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу времени
Скорость и механизм реакции изучает химическая кинетика – наука о химическом процессе.
С точки зрения химической кинетики, реакции можно классифицировать на простые и сложные.
Простые реакции – процессы, протекающие без образования промежуточных соединений. По количеству частиц, принимающих в ней участие, они делятся на мономолекулярные, бимолекулярные, тримолекулярные. Соударение большего чем 3 числа частиц маловероятно, поэтому тримолекулярные реакции достаточно редки, а четырехмолекулярные — неизвестны.
Сложные реакции – процессы, состоящие из нескольких элементарных реакций.
Любой процесс протекает с присущей ему скоростью, которую можно определить по изменениям, происходящим за некий отрезок времени.
Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t.
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
При постоянном объеме:
Единица измерения скорости реакции — моль/л·с
В целом, υ — величина постоянная и не зависит от того, за каким участвующим в реакции веществом, мы следим.
Зависимость концентрации реагента или продукта от времени протекания реакции представляют в виде кинетической кривой, которая имеет вид:
Вычислять υ из экспериментальных данных удобнее, если указанные выше выражения преобразовать в следующее выражение:
| υ = — ΔC/Δt [моль/л·с] | |
Закон действующих масс. Порядок и константа скорости реакции
Одна из формулировок закона действующих масс звучит следующим образом:
Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов.
Т.е. скорость прямой химической реакции зависит от концентраций исходных веществ.
Если исследуемый процесс представить в виде:
а А + b В = продукты
то скорость химической реакции можно выразить кинетическим уравнением:
а и b – стехиометрические коэффициенты простой реакции,
k – константа скорости реакции.
Химический смысл величины константы скорости реакции k — это скорость реакции при единичных концентрациях.
То есть, если концентрации веществ А и В равны 1, то υ = k.
Надо учитывать, что в сложных химических процессах коэффициенты а и b не совпадают со стехиометрическими.
Закон действующих масс выполняется при соблюдении ряда условий:
К сложным процессам закон действия масс применить нельзя!
Это можно объяснить тем, что сложный процесс состоит из нескольких элементарных стадий, и его скорость будет определяться не суммарной скоростью всех стадий, лишь одной самой медленной стадией, которая называется лимитирующей.
Каждая реакция имеет свой порядок. Определяют частный (парциальный) порядок по реагенту и общий (полный) порядок.
Например, в выражении скорости химической реакции для процесса
а А + b В = продукты
a – порядок по реагенту А
Для простых процессов порядок реакции указывает на количество реагирующих частиц (совпадает со стехиометрическими коэффициентами) и принимает целочисленные значения.
Для сложных процессов порядок реакции не совпадает со стехиометрическими коэффициентами и может быть любым.
Факторы, влияющие на скорость химической реакции
Определим факторы, влияющие на скорость химической реакции υ:
1. Зависимость скорости реакции от концентрации реагирующих веществ
определяется законом действующих масс:
Очевидно, что с увеличением концентраций реагирующих веществ, скорость реакции υ увеличивается, т.к. увеличивается число соударений между участвующими в химическом процессе веществами.
Причем, важно учитывать порядок реакции:
если это n = 1 по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества.
Если по какому-либо реагенту n = 2, то удвоение его концентрации приведет к росту скорости реакции в 2 2 = 4 раза.
А увеличение концентрации в 3 раза ускорит реакцию в 3 2 = 9 раз.
2. Зависимость скорости реакции от давления
Таким образом, изменение концентрации в системе, а следовательно и скорости реакции имеет прямую зависимость от изменения давления.
Например, для реакции первого порядка, увеличение давления в 2 раза вызовет рост концентрации вещества в 2 раза, что непременно изменит скорость реакции υ – она станет в 2 раза больше.
3. Зависимость скорости реакции от площади поверхности
Для гетерогенных реакций скорость реакции зависит от площади соприкосновения частиц:
Δn — изменение количества веществ, принимающих участие в реакции (исходных веществ или продуктов реакции), моль;
Δt — промежуток времени, с;
Единица измерения скорости гетерогенной реакции, моль/м 2 ⋅с.
Таким образом, вещества реагируют быстрее, если площадь поверхности, на которой может происходить взаимодействие веществ больше.
Растворяя вещество, мы уменьшаем его размеры до размеров молекулы, увеличивая тем самым площадь поверхности.
Поэтому химические процессы между веществами, находящимися в растворенном, жидком или газообразном состоянии имеют большую скорость, чем взаимодействия между твердыми веществами.
В этом случае, большое значение имеет строение электронной оболочки атома, тип химической связи и ее прочность в молекулах, структура вещества, прочность его кристаллической решетки.
Например, натрий будет активнее взаимодействовать с водой, чем олово. Поэтому и скорость взаимодействия натрия с водой выше скорости взаимодействия олова с водой.
5. Зависимость скорости реакции от температуры
определяется правилом Вант-Гоффа и уравнением Аррениуса
Повышая температуру, мы сообщаем молекулам дополнительную энергию (увеличивая, тем самым, энергию активации), которая способствует протеканию реакции.
Поэтому, при повышении температуры скорость химической реакции увеличивается.
Сванте Аррениус в 1889 году, изучая зависимость скорости реакции υ от температуры, установил, что большинство химических процессов подчиняются уравнению:
где k — константа скорости реакции
Еа -энергия активации – минимальная (критическая) энергия, необходимая для осуществления реакции, единица измерения Дж/моль
Т — абсолютная температура
R – газовая постоянная, R = 8,314 Дж/моль·град
A — предэкспоненциальный множитель (частотный фактор), единица измерения совпадает с k. Эта константа выражает вероятность того, что при столкновении молекулы будут ориентированы так, чтобы взаимодействие было возможно.
Если известна константа скорости k при одной температуре Т1, а требуется найти константу скорости k при некой другой температуре Т2, то это легко сделать, если взять логарифм уравнения Аррениуса при Т1 и Т2:
Вычитая второе равенство из первого, получаем:
Если принять, что концентрации веществ А и В постоянны и прологарифмировать данное выражение, то получим следующее выражение:
Правило Вант-Гоффа
Также удобно пользоваться эмпирическим правилом, которое сформулировал Якоб Вант-Гофф:
увеличение температуры на каждые 10 градусов, приводит к росту скорости реакции в 2 – 4 раза.
Правило Вант-Гоффа имеет математическое выражение:
γ — температурный коэффициент реакции, значения которого лежат в интервале от 2 до 4.
Приведем пример применения правила Вант-Гоффа.
υT1/υT2 = 3 2 = 9. Это означает, что υ возросла в 9 раз.
6. Зависимость скорости реакции от присутствия катализатора
Катализ – это любое изменение скорости реакции под действием катализатора. Он может быть положительным и отрицательным. Суть катализа – генерирование активного субстрата или реагента с участием катализаторов.
Катализатор представляет собой вещество, которое селективно ускоряет химическую реакцию, вступая при этом в промежуточную стадию, но регенирируясь к ее концу (к моменту образования конечных продуктов). Например, в биохимической среде в качестве катализаторов выступают ферменты.
Если такое вещество замедляет химическую реакцию, то оно называется ингибитором.
Влияние катализатора на скорость реакции основывается на том, что он изменяет энергию активации Еа. Понижение энергии активации под действием катализатора схематично представлено на рисунке ниже:
Видно, что веществам А и В требуется большое количество энергии, чтобы образовать конечные продукты. Но в присутствии катализатора для получения конечных продуктов требуется гораздо меньше энергии, т.к. идет понижение полной энергии активации, и тем самым, увеличение скорости реакции.
Обращаю ваше внимание на то, что энергии как начальных, так и конечных веществ остаются одинаковыми в обеих реакциях.