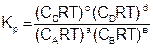в чем измеряется константа равновесия
Химическое равновесие
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Константа химического равновесия



Рассмотрим обратимую химическую реакцию общего вида, в которой все вещества находятся в одном агрегатном состоянии, например, жидком:
где A и B – исходные вещества прямой реакции; C и D – продукты прямой реакции; а, в, с, и d – стехиометрические коэффициенты.
В начальный момент времени, когда концентрация веществ A и B наибольшая, скорость прямой реакции также будет наибольшей и по закону действующих масс равна
где k1 – константа скорости прямой реакции.
С течением времени концентрация веществ A и B уменьшается, а, следовательно, уменьшается и скорость прямой реакции.
В начальный момент времени концентрация веществ C и D равна нулю, а, следовательно, и скорость обратной реакции равна нулю, с течением времени концентрация веществ C и D возрастает, а, следовательно, возрастает и скорость обратной реакции и она будет равна
где k2 – константа скорости обратной реакции.
В момент достижения равновесия, концентрации принимают значение равновесных, а скорости равны между собой uпр = uобр, следовательно
Перенесем константы скорости в одну сторону, а концентрации в другую:
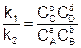
Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия:
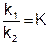
Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Величина константы равновесия зависит от природы реагирующих веществ и температуры, и не зависит от концентрации в момент равновесия, поскольку их отношение – всегда величина постоянная, численно равная константе равновесия. Если гомогенная реакция идет между веществами в растворе, то константа равновесия обозначается KС, а если между газами, то KР.
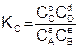
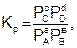
где РС, РD, РА и РВ – равновесные давления участников реакции.
Перенесем объем в правую сторону
р = 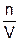
Подставим уравнение (6.9) в (6.7), для каждого реагента и упростим
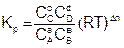
где Dn – изменение числа молей газообразных участников реакции
Dn = (с + d) – (а + в) (6.11)
Из уравнения (6.12) видно, что KР = КС, если не меняется количество молей газообразных участников реакции (Dn = 0) или газы в системе отсутствуют.
Необходимо отметить, что в случае гетерогенного процесса концентрацию твердой или жидкой фазы в системе не учитывают.
Например, константа равновесия для реакции вида 2А + 3В = С + 4D, при условии, что все вещества газы и имеет вид
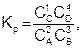
а если D – твердое, то
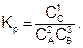
Константа равновесия имеет большое теоретическое и практическое значение. Численное значение константы равновесия позволяет судить о практической возможности и глубине протекания химической реакции.
Зная константу равновесия, можно определить состав реакционной смеси в момент равновесия и рассчитать константу выхода продуктов реакции. Константу равновесия можно определить, используя экспериментальные методы, анализируя количественный состав реакционной смеси в момент равновесия, или применяя теоретические расчеты. Для многих реакций при стандартных условиях константа равновесия – это табличная величина.
6.3. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
При внешнем воздействии на систему происходит смещение химического равновесия, т. е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Если в результате внешнего воздействия увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если вследствие внешнего воздействия увеличиваются равновесные концентрации исходных веществ, то говорят о смещении равновесия влево (в сторону обратной реакции).
Влияние различных факторов на смещение химического равновесия отражает принцип Ле-Шателье (1884): если на систему, находящуюся в устойчивом химическом равновесии воздействовать извне, изменяя температуру, давление или концентрацию, то химическое равновесие смещается в том направлении, при котором эффект произведенного воздействия уменьшается.
Необходимо отметить, что катализатор не смещает химическое равновесие, а только ускоряет его наступление.
Рассмотрим влияние каждого фактора на смещение химического равновесия для реакции общего вида:
Влияние изменения концентрации. Согласно принципу Ле-Шателье, увеличение концентрации одного из компонентов равновесной химической реакции приводит к сдвигу равновесия в сторону усиления той реакции, при которой происходит химическая переработка этого компонента. И наоборот, уменьшение концентрации одного из компонентов приводит к сдвигу равновесия в сторону образования этого компонента.
Таким образом, увеличение концентрации вещества А или В смещает равновесие в прямом направлении; увеличение концентрации вещества С или D смещает равновесие в обратном направлении; уменьшение концентрации А или В смещает равновесие в обратном направлении; уменьшение концентрации вещества С или D смещает равновесие в прямом направлении. (Схематично можно записать: CАили CВ ®; CСили CD ¬; ¯ CАили CВ ¬; ¯ CСили CD ®).
Влияние температуры. Общее правило, определяющее влияние температуры на равновесие, имеет следующую формулировку: повышение температуры способствует сдвигу равновесия в сторону эндотермической реакции (- Q); понижение температуры способствует сдвигу равновесия в сторону экзотермической реакции (+ Q).
Реакции, протекающие без тепловых эффектов, не смещают химического равновесия при изменении температуры. Повышение температуры в этом случае приводит лишь к более быстрому установлению равновесия, которое было бы достигнуто в данной системе и без нагревания, но за более длительное время.
Влияние давления. Как показывает опыт, давление оказывает заметное влияние на смещение только тех равновесных реакций, в которых участвуют газообразные вещества, и при этом изменение числа молей газообразных участников реакции (Dn) не равно нулю. При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, а при понижении давления – в сторону образования большего количества молей газообразных веществ.
Таким образом, если Dn = 0, то давление не влияет на смещение химического равновесия; если Dn 0, то увеличение давления смещает равновесие в обратном направлении, а уменьшение давления – в сторону прямой реакции. (Схематично можно записать: при Dn = 0 Р не влияет; при Dn 0 Р ¬, ¯Р ®). Принцип Ле-Шателье применим как к гомогенным, так и к гетерогенным системам и дает качественную характеристику сдвига равновесия.
Константа равновесия
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Содержание
Способы выражения константы равновесия
Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давления компонентов pi по формуле [1] :
Например, для реакции окисления монооксида углерода:
константа равновесия может быть рассчитана по уравнению:
Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид:
Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:

где Δn — изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ (

Стандартная константа равновесия
Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии 



Стандартная константа равновесия — безразмерная величина. Она связана с Kp соотношением:
Видно, что если 


Для реакции в смеси реальных газов в стандартном начальном состоянии парциальные фугитивности газов принимаются равными их парциальным давлениям 

Константа равновесия реакций в гетерогенных системах
Для гетерогенной химической реакции, например, между компонентами реального газа и реального раствора, константа равновесия в общем случае может быть выражена уравнением:

Если конденсированные фазы (твёрдые или жидкие) представляют собой практически чистые вещества, их активности постоянны и могут быть включены в константу равновесия (то есть в левую часть выражения выше). Условно можно принять их равными единице и, таким образом, исключить из выражения.
Например, для реакции твёрдофазного восстановления оксида железа:
константа равновесия (при условии, что газовая фаза идеальна) имеет вид:
Константа равновесия и изменение энергии Гиббса
Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (ΔGT) может быть рассчитана по уравнению:


Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при 





Стандартная константа равновесия связана со стандартной энергией Гиббса реакции соотношением:
Стандартная энергия Гиббса реакции в газовой смеси — энергия Гиббса реакции при стандартных парциальных давлениях всех компонентов, равных 0,1013 МПа (1 атм).
Стандартная энергия Гиббса реакции в растворе — энергия Гиббса при стандартном состоянии раствора, за которое принимают гипотетический раствор со свойствами предельно разбавленного раствора, но с концентрацией всех реагентов, равной единице. Величина стандартной энергии Гиббса реакции может быть использована для приближенной оценки термодинамической возможности протекания реакции в данном направлении, если начальные условия не сильно отличаются от стандартных. Кроме того, сравнивая величины стандартной энергии Гиббса нескольких реакций, можно выбрать наиболее предпочтительные, для которых 
Зависимость константы равновесия от температуры
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):
и изохоры химической реакции (изохоры Вант-Гоффа):
Здесь 



Константа равновесия и константа скорости реакции
Для обратимой химической реакции константа равновесия может быть выражена через константы скорости прямых и обратных реакций, исходя из того факта, что в состоянии равновесия скорости прямой и обратной реакций равны. Например, для элементарной обратимой химической реакции первого порядка

Методы расчета константы равновесия
Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG 0 ), а затем использованию формулы:


При этом следует помнить, что энергия Гиббса — функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт ΔG 0 для некоторой реакции по каким-либо причинам затруднены, можно подобрать такие промежуточные реакции, для которых ΔG 0 известно или может быть легко определено, и суммирование которых даст рассматриваемую реакцию (см. Закон Гесса). В частности, в качестве таких промежуточных реакций часто используют реакции образования соединений из элементов.
Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
или, соответственно, для стандартного изменения энергии Гиббса:
Здесь ΔH 0 при постоянных давлении и температуре равно тепловому эффекту реакции, методы расчёта и экспериментального определения которого известны — см., например, уравнение Кирхгофа:
Необходимо получить изменение энтропии в ходе реакции. Эта задача может быть решена несколькими способами, например:
Итак, если извеcтны 


Несколько упрощённый вариант этой формулы получают, считая сумму теплоёмкостей веществ не зависящей от температуры и равной сумме теплоёмкостей при 298 K:
И еще более упрощённый расчёт проводят, приравнивая сумму теплоёмкостей к нулю:
Переход от 
Расчёт константы равновесия методами статистической термодинамики
Экспериментальное определение константы равновесия
См. также
Примечания
Литература
Полезное
Смотреть что такое «Константа равновесия» в других словарях:
константа равновесия — – отношение констант скоростей прямой и обратной реакций. Общая химия : учебник / А. В. Жолнин [1] Константа равновесия – отношение произведения равновесных активностей продуктов, какой либо реакции, взятых в степенях их стехиометрических… … Химические термины
КОНСТАНТА РАВНОВЕСИЯ — КОНСТАНТА РАВНОВЕСИЯ, отношение между концентрациями продуктов реакции и исходных веществ, которое характеризует ХИМИЧЕСКОЕ РАВНОВЕСИЕ ОБРАТИМОЙ РЕАКЦИИ при определенной температуре … Научно-технический энциклопедический словарь
константа равновесия — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN equilibrium constant … Справочник технического переводчика
константа равновесия — [equilibrium constant] отношение концентраций продуктов реакций к концентрациям исходных веществ, взятых в степенях равных стехиометрических коэффициенту реакции; в растворах концентрации заменются активностями. Для газообразных веществ… … Энциклопедический словарь по металлургии
КОНСТАНТА РАВНОВЕСИЯ — (от лат. constans, род. падеж constantis постоянный, неизменный), величина, определяющая для данной хим. р ции соотношение между термодинамич. активностями исходных в в и продуктов в состоянии хим. равновесия. В общем случае р ции где vi и v j… … Химическая энциклопедия
константа равновесия — химическая реакции, величина, определяющая соотношение между термодинамическими активностями (концентрациями) исходных веществ и продуктов в состоянии химического равновесия. Является выражением закона действующих масс. Константа равновесия… … Энциклопедический словарь
константа равновесия — pusiausvyros faktorius statusas T sritis Standartizacija ir metrologija apibrėžtis Pusiausvirojo lygiaverčio aktyvumo ir radono tūrinio aktyvumo dalmuo. atitikmenys: angl. equilibrium factor vok. Gleichgewichtskonstante, f rus. константа… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
константа равновесия — pusiausvyros faktorius statusas T sritis fizika atitikmenys: angl. equilibrium factor vok. Gleichgewichtskonstante, f rus. константа равновесия, f; фактор равновесия, m pranc. facteur d’équilibre, m … Fizikos terminų žodynas
константа равновесия — pusiausvyros konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Reakcijos produktų ir reaguojančių medžiagų pusiausvirųjų koncentracijų sandaugų dalmuo. atitikmenys: angl. equilibrium constant vok. Gleichgewichtskonstante, f… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
константа равновесия — pusiausvyros konstanta statusas T sritis chemija apibrėžtis Reakcijos produktų ir reaguojančiųjų medžiagų pusiausvirųjų koncentracijų sandaugų santykis. atitikmenys: angl. equilibrium constant rus. константа равновесия … Chemijos terminų aiškinamasis žodynas