в чем измеряется изотонический коэффициент
Коллигативные свойства растворов
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К коллигативным свойствам растворов относятся:
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давления паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу.
Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку:
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
При этом принимаем, что χв-ва + χр-ль= 1
Изотонический коэффициент Вант-Гоффа
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе.
То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации). Второй закон Рауля
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления.
При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя.
Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля:
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
Осмотическое давление раствора
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида.
Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию.
Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением.
Осмотическое давление и концентрацию раствора неэлектролита позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими.
Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
Изотонический коэффициент в растворах электролитов и неэлектролитов
В данной статье будет рассмотрено понятие изотонического коэффициента Вант-Гоффа, его значение в неорганичекой химии. Будет названа его формула и перечислены различные составные данной величины, определяющей принципы действий каких-либо веществ при смешивании друг с другом и добавлении в растворы. А также упомянуты будут значение физического характера и воздействия факторов внешних условий на значение этой коэффициента.
Знакомство с понятием
Изотонический коэффициент, иногда называемый фактором Вант-Гоффа, является параметром безразмерной величины, который дает исчерпывающую характеристику поведения любых веществ в растворе. В численном выражении он равен значению некоторой составной свойства коллигативного раствора конкретного исследуемого соединения к явлению такой же коллигативной характеристики неэлектролитического раствора, имеющего ту же концентрацию и неизменные системные или иные параметры.
Такое понятие, как изотонический коэффициент, ввел в XIX веке Якоб Вант-Гофф, за что позже был удостоен Нобелевской премии по химии. Также этим ученым было введено в науку правило, названное его именем.
Суть коэффициента
Оба коллигативных параметра дают четкую характеристику данного параметра и четко определяют его смысл и суть. Зависят же эти характеристики от концентрации частичек вещества, которое было растворено, в самом растворе. Молекулы неэлектролитов, все по отдельности, образуют только по одной частичке в созданном растворе, а объясняется это тем, что процесс диссоциации неэлектролитов в растворе не происходит.
В тоже время влияние сольватации принуждает электролиты в р-ре целиком или частично распадаться на катионы и анионы, создавая в ходе этого процесса несколько частичек на единичную молекулу, подвергшуюся диссоциации. Из этого следует, что аддитивная величина или, иными словами, свойства коллигативного характера исследуемого р-ра, будут зависеть от количества содержащихся ионов всех типов в нем. Такие ионы будут частицами, что образовались в р-ре в результате протекания диссоциации изначально содержащихся молекул. Данный р-р представляется в виде смеси р-ров, составленных из каждого, отдельного типа частичек.
Примером тому служит р-р извести хлорной, содержащий 3 вида частиц – гипохлориты анионов, хлоридные анионы и катионы кальция. В общем понимании изотонический коэффициент Вант Гоффа позволяет нам узнать, на сколько же частичек находящихся в р-ре электролита, больше, чем в растворе неэлектролита, имеющего аналогичные показатели концентрации. Связан этот к-т со свойством вещества, распадающегося в р-ре, образовывать различного рода катионы и анионы, то есть он показывает степень происходящей диссоциации.
В случае, когда молекула или формульная единица заключает в себе n ионов либо атомов в р-рах с полярным типом связи, количество изначально взятых молекул будет равно N, в свою очередь α будет указывать уровень проявления диссоциации в соединении, и из этого понятно, что N·α. Таким образом, суммарная величина частичек в р-ре вычисляется по формуле – ((N – N·α) + N·α·n).
Нахождение в сильных электролитических растворах
Сильные электролиты в результате диссоциации распадаются практически на 100%, и из-за этого можно решить что, изотонический к-т будет равняться ионному количеству на одну формульную единицу или молекулу, но это не так. В реальности показатель будет меньше того, что был определен по формуле. Данное явление объясняется теорией сильных электролитов, созданной П. Дебаем совместно с Э. Хюккелем в 1923 году. Из этой теории следует, что движение ионов в р-ре будет затрудняться вследствие образования оболочки сольватации. К этому добавляем фактор взаимодействия ионов друг с другом, ведь разноименные частицы будут притягиваться, а одноименные – отталкиваться. Таким образом, взаимное притяжение создаст группы ионов, которые будут передвигаться в толще р-ра друг с другом. Группы таких ионов называются ассоциативными, или парными. В результате такого явления р-р начинает себя вести, словно он содержит меньшее количество частичек, чем есть на самом деле, что объясняется ограничением свободы их перемещения.
Физическая роль коэффициента
К-т Вант-Гоффа кроет в себе значение не только для химии. Физический смысл изотонического коэффициента заключен в учете увеличения количества частичек в р-ре электролитического характера по сравнению с р-ром неэлектролитической природы и аналогичного уровня концентрации.
Внешнее влияние на значение коэффициента
Изотонический коэффициент может изменяться под влиянием факторов различной природы внешнего характера. Например, ионное взаимодействие будет уменьшаться, если температуру раствора повысить (связано с возрастанием теплового движения частиц), или уменьшить концентрацию заряженных частиц путем разбавления р-ра (вследствие уменьшения шанса встречи пары частиц). Если мы будем экстраполировать уровень разбавления, приближая его к бесконечности, то увидим что к-т i пытается набрать свое максимальное значение, которое определяется при помощи формулы растворенных соединений.
Заключение
Итак, мы видим что данная безразмерная величина, представленная в виде изотонического к-та, является характеристикой растворов, а именно: объясняет суть того или иного поведения вещества в растворе, позволяет определять степень диссоциации растворов электролитической и неэлектролитической природы и делать расчет соотношения частичек (ионов) в подобных растворах в сравнении друг с другом.
Изотонический коэффициент
Содержание:
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 17.05.2019 |
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
Посмотрите похожие темы возможно они вам могут быть полезны:
Введение:
Суть процесса
Феномен осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворенных веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми мембранами являются те, которые обладают достаточно высокой проницаемостью не для всех, а только для некоторых веществ, в частности, для растворителя. (Подвижность растворенных веществ в мембране стремится к нулю). Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку некоторые его молекулы заменяются молекулами растворенного вещества. Как следствие, переходы частиц растворителя из секции, содержащей чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объем раствора будет увеличиваться (и концентрация вещества будет уменьшаться), тогда как объем растворителя будет соответственно уменьшаться.
В тех случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворенных веществ, перенос последнего из раствора в растворитель позволяет проводить диализ, который используется в качестве метода очистки полимеров и коллоидных систем от низкомолекулярных примесей, таких как как электролиты.
Значение осмоса
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальные клетки крови, проницаема только для молекул воды, кислорода, некоторых питательных веществ, растворенных в крови, и продуктов жизнедеятельности клеток; для больших молекул белка в растворенном состоянии внутри клетки это непроницаемо. Следовательно, белки, которые так важны для биологических процессов, остаются внутри клетки.
Осмос участвует в транспортировке питательных веществ в стволах высоких деревьев, где капиллярный транспорт не может выполнять эту функцию.
Осмос широко используется в лабораторных технологиях: при определении молярных характеристик полимеров, концентрирующих растворов и при изучении различных биологических структур. Осмотические явления иногда используются в промышленности, например, при производстве определенных полимерных материалов, очистке высокосоленой воды методом обратного осмоса жидкостей.
Осмос также играет важную роль в экологии водоемов. Если концентрация соли и других веществ в воде повышается или падает, обитатели этих вод погибнут из-за вредного воздействия осмоса.
Промышленное использование
Первая в мире электростанция, использующая осмос для выработки электроэнергии, была открыта 24 ноября 2009 года в Норвегии. Соленая морская вода и пресная вода в силовой установке разделены мембраной; Поскольку концентрация солей в морской воде выше, между соленой и пресной водой развивается явление осмоса, в результате чего давление соленой воды самопроизвольно возрастает. Поскольку давление соленой воды, подвергшейся осмосу, превышает атмосферное давление, возникает мощный поток воды, который приводит в движение турбину, которая генерирует энергию
Осмотическое давление неэлектролитов
Закон Вант Хоффа
Пленки из целлофана, коллодия и т. д. Используются в качестве полупроницаемых мембран.
Для разбавленных растворов неэлектролитов зависимость осмотического давления от концентрации и температуры раствора выражается уравнением Вант-Хоффа.
Онкотическое давление
Осмотическое давление электролитов
Осмотическое давление (обозначаемое р) представляет собой избыточное гидростатическое давление в растворе, отделенном от чистого растворителя полупроницаемой мембраной, при которой диффузия растворителя через мембрану прекращается. Это давление имеет тенденцию выравнивать концентрации обоих растворов из-за встречной диффузии молекул растворенного вещества и растворителя.
Если такой раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. По этой причине препараты, предназначенные для введения в кровь, растворяются в изотоническом растворе, содержащем столько хлорида натрия (поваренной соли), сколько необходимо для уравновешивания осмотического давления, создаваемого клеточной жидкостью. Если инъекционные препараты были сделаны в воде или в сильно сильно разбавленном (гипотоническом по отношению к цитоплазме) растворе, осмотическое давление, заставляющее воду проникать в клетки крови, привело бы к их разрыву. Однако, если в кровь будет введен слишком концентрированный раствор хлорида натрия (3-5-10%, гипертонические растворы), то вода из клеток выйдет, и они сократятся. В случае растительных клеток протопласт отделяется от клеточной мембраны, что называется плазмолизом. Обратный процесс, который происходит, когда сжатые клетки помещают в более разбавленный раствор, представляет собой, соответственно, деплазмолиз.
Величина осмотического давления, создаваемого раствором, зависит от количества, а не от химической природы растворенных в нем веществ (или ионов, если молекулы вещества диссоциируют), поэтому осмотическое давление является коллигативным свойством решение. Чем выше концентрация вещества в растворе, тем больше создается осмотическое давление. Это правило, называемое законом осмотического давления, выражается простой формулой, очень похожей на определенный закон идеального газа.
Это также показывает сходство свойств частиц растворенного вещества в вязкой среде растворителя с частицами идеального газа в воздухе. Обоснованность этой точки зрения подтверждается экспериментами Дж. Б. Перрина (1906): распределение частиц эмульсии смолы гуммигута в толще воды в целом подчинялось закону Больцмана.
Закон осмотического давления может быть использован для расчета молекулярной массы данного вещества (с известными дополнительными данными).
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается как i) является безразмерным параметром, характеризующим поведение вещества в растворе. Численно оно равно отношению значения определенного коллигативного свойства раствора данного вещества и значения этого же коллигативного свойства неэлектролита той же концентрации с другими параметрами системы без изменений.
Под прямым воздействием этих растворов на ткани из-за разницы осмотического давления в системе раствор-ткань вода попадает в клетки, в результате чего клетки и ткани набухают. При введении в сосуды Г. р. может вызвать гемолиз эритроцитов. В связи с этим при необходимости внутривенное введение Г. р. предварительно определяют осмотическую резистентность эритроцитов. Проглатывание Г. р. вызвать увеличение выработки мочи. В мед. практика Г. р. имеют ограниченное использование. Итак, Г. р. хлорид натрия (0,6%) иногда используется для приготовления растворов местных анестетиков с целью уменьшения всасывания последних в кровь.
Гипертонические растворы, растворы, осмотическое давление которых выше, чем осмотическое давление в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и гипертонический для одних клеток раствор может оказаться изотоническим или даже гипотоническим для других. Когда растительные клетки погружаются в гипертонический раствор, он высасывает воду из клеток, которые уменьшаются в объеме, а затем дальнейшее сжатие прекращается, и протоплазма отстает от клеточных стенок (см. Плазмолиз). Эритроциты крови человека и животных в гипертонических растворах также теряют воду и уменьшаются в объеме. Гипертонические растворы в сочетании с гипотоническими и изотоническими растворами используются для измерения осмотического давления в живых клетках и тканях.
Изотонический коэффициент. Законы Рауля Вант Хоффа для электролитов
Растворы электролита проводят электрический ток за счет самопроизвольного распада (диссоциации) электролита на заряженные ионы (катионы и анионы). Процесс разложения веществ на ионы называется электролитической диссоциацией. Количественно процесс диссоциации характеризуется следующими значениями: изотонический коэффициент i, эквивалентная электропроводность , степень диссоциации , константа электролитической диссоциации Kdiss.
Изотонический коэффициент или коэффициент Вант-Хоффа (i) представляет собой отношение суммы числа ионов и недиссоциированных молекул электролита к начальному количеству молекул электролита; Степень электролитической диссоциации рассчитывается по ее значению:
Первый закон Рауля выражает зависимость относительного снижения давления насыщенного пара растворителя от концентрации раствора неэлектролита. Относительное снижение давления насыщенных паров растворителя над раствором нелетучих веществ равно молярной доле растворенного вещества.
Второй закон Рауля определяет зависимость точек кристаллизации и кипения раствора от концентрации растворенного вещества: повышение температуры кипения и понижение температуры кристаллизации разбавленных идеальных растворов пропорционально молярной концентрации растворенного вещества.
Ван Гофф Лоу. Осмотическое давление раствора равно давлению газа, которое было бы произведено растворенным веществом, если бы оно находилось в газообразном состоянии и занимало объем, равный объему раствора.
Вывод:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Изотонический коэффициент
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:


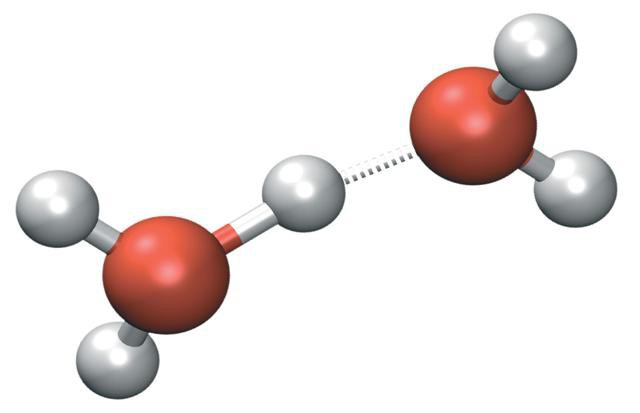




 .
. , где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.
, где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.