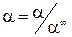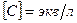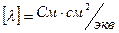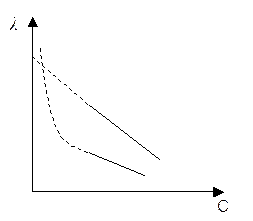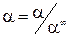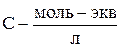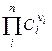в чем измеряется эквивалентная электропроводность
эквивалентная электропроводность
Смотреть что такое «эквивалентная электропроводность» в других словарях:
ЭКВИВАЛЕНТНАЯ ЭЛЕКТРОПРОВОДНОСТЬ — величина, характеризующая электрическую проводимость электролитов. Эквивалентная электропроводность определяется проводимостью всех ионов, образующихся из количества электролита, соотвeтствующего его химическому эквиваленту, в растворе данной… … Большой Энциклопедический словарь
ЭКВИВАЛЕНТНАЯ ЭЛЕКТРОПРОВОДНОСТЬ — величина, характеризующая электрич. проводимость электролитов. Э.э. определяется проводимостью всех ионов, образующихся из кол ва электролита, соответствующего его хим. эквиваленту, в р ре данной концентрации. Наиб. Э. э. соответствует предельно… … Естествознание. Энциклопедический словарь
ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ — способность электролитов проводить электрич. ток при приложении электрич. напряжения. Носителями тока являются положительно и отрицательно заряженные ионы катионы и анионы, к рые существуют в р ре вследствие электролитич. диссоциации. Ионная Э. э … Химическая энциклопедия
Электропроводность электролитов — обусловлена наличием в них положительных и отрицательных ионов (катионов и анионов). Доли общего количества электричества, переносимого катионами и анионами, называются переноса числами (См. Переноса число). Э. э. количественно… … Большая советская энциклопедия
Электропроводность (биол.) — Электропроводность биологических систем, обусловлена наличием в них ионов и подвижных полярных молекул. Биологическая ткань состоит из клеток и межклеточного пространства, заполненного веществом ‒ электролитом с удельным сопротивлением около 100… … Большая советская энциклопедия
эквивалентная удельная электропроводность — ekvivalentinis savitasis elektrinis laidis statusas T sritis Standartizacija ir metrologija apibrėžtis Ekvivalentinės elektrinės grandinės savitasis laidis. atitikmenys: angl. equivalent electric conductivity vok.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
эквивалентная удельная электропроводность — ekvivalentinis savitasis elektrinis laidis statusas T sritis fizika atitikmenys: angl. equivalent electric conductivity vok. Äquivalentelektrischeleitfähigkeit, f rus. эквивалентная удельная электропроводность, f pranc. conductivité électrique… … Fizikos terminų žodynas
Электропроводность — I Электропроводность электрическая проводимость, проводимость, способность тела пропускать Электрический ток под воздействием электрического поля, а также физическая величина, количественно характеризующая эту способность. Тела,… … Большая советская энциклопедия
Эквивалентная электропроводность растворов электролитов



Хотя для понимания свойств электролитов удельная электропроводность представляет собой малоудобную величину, зато ее можно измерить непосредственно и затем пересчитать в эквивалентную электропроводность λ.
Эквивалентная электропроводность представляет собой электропроводность такого объёма раствора V (см 3 ), который содержит 1 моль-экв растворенного вещества и заключён между двумя параллельными электродами соответствующей площади, находящихся на расстоянии в 1 см друг от друга:
Электропроводность электролита объема V складывается из суммы удельных электропроводностей æi, которые соответствуют каждому отдельному единичному объему. Таких единичных объемов будет V, следовательно
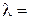
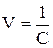
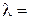
где С – концентрация раствора (моль-экв/см 3 ).
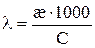
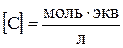
Электропроводность с ростом температуры увеличивается, это в основном связано в основном с увеличением подвижности ионов. Обычно при повышении температуры на 1 К электропроводность увеличивается на 1,5 – 2%.
Предельная электропроводность λ ∞ соответствует электропроводности бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами.
Из уравнений (11) и (12) следует, что
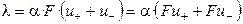
Произведение числа Фарадея на абсолютную скорость движения иона называют подвижностью иона:
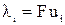
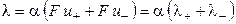
При бесконечном разведении (α = 1) и из выражения (15) получаем
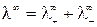
где 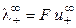
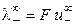
Величина предельной эквивалентной электропроводности бесконечно разбавленного раствора электролита представляет собой сумму двух независимых слагаемых, каждое из которых соответствует определенному виду ионов. Это соотношение установлено Кольраушем и называется законом независимого движения ионов (законом Кольрауша):
Эквивалентная электропроводность при бесконечном разведении равна сумме предельных подвижностей ионов.
Сущность этого закона состоит в следующем: в предельно разбавленном растворе электролита катионы и анионы переносят ток независимо друг от друга.
Для сильных электролитов, диссоциирующих полностью, рассчитывают коэффициент электропроводности:
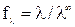
который учитывает влияние электростатического взаимодействия ионов на скорость их движения.
Для связи электролитов рассчитывают степень диссоциации
æ
æ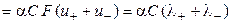
Отметим, что в современной научной и учебной литературе используется также понятие молярной электропроводности λm, которую легко связать с величиной λ, зная количество моль эквивалентов (Z) в 1 моле вещества:
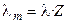
Экспериментально было установлено, что для сильных электролитов зависимость эквивалентной электропроводности от 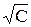
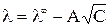
A – постоянная, зависящая от диэлектрической проницаемости и температуры. Экстраполяция значений 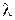
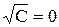
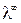
 |
Эквивалентная электропроводность
(современное название: молярная)
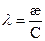
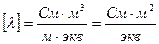
Часто употребляется другая формула: 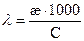
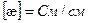
Физический смысл эквивалентной электропроводности: эквивалентная электропроводность численно равна электропроводности раствора, помещенного между электродами, находящимися на расстоянии 1м, и содержащего 1экв. электролита.
Эквивалентная электропроводимость отнесена к определенному числу молекул, введенных в раствор (NA/Z).
Формула эквивалентной электропроводимости: 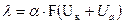
График эквивалентной электропроводности:
Эквивалентная электропроводность с увеличением концентрации уменьшается. Для слабого электролита это объясняется уменьшением степени диссоциации. Для сильного электролита – уменьшением скорости движения электронов вследствие эффектов релаксации и катафоретического (электрофоретического).
Эффект релаксации (асимметрии):
Каждый ион создает вокруг себя «ионную атмосферу», состоящую из ионов противоположного знака заряда. При движении иона он выходит из этого окружения, затем оно создается в новом месте. Это происходит не мгновенно, поэтому позади иона концентрация ионов с противоположным знаком заряда больше, чем впереди. Это тормозит движение иона.
«Ионная атмосфера» сама движется в противоположную сторону вместе с сольватирующими молекулами среды. Это создает дополнительное торможение иона со стороны среды.
Математическая зависимость эквивалентной электропроводности от концентрации экспериментально получена Кольраушем и теоретически обоснована Онзагером.
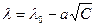
где λ0 – предельная эквивалентная электропроводность; λ→λ0 при С→0;
а – постоянная, независящая от концентрации.
График этой зависимости представляет собой прямую линию для сильных электролитов.
Предельная эквивалентная электропроводимость обладает свойством аддитивности:
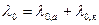
здесь λ0,а, λ0,к – это предельные ионные электропроводимости (подвижности).
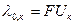
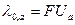
Предельную эквивалентную электропроводимость можно рассчитать двумя способами:
Измерив эквивалентную электропроводность электролита, можно рассчитать степень диссоциации слабого электролита или скорость движения ионов сильного электролита.
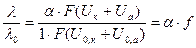
где 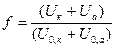
Для слабого электролита 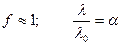
Для сильного электролита 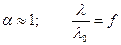
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Эквивалентная электропроводность растворов электролитов
Хотя для понимания свойств электролитов удельная электропроводность представляет собой малоудобную величину, зато ее можно измерить непосредственно и затем пересчитать в эквивалентную электропроводность λ.
Эквивалентная электропроводность представляет собой электропроводность такого объёма раствора V (см 3 ), который содержит 1 моль-экв растворенного вещества и заключён между двумя параллельными электродами соответствующей площади, находящихся на расстоянии в 1 см друг от друга:
Электропроводность электролита объема V складывается из суммы удельных электропроводностей æi, которые соответствуют каждому отдельному единичному объему. Таких единичных объемов будет V, следовательно
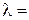
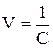
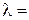
где С – концентрация раствора (моль-экв/см 3 ).
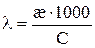
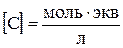
Электропроводность с ростом температуры увеличивается, это в основном связано в основном с увеличением подвижности ионов. Обычно при повышении температуры на 1 К электропроводность увеличивается на 1,5 – 2%.
Предельная электропроводность λ ∞ соответствует электропроводности бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами.
Из уравнений (11) и (12) следует, что

Произведение числа Фарадея на абсолютную скорость движения иона называют подвижностью иона:
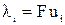
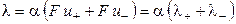
где λ+ и λ‑ ‑ подвижности катиона и аниона соответственно.
При бесконечном разведении (α = 1) и из выражения (15) получаем
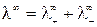
где 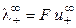
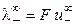
Величина предельной эквивалентной электропроводности бесконечно разбавленного раствора электролита представляет собой сумму двух независимых слагаемых, каждое из которых соответствует определенному виду ионов. Это соотношение установлено Кольраушем и называется законом независимого движения ионов (законом Кольрауша):
Эквивалентная электропроводность при бесконечном разведении равна сумме предельных подвижностей ионов.
Сущность этого закона состоит в следующем: в предельно разбавленном растворе электролита катионы и анионы переносят ток независимо друг от друга.
Для сильных электролитов, диссоциирующих полностью, рассчитывают 
коэффициент электропроводности:
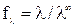
который учитывает влияние электростатического взаимодействия ионов на скорость их движения.
Для связи электролитов рассчитывают степень диссоциации
С учётом нового понятия ‑ подвижность иона ‑ для удельной электропроводности можно записать:
æ 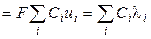
æ 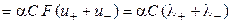
Отметим, что в современной научной и учебной литературе используется также понятие молярной электропроводности λm, которую легко связать с величиной λ, зная количество моль-эквивалентов (Z) в 1 моле вещества:
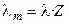
Экспериментально было установлено, что для сильных электролитов зависимость эквивалентной электропроводности от 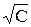
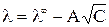
A – постоянная, зависящая от диэлектрической проницаемости и температуры. Экстраполяция значений 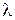
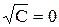
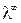
 |
У ионов ОН ‑ и ионов гидроксония наблюдается аномально высокие подвижности: при 25 0 С
 |
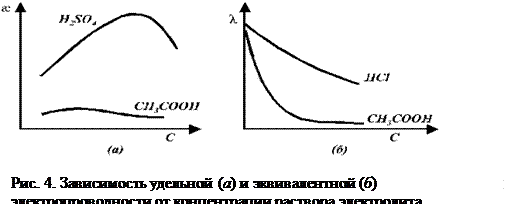
8.3 Зависимость удельной и эквивалентной электропроводностей от от концентрации для слабых и сильных электролитов.
Кривые зависимостей 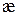
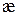
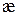
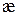
Для слабых электролитов на концентрационную зависимость 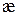
Эквивалентная электропроводность слабых и сильных электролитов увеличивается с разбавлением (рис. 4 б). Для слабых электролитов это обусловлено в основном тем, что с увеличением разведения степень диссоциации электролита возрастает и в пределе стремится к 1. Рост эквивалентной электропроводности сильных электролитов связан в основном с увеличением подвижностей ионов. В области сильно разбавленных растворов подвижности ионов достигают своего предельного значения.
 |
С позиций теории Дебая-Гюккеля уменьшение подвижности ионов с ростом концентрации обусловлено двумя эффектами торможения движения ионов за счёт электростатического взаимодействия между ионом и ионной атмосферой (рис.5,6.)
1) Эффект электрофоретического торможения обусловлен торможением движения центрального иона встречным движением ионной атмосферы и имеет гидродинамическую природу. Поскольку ионы гидратированы, то движение центрального иона происходит не в неподвижной среде, а в среде, перемещающейся ему навстречу. Движущийся ион находится под влиянием дополнительной тормозящей силы (силы электрофоретического торможения), что приводит к снижению скорости его движения. (рис.5.)
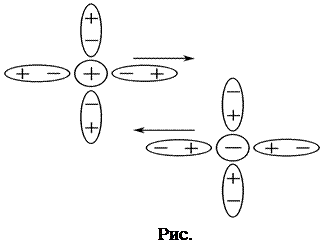 | 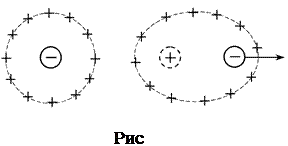 |
2) Эффект релаксационного торможения. Ионная атмосфера обладает сферической симметрией до тех пор, пока отсутствует внешнее электрическое поле. Как только центральный ион начинает движение под действием электрического поля, симметрия ионной атмосферы нарушается. Перемещение иона сопровождается разрушением ионной атмосферы в одном положении иона и формированием ее в другом, новом. Этот процесс происходит с конечной скоростью в течение некоторого времени, называемого временем релаксации. В результате ионная атмосфера теряет центральную симметрию и позади движущегося иона всегда будет находиться некоторый избыток заряда противоположного знака, что и вызывает уменьшение его скорости движения. (рис.6.)
И только теория Дебая-Гюкеля-Онзагера позволила количественно учесть влияние этих эффектов на величину эквивалентной электропроводности раствора электролита. Теоретически было получено уравнение
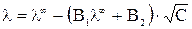
в котором постоянные (В1·λ ∞ ) и В2 характеризуют влияние релаксационного и электрофоретического эффектов соответственно. Если концентрация в растворе стремиться к нулю С → 0 эти эффекты практически не проявляются и 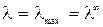
8.4 Экспериментальные приложения метода измерения электропроводности.
1. Определение константы диссоциации и степени диссоциации
Степень диссоциации a слабого электролита может быть найдена из соотношения:
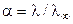
Константа диссоциации КД бинарного слабого электролита типа АВ связана со степенью диссоциации a уравнением
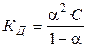
С учетом (17), получаем
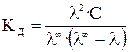
Величина λ ∞ рассчитывается по закону Кольрауша (уравнение (16)).
2 Определение произведения растворимости
Растворимостью электролита (S) называется его концентрация в насыщенном растворе (моль/л), а произведением растворимости (ПР) – произведение активностей катиона и аниона труднорастворимой соли.
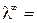
Найдя значение λ ∞ по табличным данным, и измерив удельную электропроводность раствора, можно вычислить концентрацию насыщенного раствора (в моль-экв/л),
Затем перейдя от нормальной концентрации С к молярной концентрации СM можно вычислить растворимость (S) соли.
Поскольку удельная электропроводность растворов труднорастворимых веществ (æр-ра) часто соизмерима с электропроводностью растворителя (воды) (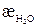

где æ –удельная электропроводность соли
Для труднорастворимых солей активности катиона и аниона практически совпадают с их концентрациями, 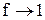
ПР =
где ni – стехиометрический коэффициент иона в уравнении диссоциации;
n – число видов ионов, на которые диссоциирует электролит;
Ci – концентрация иона, связанная с молярной концентрацией электролита СМ соотношением 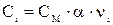
Так как a = 1, то 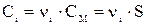
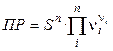
Так, для труднорастворимого (бинарного) одно–одновалентного электролита, диссоцииирующего по схеме
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет