в чем используется карбонат кальция
Польза и вред карбоната кальция
Чтобы понять, наносит ли карбонат кальция вред или дает пользу, важно разобраться в особенностях его состава. Природный минерал, известный всем нам как белый мел, химическая наука относит к красящим веществам неорганического происхождения. В действующей классификации пищевых добавок карбонату кальция присвоен код Е 170.
В естественных условиях вещество:
Кроме того, кальций является частью яичной скорлупы, а также беспозвоночных организмов: губок, моллюсков и пр. Собственно, окаменевшие останки этих животных считаются основным источником образования карбоната в природной среде.
Е170 — что за состав?
По химическому составу карбонат кальция относится к солям угольной кислоты. Лабораторный процесс получения этого вещества двухступенчатый:
Очищенный кальций, т. е. краситель Е 170, — белый порошок, который не растворяется в воде и этиловом спирте.
Где добывают карбонат кальция?
Залежи карбоната кальция в форме меловых отложений имеются на всех континентах. Добычей занимается множество компаний, но 70 % производства принадлежит десятку фирм из Европы, среди которых лидируют швейцарская Omya и французская Imerys. Однако около 10 лет назад добычей природных карбонатов и изготовлением Е 170 активно занялись китайские предприятия. Сейчас их доля на рынке постоянно растет, постепенно сужая сбыт европейской продукции.
Меловые пласты, пригодные для добычи карбоната кальция, есть и на российской территории, например, в Белгороде и Воронеже.
Лучший порошок получается в результате промышленной обработки мрамора. Для изготовления фармацевтического компонента и пищевого красителя Е 170 камень подвергается измельчению и многоступенчатой очистке.
Применение карбоната кальция в промышленности
Физико-химические свойства карбоната кальция обусловили широкий потенциал его применения в разных отраслях промышленности. Мел используется при производстве:
Также природный карбонат кальция задействуется в разнообразных промышленных системах очистки. Он эффективно заменяет опасные синтетические препараты, чем помогает сохранять экологию. Углекислый кальций полезен для сельхозугодий — с его помощью восстанавливают и поддерживают кислотно-щелочной баланс почвы.
Применение в продуктах питания
При производстве продуктов питания очищенный карбонат кальция играет тройную роль:
Помимо карбоната производители продуктов питания используют для улучшения их свойств цитрат (соль лимонной кислоты) и другие добавки, закодированные буквой Е и цифровыми обозначениями.
Вреден или нет краситель Е170 (карбонат кальция) в пище?
Поступающий в нормальных количествах в организм вместе с пищей карбонат кальция вреда не наносит. Потенциальная опасность существует только при значительной передозировке вещества. Переизбыток Е 170, т. е. гиперкальцемия, может выражаться приступами рвоты и тошноты, болями в животе, раздражительностью, нарушением координации движений. Но повторимся — это редчайшие ситуации, когда человек существенно злоупотреблял пищевой добавкой.
Разрешенная медиками доза углекислого кальция составляет 1,2–1,5 грамма. В продуктах питания количество добавки Е 170 значительно меньше, поэтому она считается максимально безопасной. О безвредности этого компонента пищи свидетельствует тот факт, что вещество законодательно разрешено к использованию практически во всех странах, включая РФ.
Фармацевтическая польза и вред карбоната кальция для организма человека
Карбонат кальция способен положительно влиять на состояние человеческого организма, обеспечивая комплексную пользу:
Благодаря этим свойствам карбонат используют в составе фармацевтических биоактивных добавок. Правильно дозированное применение таких препаратов помогает компенсировать дефицит кальция. Однако польза обеспечивается только качественным, хорошо очищенным веществом природного происхождения.
Вред от использования меловых добавок, напомним, может быть связан только с передозировкой.
Польза и вред карбоната кальция
Пищевая добавка карбонат кальция обозначается как Е 170 и в природе встречается в виде привычного мела. Вещество относится к неорганическим пигментам и используется в пищевой промышленности, медицине, строительстве, других отраслях.
Карбонат кальция не растворяется в воде и спирте, обладает свойствами разрыхлителя, антиокислителя, красителя. В материале разберем, какую пользу несет вещество и ознакомимся с оптимальными дозировками, чтобы исключить опасные побочные эффекты.
Состав пищевой добавки Е 170
Химическая формула добавки Е 170 — CaCO3. Очищенный мел поступает в продажу в форме белого порошка мелкой фракции. Источником карбоната служит мрамор. Также соль угольной кислоты присутствует в панцирях ракообразных и моллюсков.
Где добывают карбонат кальция?
Для изготовления промышленной добавки Е 170 берут природное сырье, которое содержится в минералах: ватерите, арагоните, кальците. Источником углекислого кальция также служат мрамор, известняк, мел. Сырье перерабатывают и очищают от примесей перед продажей. Наиболее ценен карбонат кальция, полученный из мрамора.
Ведущие производители добавки — 10 европейских компаний, включая Omya (Швейцария) и Imerys (Франция). С начала XXI века заводы по переработке углекислого кальция действуют в Китае. Свои меловые месторождения есть и в России. Карбонаты добывают в Белгородской и Воронежской областях. Промышленным производством занимаются предприятия АО «Мелстром», ООО «Воронежглавмел» и ОАО «Клинцевский силикатный завод».
Краситель Е170 (карбонат кальция) — вреден или нет?
Потребляемый в разумных дозировках карбонат кальция вред организму не наносит. По этой причине пищевой краситель разрешен к применению в России. При превышении суточной нормы вещество может вызвать отравление, симптомами которого становятся:
Избежать этих неприятных последствий помогает соблюдение дозировки.
В сутки медики рекомендуют применять взрослому человеку не более 1,2–1,5 г карбоната кальция.
Применение карбоната кальция в промышленности
Углекислый кальций используется сразу в нескольких отраслях промышленности.
Кроме того, вещество используется при производстве очистных сооружений и фильтров, а также в сельском хозяйстве — для восстановления кислотности грунта.
Применение в продуктах питания
Природный карбонат кальция применим в кулинарии как натуральный пищевой краситель, разрыхлитель, регулятор кислотности, наполнитель.
Также вещество предупреждает слеживание и комкование сыпучих изделий.
Карбонат кальция встречается в составе молочных и молочнокислых продуктов: сыра, сгущенки, сливок, йогуртов. Также полезную добавку используют при приготовлении детского питания, консервов, шоколадных плиток.
Польза и вред карбоната кальция для организма
Как мы уже выяснили, карбонат кальция не несет вреда организму. Доказательством тому служит использование в фармацевтике: вещество присутствует в БАДах и витаминных препаратах, направленных на устранения дефицита кальция.
Польза Е 170 очевидна: вещество поддерживает жизнедеятельность организма, стабилизирует кровяное давление, стимулирует работу сердечной мышцы, отвечает за свертываемость крови и формирование костных структур.
Для лучшего усвоения карбонат кальция рекомендуется употреблять совместно с витамином D.
Что такое карбонат кальция, и где мы с ним можем встретиться
Перебирала недавно свои детские книги в поисках, что почитать сыну, и наткнулась на старую, но хорошо запомнившуюся с детства книгу А. Дитриха «Разноцветные истории». Мне подарили ее в третьем классе, и я, помню, зачитала её до заучивания наизусть.
Как ни странно, сейчас её уже не переиздают, по крайней мере, я нигде не смогла найти ни в продаже, ни на «пиратских» сайтах на скачивание.
Моему пятилетнему сыну она пока рановата для чтения, а вот для детей 8-9 лет, думаю, прекрасно подойдет. Здесь рассказывается об окружающем мире: из чего состоят горы, как образуются острова, как ученые прошлого изучали огонь и воздух.
Особенно мне нравилась первая повесть «Черным по белому».
Главный герой этой повести – обычный кусочек мела – и натолкнул меня на тему сегодняшней статьи. А что мы знаем о меле кроме того, что им пишут на школьной доске и на асфальте?
В общих чертах
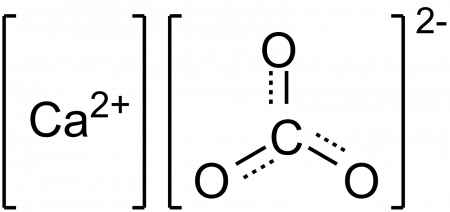
Кто бы там что ни говорил о «натуральном» меле «без химии», но это как раз – самая типичная химия. Кальция карбонат – это и есть мел. Вещество, в состав которого входят по одному атому кальция и углерода и три атома кислорода.
Еще можете встретить название «углекислый кальций», это тоже верно.
Думаю, о внешнем виде долго говорить не надо – твердое белое вещество, не растворимое в воде, без вкуса и запаха.
Самое частое, где мы с ним сталкиваемся, это не только кусок мела из детского набора, но и скорлупа яиц, мелованная бумага, побелка и многое другое, о чем я напишу чуть ниже.
Кстати, не путайте с восковыми мелками – это совсем другое и не имеет никакого отношения к углекислому кальцию. Обычный мел, которым пишут на школьных досках, состоит из сорока процентов карбоната кальция и шестидесяти процентов гипса.
Так что, если вы прочитали чуть выше, что у мела нет вкуса, и решили со мной поспорить на основе своего опыта со школьным мелом, то знайте, что вы грызете не только карбонат, но и сульфат кальция, то есть гипс – отсюда и такой вкус.
Кому-то он кажется приятным, кому-то – нет. Я отношусь ко второй группе людей.
А насчет содержания карбоната кальция в скорлупе яиц есть интересный опыт, проведенный исследователем Дж. А. Маккеем – как знание химии помогло в экономике.
История, приключившаяся с одним фермером, чуть не разорила его – скорлупа куриных яиц была настолько тонкая, что при перевозке билось огромное количество яиц. Оказалось, что причина – в жаре и воде, которую пью куры.
Как именно была решена проблема, вы можете прочитать в группе « Занимательная химия », ссылки на которую в различных социальных сетях вы найдете под статьей.
Где встречается в природе
Думаю, эти названия вам мало что скажут, кроме, пожалуй, мрамора, его довольно легко представить. Кроме того, как я уже говорила, карбонат кальция входит в состав скорлупы яиц, а также с его помощью образуются сталактиты и сталагмиты в пещерах:

Ну а мел как осадочная порода также существует. Кроме карбоната кальция в него входит еще карбонат магния и оксиды некоторых металлов.
Где применяется
Два самых активных потребителя карбоната кальция – это строительная промышленность и производство пластмасс.
Ну, со строительством, думаю, все понятно – побелки, шпатлевки, герметики. Кроме того, большое количество этого вещества идет на производство красок (в качестве белого пигмента) и стекла.
Из мрамора строят красивейшие здания:

В производстве пластмасс он используется как наполнитель и наполнитель.
Остальные области применения карбоната кальция не слишком большие, но все равно без него не могут обойтись:
Немного хочу сказать про карбонат кальция в качестве пищевой добавки. Она считается безвредной. В основном, применяется как белый краситель, разрыхлитель, который предотвращает слеживание сыпучих продуктов.
В детском питании, например, он выступает как регулятор кислотности, а в шоколаде работает как стабилизатор.
Чаще всего его добавляют в концентрированное молоко и сливки, твердые сыры, порошок какао.
Как я уже сказала, количество добавляемого углекислого кальция настолько мало, что не может вызвать негативные последствия. Нормой считается 1,5 г чистого вещества в день. Это довольно приличное количество, которое вы никак не наберете с пищей, поэтому беспокоиться не нужно.
Воздействие на организм
Какие же есть полезные свойства этого вещества? Оно влияет на свертываемость крови и давление, поддержание стабильной сердечной деятельности, участвует в формировании костной ткани.
В медицине его применяют для:
Например, если вы пьете «Ренни» при изжоге, то прочитайте в инструкции его состав: карбонаты кальция и магния, так как они вступают в реакцию с соляной кислотой, находящейся в желудке, и нейтрализуют ее. Правда, тут есть свои тонкости, с которыми лучше посоветоваться с врачом.
Кстати, если вы решите, что вам срочно необходимо пополнить запасы кальция в организме, то не надо говорить, что вам нужен чистый кальций – это все-таки металл, причем, достаточно активный (вы же не глотаете железные гвозди, если у вас низкий гемоглобин). А вот его соединения будут в самый раз.
Я уже рассказывала о глюконате кальция и его применении. Иногда возникают споры, что лучше – глюконат или карбонат.
Если разбираться, то оба этих вещества хорошо усваиваются организмом, но глюконата требуется гораздо больше – в его составе кальция почти в четыре раза меньше, чем в карбонате.
Минус применения карбоната в том, что он нерастворим в воде, это может привести к образованию камней в почках.
Кстати, очень смешно читать про «органический» и «неорганический» кальций. Это – чушь! Нет таких понятий.
Сейчас наиболее «удобным» для организма считается цитрат кальция. Именно поэтому на разных «народных» форумах и сайтах можно встретить рецепты типа: истолочь куриную скорлупу, растворить её в лимонной кислоте (лимонном соке) и пить.
В принципе, с точки зрения химии способ правильный. В результате химической реакции между карбонатом кальция, находящемся в скорлупе, и лимонной кислотой образуется соединение под названием цитрат кальция, которое хорошо растворяется в воде.
Но как это повлияет на организм, я сказать не могу, я не врач. По отзывам врачей, оно не влияет на образование камней в почках и на кислотность желудочного сока, хорошо усваивается организмом.
Честно скажу, я этим рецептом не пользовалась – я больше доверяю аптечным препаратам, где строго выверена дозировка, а основной компонент тщательно очищен от ненужных примесей.
Ну а что касается камней в почках, которыми нас так усердно пугают все, кому не лень, то прием препаратов кальция – далеко не единственный «провокатор» их образования. Если вы пьете кофе или/и газированные напитки в бешеных количествах, употребляете много сахара и соли, ведете сидячий образ жизни, то не надо потом грешить на кальций.
Вот, пожалуй, и все на сегодня.
Всем желаю хорошего настроения! Я недавно нашла забавное видео, поделюсь им с вами:
Карбонат кальция
| Карбонат кальция | |||
|---|---|---|---|
| |||
 | |||
| Систематическое наименование | карбонат кальция | ||
| Традиционные названия | углекислый кальций | ||
| Хим. формула | CaCO3 | ||
| Состояние | твёрдые белые кристаллы | ||
| Молярная масса | 100.0869 г/моль | ||
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ | ||
| Температура | |||
| • плавления | (кальцит) 825 °C, (арагонит) 1339 °C | ||
| • разложения | 900−1000 °C | ||
| Давление пара | 0 ± 1 мм рт.ст. | ||
| Константа диссоциации кислоты pKa | 9.0 | ||
| Растворимость | |||
| • в воде | (25 °C) 0,0014 г | ||
| Показатель преломления | 1,60 | ||
| Кристаллическая структура | тригональная, пространств. гр. 2/m | ||
| ГОСТ | ГОСТ 4530-76 | ||
| Рег. номер CAS | 471-34-1 | ||
| PubChem | 10112 | ||
| Рег. номер EINECS | 207-439-9 | ||
| SMILES | |||
| Кодекс Алиментариус | E170 | ||
| RTECS | FF9335000 | ||
| ChEBI | 3311 | ||
| ChemSpider | 9708 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Содержание
Применение
Используется как белый пищевой краситель E170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов.
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
Химические свойства
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ: