в чем физический смысл порядкового номера элемента
Какой физический смысл порядкового номера химического элемента?
Содержание:
Физический смысл Периодического закона Дмитрия Ивановича Менделеева отражается в закономерных изменениях свойств химических элементов и их соединений по мере увеличения атомного заряда. Ученые во второй половине XIX века имели огромное количество знаний о различных элементах. Все знания для лучшего понимания и развития науки было необходимо упорядочить в понятном и наглядном виде. Исследователи стремились создать химическую классификацию, в которой все вещества должны объединяться по общему строению и схожим свойствам.
Упорядочить элементы удалось молодому русскому химику Дмитрию Ивановичу Менделееву. Путем экспериментов он определил свойства всех элементов и их соединений. Исследователь отразил сведения о каждом элементе на отдельных листах, которые он перемещал на столе огромное количество раз и старался определить логичную последовательность. Спустя несколько лет он определил, что свойства периодически изменяются по мере увеличения атомной массы.
Периодический закон отражается в Периодической таблице Д.И. Менделеева. Во время создания данного закона было известно 63 элемента. Менделеев предугадал существование новых веществ, поэтому оставил для них пустые ячейки. В современной таблице 118 элементов.
Каков физический смысл порядкового номера химического элемента?
Каков физический смысл порядкового номера группы?
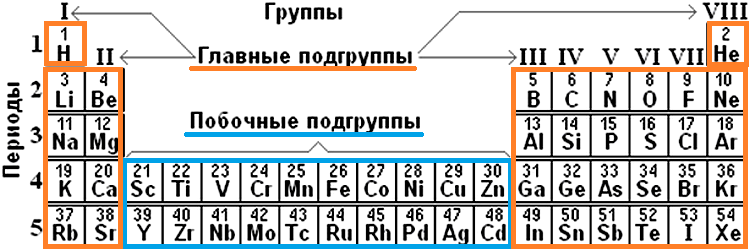
Группы классифицируются на главные и побочные подгруппы. Атомы малых периодов и некоторые атомы больших периодов относятся к главным (А) подгруппам, элементы больших периодов – к побочным (В).
Номер группы соответствует числу электронов на наружном уровне атомов А-подгрупп. Сверху вниз по подгруппе происходят следующие изменения:
Для всех атомов, кроме гелия Не, неона Ne и аргона Ar, характерно образование высших оксидов, которые классифицируются на несколько форм. Они изображаются формулами, которые располагаются внизу периодической таблицы.
Элементы, находящиеся с четвертой по восьмую главную подгруппу, образуют одну из четырех форм соединений с водородом. Они обозначаются в виде формул внизу периодической таблицы.
Каков физический смысл порядкового номера периода?
Номер периода соответствует числу энергетических уровней атома. Слева направо по периоду происходят следующие закономерные изменения:
Таким образом, физический смысл периодического закона отражается в порядковом номере, группе и периоде химического элемента. Периодическая таблица Дмитрия Ивановича раскрывает тайны человечества и открывает новые границы химической науки.
Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
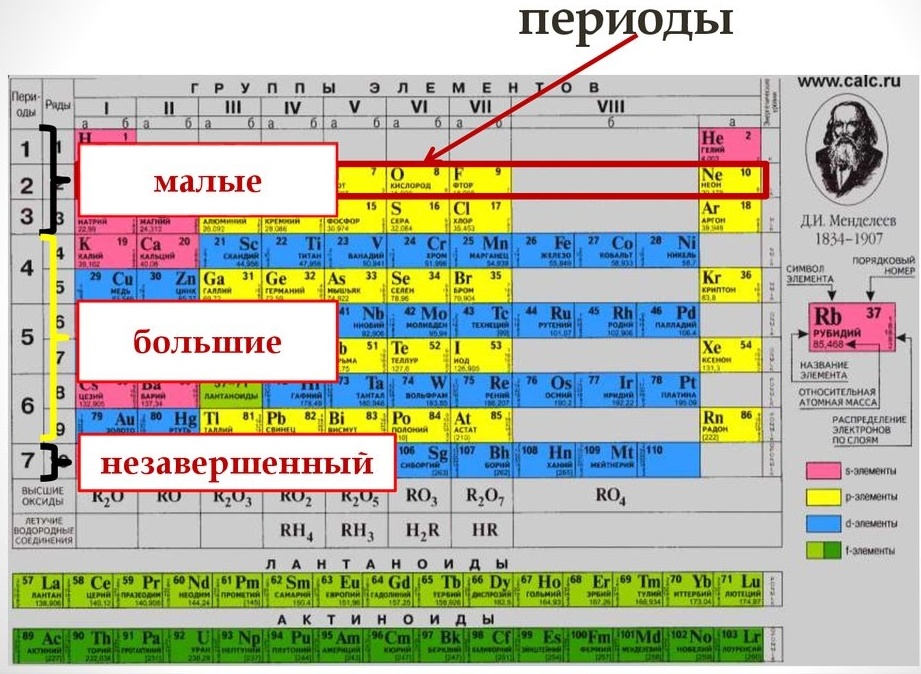
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
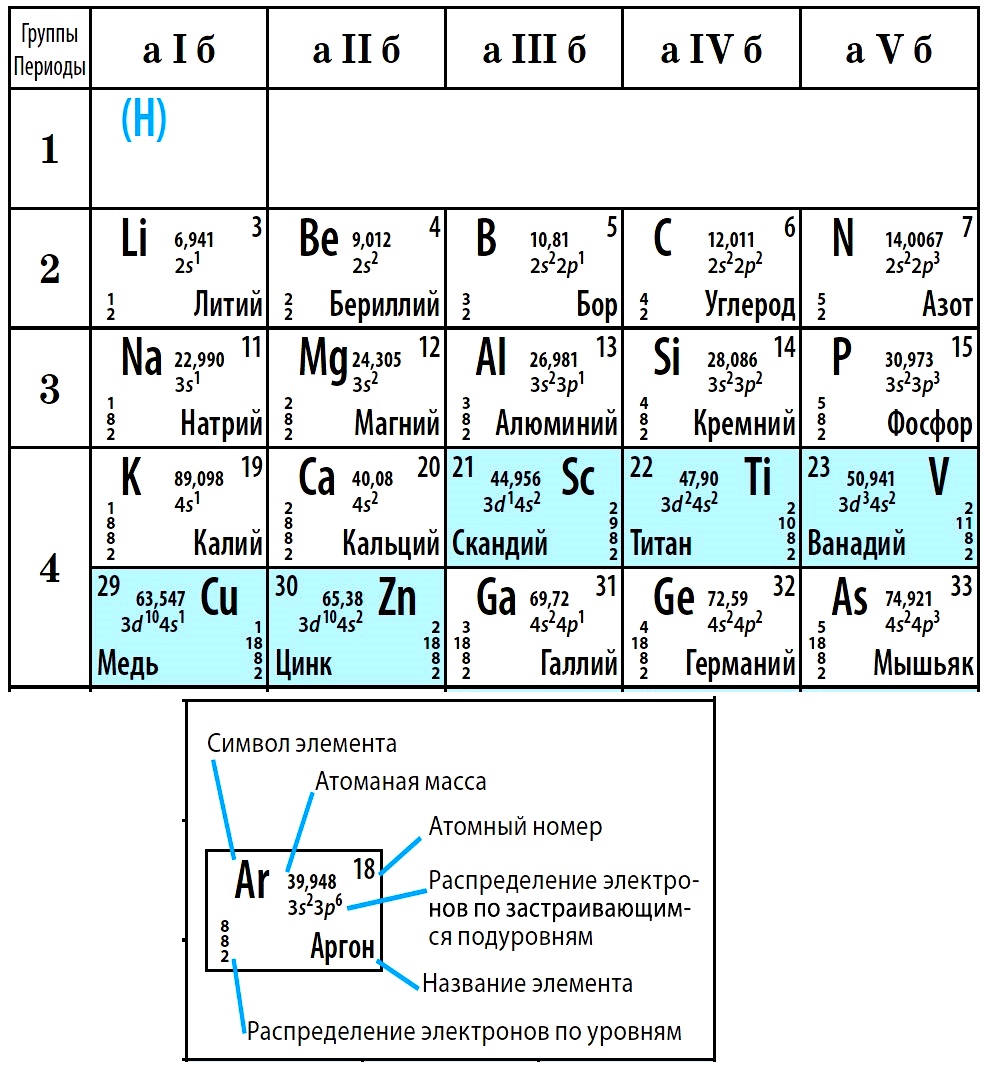
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
12. Кислотные свойства водородных соединений ослабевают в ряду
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
В чем физический смысл порядкового номера элемента
Ключевые слова конспекта: Периодическая система химических элементов Д.И. Менделеева, группы и периоды Периодической системы, физический смысл порядкового номера химического элемента.
Периодическая система химических элементов — это таблица, в которой все химические элементы расположены в порядке возрастания атомных номеров. Таблица включает в себя периоды и группы, т.е. горизонтальные строчки и вертикальные столбцы.
Период — это последовательность (горизонтальный ряд в таблице) элементов с возрастающими атомными номерами, начинающаяся щелочным металлом (или водородом) и заканчивающаяся благородным газом.
Число электронных слоев в атомах данного периода равно номеру периода.
В периодах с возрастанием атомного номера Z металлические свойства ослабевают, а неметаллические усиливаются.
Группа — это вертикальная колонка элементов в таблице, включающая элементы с одинаковой максимальной степенью окисления, равной номеру группы, и одинаковой отрицательной степенью окисления, для атомов неметаллов равной номеру группы минус 8.
В группах с возрастанием атомного номера Z металлические свойства усиливаются, а неметаллические ослабевают. Число валентных электронов атома обычно равно номеру группы.
В коротком варианте таблицы Менделеева различают малые периоды — 1-й, 2-й и 3-й, содержащие 2, 8 и 8 элементов соответственно, а также большие периоды — 4-й, 5-й, 6-й и незавершенный 7-й. Каждый большой период таблицы включает две строчки (два ряда). Например, в 4-м периоде, начинающемся калием 19K, последний элемент в верхней строчке — никель 28Ni, он в числе элементов триады (Fe, Со, Ni) попадает в VIII группу. Следующий элемент — медь 29Cu записан строчкой ниже и находится в I-й группе.
Каждая группа с номерами от I до VIII включает две группы — А и Б.
A-группы включают элементы малых периодов, а также элементы больших периодов, которые по свойствам наиболее близки к соответствующим элементам малых периодов.
Б-группы включают элементы больших периодов, в атомах которых электроны, появляющиеся в них с увеличением заряда ядра, попадают в слой, предшествующий внешнему.
Физический смысл порядкового номера химического элемента:
Конспект урока «Периодическая система химических элементов».