углерод номер периода номер группы
Подгруппа углерода
Содержание
Элементы подгруппы
Углерод
Кремний
Германий
Олово
Олово — ковкий, легкий металл серебристо-белого цвета.
Свинец
Свинец — ковкий металл серого цвета. Элемент довольно мягок, можно без затруднения порезать ножом.
Флеровий
Флеровий — искусственный сверхтяжёлый радиоактивный элемент. Из известных изотопов наиболее устойчив 289 Fl. Период полураспада составляет около 2,7 секунд для 289 Fl и 0,8 секунды для 288 Fl.
Примечания
Полезное
Смотреть что такое «Подгруппа углерода» в других словарях:
УГЛЕРОДА СЕМЕЙСТВО — ПОДГРУППА IVA. СЕМЕЙСТВО УГЛЕРОДА КРЕМНИЯ УГЛЕРОД, КРЕМНИЙ, ГЕРМАНИЙ, ОЛОВО, СВИНЕЦ Характерная для подгруппы IIIA особенность постепенного перехода от легкого неметаллического элемента к тяжелому типичному металлу наблюдается и в этой подгруппе … Энциклопедия Кольера
Группа периодической системы — химических элементов последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, к … Википедия
Группа периодической таблицы — Группа периодической системы химических элементов последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) … Википедия
ХАЛЬКОГЕНЫ — ПОДГРУППА VIA. ХАЛЬКОГЕНЫ КИСЛОРОД Элемент кислород O восьмой элемент периодической системы элементов и первый элемент подгруппы VIA (табл. 7а). Этот элемент наиболее распространен в земной коре, составляя около 50% (масс.). В воздухе, которым мы … Энциклопедия Кольера
ГАЛОГЕНЫ — ПОДГРУППА VIIA. ГАЛОГЕНЫ ФТОР, ХЛОР, БРОМ, ИОД, АСТАТ Галогены и особенно фтор, хлор и бром имеют большое значение для промышленности и лабораторной практики как в свободном состоянии, так и в виде различных органических и неорганических… … Энциклопедия Кольера
ТИТАНА СЕМЕЙСТВО — ПОДГРУППА IVB. СЕМЕЙСТВО ТИТАНА ТИТАН, ЦИРКОНИЙ, ГАФНИЙ К переходным металлам относятся также элементы семейства титана Ti, Zr и Hf, отличающиеся удивительным сходством свойств. Последние два элемента (Zr и Hf) особенно близки по свойствам.… … Энциклопедия Кольера
АЛЮМИНИЯ СЕМЕЙСТВО — ПОДГРУППА IIIA. СЕМЕЙСТВО АЛЮМИНИЯ БОР, АЛЮМИНИЙ, ГАЛЛИЙ, ИНДИЙ, ТАЛЛИЙ Внешняя электронная конфигурация у всех элементов подгруппы s2p1, но наличие внутренней электронной структуры типа электронной конфигурации благородного газа у B и Al и… … Энциклопедия Кольера
ВАНАДИЯ СЕМЕЙСТВО — ПОДГРУППА VB. СЕМЕЙСТВО ВАНАДИЯ ВАНАДИЙ, НИОБИЙ, ТАНТАЛ Различие в химических и физических свойствах среди членов этого семейства переходных металлов ванадия V, ниобия Nb и тантала Ta несколько больше, чем отмеченное у элементов подгруппы IVB.… … Энциклопедия Кольера
Углерод — характеристика, строение и свойства элемента
Углерод – это один из самых важных химических элементов, без которого невозможна жизнь всех живых организмов. Он является основным компонентом всех органических соединений, которые поддерживают жизнь на Земле.
С этим атомом тесно связано понятие «органическая химия», основоположником которой является великий учёный Берцелиус Йёнс Якоб.
Положение углерода в периодической системе химических элементов
Кратко об углероде (С):
порядковый номер атома углерода – 6;
он расположен во втором периоде;
углерод занимает 4 группу, главную подгруппу (а).
Электронное строение углерода
+6 C ) 2 ) 4 1s 2 2s 2 2p 2
У атома углерода всего два электронных уровня. На первом расположено 2 электрона, на втором – 4. Всего электронов 6, а значит, заряд ядра будет равен +6.
Атомная масса атома – 12.011.
Аллотропные модификации и физические свойства
Рассмотрим 4 основные аллотропные модификации углерода, их формулы и физические свойства.
Алмаз (С)
Благодаря своей уникальной кристаллической решётке, алмаз считается самым твёрдым камнем на планете после корунда.
Из твёрдости алмаза следует ещё одно его важное физическое свойство – высокая плотность.
Алмаз отличается своей уникальной теплопроводностью, которая лидирует среди всех твёрдых тел. Кроме того, такая порода не проводит электричество.
Графит (С)
тёмный, ближе к чёрному цвет;
имеет сильно выраженный металлический блеск;
прозрачность проявляется в наименьшей степени;
имеет огромную температуру сгорания (38500 градусов по Цельсию);
температура плавления больше 3800 градусов по Цельсию:
теплопроводность 100 — 354 Вт.
Фуллерен (С60)
плотность 1,68 г/см 3 ;
температура плавления 1180 градусов по Цельсию;
не растворяется в воде (но растворим в бензоле);
плотность 1,69 г/см 3 ;
Карбин (CH3OH)
электропроводен (зависит от действия света: чем он больше, тем выше электропроводность);
высокая твёрдость и теплопроводность.
Качественные реакции
Цель проведения качественных реакций – выявление наличия нужного атома, вещества или иона.
Рассмотрим их подробнее:
Ca(OH)2 + CO2 = Ca(CO3) (осадок) + H2O – образование вещества, нерастворимого в воде, что свидетельствует о том, что в реакции присутствует углекислый газ.
Соединения углерода
Углерод образует два оксида:
1. Оксид углерода (II) – CO. Другое название – угарный газ.
Характеристика: не имеет запаха и цвета. Опасен для жизни живых организмов. Молярная масса – 28,01 г/моль. Получают за счёт окисления углерода кислородом:
C + O2 = 2CO + Q (теплота).
2. Оксид углерода (IV) – CO2. Другое название – углекислый газ, «сухой лёд». Характеристика: без цвета и запаха. Не горит и не поддерживает горения.
Это кислотный оксид, которому соответствует угольная кислота. Молярная масса – 44,01 г/моль.
Карбиды – бесцветные вещества, имеющие форму кристаллов и содержащие в своём составе углерод. Примеры: SiC, Al3C4, CaC2, Cr3C2.
Органические соединения углерода:
углеводороды (алкины, алкены, алканы);
кислородосодержащие соединения (спирты, кислоты и альдегиды, кетоны);
азотосодержащие соединения (нитросоединения, амины, аминокислоты).
Химические свойства углерода
Углерод является и окислителем и восстановителем.
C 0 + 2CuO = 2Cu + C +4 O2
Углерод – это неметалл, т. е. принимает на внешний уровень недостающие атомы.
Таким образом, значение углерода в жизни всего живого очень велико. Его многочисленные уникальные свойства, различные модификации позволяют использовать углерод во множестве сфер промышленности.
Углерод
Углерод / Carboneum (С), 6
8,54 (графит) [4] Дж/(K·моль)
гексагональная (графит), кубическая (алмаз)
a=2,46; c=6,71 (графит); а=3,567 (алмаз) Å
Содержание
История
Углерод в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны аллотропные модификации углерода — алмаз и графит.
На рубеже XVII—XVIII вв. возникла теория флогистона, выдвинутая Иоганном Бехером и Георгом Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества — невесомого флюида — флогистона, улетучивающегося в процессе горения. Так как при сгорании большого количества угля остается лишь немного золы, флогистики полагали, что уголь — это почти чистый флогистон. Именно этим объясняли, в частности, «флогистирующее» действие угля, — его способность восстанавливать металлы из «известей» и руд. Позднейшие флогистики, Реомюр, Бергман и другие, уже начали понимать, что уголь представляет собой элементарное вещество. Однако впервые таковым «чистый уголь» был признан Антуаном Лавуазье, исследовавшим процесс сжигания в воздухе и кислороде угля и других веществ. В книге Гитона де Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur). Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье.
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Ещё в 1751 г. германский император Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что алмаз представляет собой кристаллический углерод. Второй аллотроп углерода — графит — в алхимическом периоде считался видоизменённым свинцовым блеском и назывался plumbago; только в 1740 г. Потт обнаружил отсутствие в графите какой-либо примеси свинца. Шееле исследовал графит (1779) и, будучи флогистиком, счёл его сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона.
Двадцать лет спустя Гитон де Морво путем осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Происхождение названия
В начале XIX века в русской химической литературе иногда применялся термин «углетвор» (Шерер, 1807; Севергин, 1815); с 1824 года Соловьёв ввёл название «углерод». Соединения углерода имеют в названии часть карб(он)— от лат. carbō (род. п. carbōnis) «уголь».
Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Изотопы углерода
На образовании и распаде 14 С основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
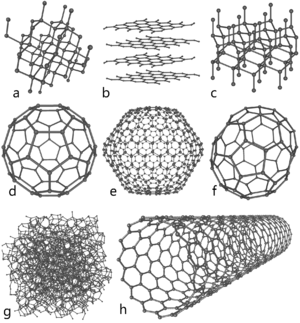
Аллотропные модификации углерода
Кристаллический углерод
Аморфный углерод
На практике, как правило, перечисленные выше аморфные формы являются химическими соединениями с высоким содержанием углерода, а не чистой аллотропной формой углерода.
Кластерные формы
Структура
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода.
Графит и алмаз
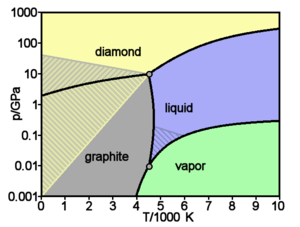
Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы метастабильны. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается за секунды. ΔН0 перехода — 1,898 кДж/моль. При нормальном давлении углерод сублимируется при 3 780 K. Жидкий углерод существует только при определенном внешнем давлении. Тройные точки: графит-жидкость-пар Т = 4130 K, р = 10,7 МПа. Прямой переход графита в алмаз происходит при 3000 K и давлении 11—12 ГПа.
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15—20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1 200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решёткой типа вюрцита — лонсдейлит (а = 0,252 нм, с = 0,412 нм, пространственная группа Р63/mmc), плотность 3,51 г/см³, то есть такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
В 1980-е гг. в СССР было обнаружено, что в условиях динамического нагружения углеродсодержащих материалов могут образовываться алмазоподобные структуры, получившие название ультрадисперсных алмазов (УДА). В настоящее время всё чаще применяется термин «наноалмазы». Размер частиц в таких материалах составляет единицы нанометров. Условия образования УДА могут быть реализованы при детонации взрывчатых веществ с значительным отрицательным кислородным балансом, например смесей тротила с гексогеном. Такие условия могут быть реализованы также при ударах небесных тел о поверхность Земли в присутствии углеродсодержащих материалов (органика, торф, уголь и пр.). Так, в зоне падения Тунгусского метеорита в лесной подстилке были обнаружены УДА.
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl4 в низкотемпературной плазме.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Фуллерены и углеродные нанотрубки
Углерод известен также в виде кластерных частиц С60, С70, C80, C90, C100 и подобных (фуллерены), а также графенов, нанотрубок и сложных структур — астраленов.
Аморфный углерод (строение)
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, техуглерод, сажа, активный уголь.
Графен
Графен (англ. graphene) — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp² связей в гексагональную двумерную кристаллическую решётку.
Нахождение в природе
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в
60 раз больше. Углерод входит в состав растений и животных (
18 %).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др. Биологический цикл состоит в том, что углерод в виде СО2 поглощается из тропосферы растениями. Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов — в почву и в виде СО2 — в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
В природе встречается минерал шунгит, в котором содержится как твердый углерод (≈25 %), так и значительные количества оксида кремния (≈35 %).
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4 (напр., CO2), −4 (напр., CH4), редко +2 (СО, карбонилы металлов), +3 (C2N2); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С 0 к С 4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Продукты горения углерода в кислороде являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). Известен также неустойчивый недооксид углерода С3О2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например C12O9, C5O2, C12O12). Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C.
Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты. На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. С большинством металлов углерод образует карбиды, например:

Важна в промышленности реакция углерода с водяным паром:
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности.
Органические соединения
Способность углерода образовывать полимерные цепочки, порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Применение
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области.
В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.
Токсическое действие
Углерод входит в состав атмосферных аэрозолей, в результате чего может изменяться региональный климат, уменьшаться количество солнечных дней. Углерод поступает в окружающую среду в виде сажи [источник не указан 1185 дней] в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5 — 0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)·10 9 Бк/сут 14 СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14 С, вошедшего в состав молекул белков (особенно в ДНК и РНК), определяется его радиационным взаимодействием с β-частицами ( 14 С (β) → 14 N), приводящим к изменению химического состава молекулы. Допустимая концентрация 14 С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0·10 4 Бк/л, предельно допустимое поступление через органы дыхания 3,2·10 8 Бк/год.
См. также
Примечания
Литература
Ссылки
Нестабильные (менее суток): 8 C: Углерод-8, 9 C: Углерод-9, 10 C: Углерод-10, 11 C: Углерод-11
Нестабильные (менее суток): 15 C: Углерод-15, 16 C: Углерод-16, 17 C: Углерод-17, 18 C: Углерод-18, 19 C: Углерод-19, 20 C: Углерод-20, 21 C: Углерод-21, 22 C: Углерод-22