реактивный элемент под номером 100
Наведённая радиоактивность
При облучении частицами (нейтронами, протонами, гамма-квантами) стабильные ядра могут превращаться в радиоактивные ядра с различным периодом полураспада, которые продолжают излучать длительное время после прекращения облучения. Особенно сильна радиоактивность, наведённая нейтронным облучением. Это объясняется следующими свойствами этих частиц: для того, чтобы вызвать ядерную реакцию с образованием радиоактивных ядер, гамма-кванты и заряженные частицы должны иметь большую энергию (не меньше нескольких МэВ). Однако они взаимодействуют с электронными оболочками атомов намного интенсивнее, чем с ядрами, и быстро теряют при этом энергию. Кроме того, положительно заряженные частицы (протоны, альфа-частицы) быстро теряют энергию, упруго рассеиваясь на ядрах. Поэтому вероятность гамма-кванта или заряженной частицы вызвать ядерную реакцию ничтожно мала. Например, при бомбардировке бериллия альфа-частицами лишь одна из нескольких тысяч или десятков тысяч (в зависимости от энергии альфа-частиц) вызывает (α, n)-реакцию, а для других веществ эта вероятность ещё меньше.
Нейтроны же, наоборот, захватываются ядрами при любой энергии, более того, максимальна вероятность захвата именно нейтронов с низкой энергией. Поэтому, распространяясь в веществе, нейтрон может попадать в множество ядер последовательно, пока не будет захвачен очередным ядром, и вероятность захвата нейтрона практически равна единице.
Следует заметить, что поглощение нейтронов не обязательно ведёт к появлению наведённой радиоактивности. Многие ядра могут захватывать нейтрон с образованием стабильных ядер, например бор-10 может превратиться в стабильный бор-11 (если захват нейтрона ядром не приведёт к образованию лития и альфа-частицы), лёгкий водород (протий) — в стабильный дейтерий. В таких случаях наведённая радиоактивность не возникает.
Процесс превращения нерадиоактивных ядер в радиоактивные и образования в веществе радиоактивных изотопов под действием облучения называется активацией.
7 элементов в таблице Менделеева, которые здравому смыслу не оставляют ни единого шанса
Какой самый интересный и сумасшедший элемент в периодической таблице химических элементов?
Почти любой элемент в периодической таблице Менделеева удивителен и имеет долю сумасшествия. Сера, похоже, не принадлежит к сумасшедшему клубу. Но тем не менее факты о ней удивительно интересны.
Учтите, что вода – это H20. Это необходимо для жизни. Она не пахнет. Это жидкость.
Чуть ниже кислорода в периодической таблице находится сера. У нее, по логике, должны быть похожие свойства. Но это не так. Согласитесь, это поразительно. Но есть в нашем мире химии и более необычные элементы, которые могут удивить еще больше. Мы в 1Gai.Ru изучили всю таблицу Менделеева, отобрав для вас самые интересные факты о самых удивительных элементах.
Цезий как эталон самого точного времени в мире
Цезий – прекрасный пример управляемого хаоса. Этот элемент известен как радиоактивный отход от ядерных взрывов. Цезий является одним из пяти элементов, которые находятся в жидком состоянии при комнатной температуре.
Но самое удивительное изменение состояния цезия происходит, когда вы помещаете его в воду. Вот что при этом происходит:
Также у цезия электронные переходы настолько точны, что он стал использоваться в качестве основного стандарта для определения самого точного в мире времени.
Так, секунда – это время, равное 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133.
Цезий применяется в атомных часах. Вот как они выглядят:
Эти атомные часы настолько точны, что не потеряют ни секунды за 20 миллионов лет. Это безумие, как такой нестабильный элемент может быть использован, чтобы стать нашим точным определением времени.
Олово – элемент, который совершает самоубийство!
Олово (Sn) – это 50-й элемент периодической таблицы Менделеева.
Олово издавна известно человечеству. Так, есть доказательства, что человек знал об олове уже в IV тысячелетии до нашей эры. Этот металл был очень дорог и мало кому доступен. Именно поэтому изделия из него редко встречаются среди римских и греческих древних находок. Примечательно, что об олове даже есть информация в Библии (Четвертой Книге Моисея).
Примечательно, что вокруг олова в нашем мире есть множество интересных легенд. Одна из самых интересных – это легенда о том, как свойства олова сыграли с Наполеоном Бонапартом злую шутку.
Легенда гласит, что это необычное химическое поведение олова способствовало падению императора Наполеона Бонапарта. В те времена олово использовалось для изготовления пуговиц и других застежек солдатской формы. Пока армия французов шла в сторону России, с пуговицами солдат было все порядке. Но все изменилось, когда солдаты ступили на российскую землю, где свирепствовали морозы.
Вот тут-то и началась метаморфоза с оловянными пуговицами, которые начали разрушаться, в результате чего форма не могла согреть солдат. В действительности же олову требуется несколько месяцев, чтобы буквально уничтожить себя, преобразовавшись в другую форму. Но, с другой стороны, когда французы вторглись в Россию, температура была ниже минус 30 ° C.
Так что, как полагают некоторые историки и химики, это и послужило сильным толчком для перехода оловянных пуговиц в порошкообразную форму. Правда, все это исторически не подтверждено. А согласитесь, легенда хорошая. Ведь один факт, что легендарный Наполеон потерпел крах своей армии на территории России из-за проблем с форменным обмундированием и виной всему химические свойства олова… Звучит красиво!
Если вам интересно, вот видео, которое показывает переход олова из его бета-формы в альфа-форму:
Висмут
Обычно это выглядит так:
Но при правильных условиях это может выглядеть так:
Мы рекомендуем воспользоваться поиском картинок на Яндексе или в Google по запросу «Кристаллы висмута», чтобы увидеть все чудеса, которые может произвести висмут.
Некоторые другие интересные факты о висмуте:
Франций
Франций ОЧЕНЬ реактивный и имеет атомный номер 87.
Франций очень реакционноспособный и радиоактивный элемент. Поскольку период его полураспада составляет 22 минуты, он очень реактивный.
Фактически это никогда не проверялось из-за рисков, которые это несет. Тем не менее ученые сделали копию того, на что это было бы похоже, если бы вы уронили его в воду.
Посмотрите, к чему это привело бы:
Вот некоторые фотографии, на которых тестировался франций (но только с небольшим количеством)
Наконец, вот так выглядит франций.
Московий
Московий – это искусственно синтезированный радиоактивный элемент. То есть этот элемент в нашей природе не встречается. В 2004 году российские ученые во время исследований на циклотроне У-400 в Объединённом институте ядерных исследований (Дубна, Россия) получили 115-й элемент периодической таблицы Менделеева, представив миру новый элемент, получивший название «Московий».
Галлий
Галлий был предсказан Дмитрием Менделеевым до его открытия. При создании периодической таблицы химических элементов Менделеев на основе ранеее открытого периодического закона оставил в таблице вакантные места для третьей группы неизвестных элементов.
Галлий же был открыт, выделен и изучен в виде простого вещества французским химиком Полем Эмилем Лекоком де Буабодраном. Это произошло 20 сентября 1875 года.
Этот элемент является постпереходным металлом, перекрывающим промежуток между переходными металлами и металлоидами, и поэтому имеет тенденцию быть мягче с низкой электропроводностью, чем переходные металлы.
Галлий имеет температуру плавления в 29,7 ° С, в то время как его температура кипения находится на уровне около 2204 ° С, что делает этот металл элементом с самым высоким соотношением температуры кипения и температуры плавления.
Он менее токсичен, чем ртуть, поэтому является более экологически чистым выбором для высокотемпературного термометра.
Жидкий галлий расширяется на 3,1 процента при затвердевании.
Жидкий галлий очень легко охлаждается.
Водород
Многие химические элементы каждый по-своему удивителен и уникален. Например, уран способен к массовому разрушению, цезий (читайте о нем выше) имеет крутой эффект взрыва при контакте с водой, а галлий обладает очень низкой температурой плавления и не такой вредный, как ртуть.
Но это всего лишь цветочки по сравнению с настоящим безумным элементом периодической таблицы Менделеева. Один элемент намного, намного более удивительный, чем любой в этой таблице, – речь идет о невероятном водороде. Вот лишь некоторые из уникальных свойств водорода.
Это основной компонент звезд во Вселенной – солнечных гигантских огненных шаров с невероятным количеством энергии. Вы только вдумайтесь: 0,0000066% энергии нашего Солнца питает всю Землю.
Водород стоит за созданием всех других элементов. Этот элемент самый распространенный во Вселенной. От всей барионной массы водород во Вселенной составляет 75 процентов. Звезды чаще всего состоят из водородной плазмы. По сути, без водорода не было бы ничего.
Вы наверняка еще со школы помните, что водород является компонентом воды. А вода именно та вещь, из чего состоят практически большинство всех живых существ на нашей планете.
Также некоторые спирты в значительной степени зависят от водорода. Да-да, речь идет о знакомом нам этаноле (алкоголе), который может затуманить нам мозг на какой-нибудь вечеринке.
На самом деле есть безумное количество вещей, за которыми стоит водород. Включая каждого из нас. То есть без водорода не было бы и нас.
Хотите узнать, на что способен чистый водород? Тогда посмотрите на аварию дирижабля Гинденбург. Это была настоящая трагедия, виной которой был безумный водород.
Водород особняком стоит в периодической таблице химических элементов. Он изолирован от любого другого элемента и является единственным элементом, который не имеет ни одного нейтрона.
Если вы хотите игрушку, тогда используйте галлий. Это очень весело. Но если вы хотите почувствовать вкус настоящего безумия, ни один элемент не может быть более безумным, чем всем знакомый водород. Да, для всех нас водород – знакомый всем элемент, но это не меняет его свойства.
Открытие элементов 113, 115, 117 и 118: что это дает
Об авторе
Борис Жуйков — радиохимик, докт. хим. наук, зав. Лабораторией радиоизотопного комплекса Института ядерных исследований РАН, ранее много лет работавший в Лаборатории ядерных реакций ОИЯИ (Дубна), занимался исследованием свойств новых элементов.
Открытие новых элементов Периодической таблицы Менделеева всегда вызывало интерес у широкой публики. Дело даже не столько в научной значимости этих открытий, а в том, что в школе все проходили Периодический закон, и некоторые даже помнят символы, обозначающие элементы. Это понятно, знакомо. Но сейчас за этими открытиями стоят сложные исследования в ядерной физике и радиохимии, о которых многие не имеют представления.
В настоящее время новые элементы получают только на ускорителях тяжелых ионов. (Ранее их обнаруживали в земных минералах, продуктах ядерных реакторов и ядерных взрывов.) Тяжелыми ионами, ускоренными в циклотронах или линейных ускорителях, бомбардируют мишени из тяжелых элементов, и в результате реакции слияния с испусканием одного или нескольких нейтронов синтезируется новый элемент с порядковым номером (зарядом ядра) — суммой зарядов ядер налетающего иона и ядра мишени. Затем образующиеся ядра претерпевают радиоактивный распад. Для синтеза наиболее устойчивых изотопов выбирают такие комбинации ядер, в которых содержится по возможности большее число нейтронов и составные ядра имеют низкую энергию возбуждения. Выход получаемых тяжелых элементов чрезвычайно мал — отдельные атомы или десятки атомов, иногда за месяцы облучения на ускорителе. Период полураспада — секунды, а иногда и доли миллисекунд. Довольно сложно выделить ядра новых элементов из всей смеси образующихся продуктов ядерных реакций и правильно идентифицировать полученные продукты. Для этого создаются специальные установки, которые в результате регистрируют цепочку распадов с испусканием альфа-частиц и образованием изотопов более легких элементов, иногда цепочка оканчивается спонтанным делением ядра.

В нашей стране начиная с 1950-х годов работы по синтезу новых элементов на ускорителях тяжелых ионов проводились в Дубне под руководством акад. Г. Н. Флёрова (1913–1990) — основателя этого направления. Сейчас эти работы проводятся под научным руководством акад. Ю. Ц. Оганесяна. В мире существует лишь несколько ускорителей и установок, где можно получать трансактиноидные элементы (т. е. элементы с зарядом ядра Z более 103).
Последнее решение IUPAC (Международный союз теоретической и прикладной химии [1]) о признании открытия сразу четырех элементов — под номерами 113, 115, 117 и 118 — привлекло внимание российской общественности еще и потому, что приоритет в трех из них — 115, 117 и 118 — признан за российско-американской коллаборацией, включающей Лабораторию ядерных реакций им. Г. Н. Флёрова Объединенного института ядерных исследований (Дубна) (ФЛЯР ОИЯИ), Ливерморскую национальную лабораторию им. Э. Лоуренса (LLNL), Окриджскую национальную лабораторию (ORNL) и Университет Вандербильта. Приоритет в открытии элемента 113 признан за группой из японского ускорительного научного центра RIKEN.
Установление приоритета — непростая задача, так как неточности в первых сообщениях об открытии в какой-то мере неизбежны. Вопрос — какие неточности существенны, а какие можно принять и насколько выводы авторов обоснованны. Решение IUPAC основывалось на отчетах объединенной рабочей группы экспертов (Joint Working Party, JWP) [ 2, 3] и разработанных ранее критериях открытия. Согласно существующей практике авторам предоставляется право предложить названия новых элементов.

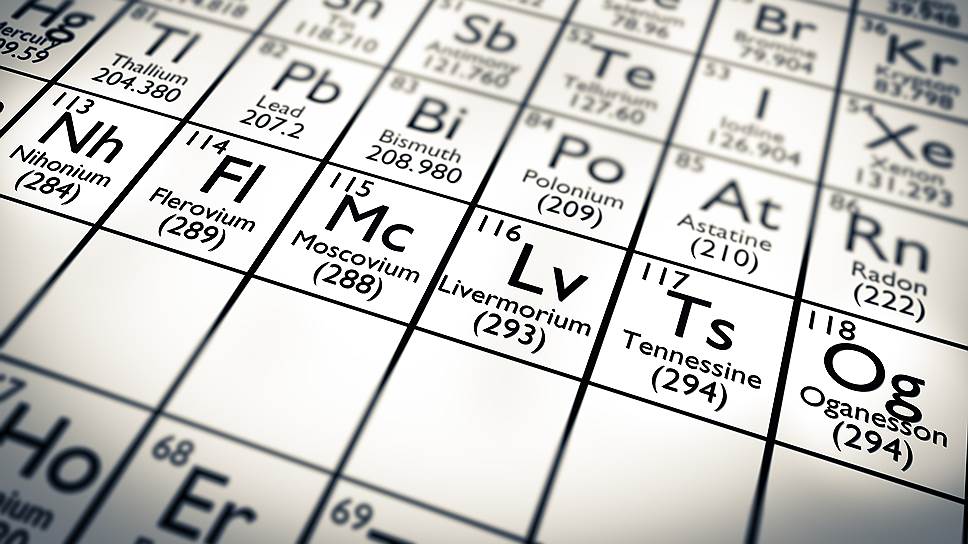
Элемент 113 предложено назвать нихонием (nihonium, Nh). Nihon — одно из двух названий Японии на японском языке, означающее «Страна восходящего солнца». Это первый элемент, открытый в Азии. Дубнинская группа оспаривала это первенство.
Приоритетные работы были опубликованы ФЛЯР ОИЯИ и RIKEN почти одновременно в 2004 году, группа из Дубны опубликовала работу даже несколько раньше. Для синтеза новых ядер в Японии использовали «холодную» реакцию слияния, бомбардируя изотопом цинка мишень из висмута 70 Zn + 209 Bi, с образованием изотопа 278 113 (время жизни — миллисекунды и десятые доли миллисекунд).
В Дубне применили более выгодную (с точки зрения выхода и периодов полураспада) ядерную реакцию ионов тяжелого изотопа кальция и америция 48 Ca + 243 Am, которая приводит к образованию изотопов 288 115 и 287 115. Эти радионуклиды, испуская альфа-частицы, распадаются сначала соответственно в 284 113 и 283 113 (время жизни — сотни миллисекунд), а затем по цепочке в долгоживущие изотопы элемента 105 (дубния, Db). 268 Db выделяли химически и затем регистрировали спонтанное деление.
Но промежуточные нуклиды в этих цепочках распада на тот момент не были известны, и их независимая физическая идентификация не проводилась. А химическое выделение и идентификацию Db на основе ионного обмена, проведенные в ФЛЯР ОИЯИ, объединенная рабочая группа посчитала неселективными и неубедительными. Также не были приняты во внимание попытки исследовать химические свойства элемента 113 методом газовой хроматографии, хотя этот метод ранее успешно использовался для изучения химии других трансактиноидных элементов. В результате заключили, что заявка Дубны в данном случае не соответствует критериям открытия элементов.
В то же время все промежуточные продукты распада синтезированного в Японии изотопа 278 113 (всего 3 события за 8 лет работы) были подтверждены, в том числе в специальных экспериментах в новом исследовательском центре по тяжелым ионам Ланжо в Китае. Таким образом, приоритет в открытии элемента 113 был признан за японской группой.
Элемент 115 был синтезирован в Дубне, и в честь региона, где расположен этот международный центр, авторами было предложено название московий (moscovium, Mc). Элемент получали опять же в ядерной реакции 48 Ca + 243 Am с образованием 287 115 и 288 115 (время жизни — десятки и сотни миллисекунд соответственно). Позднее был получен 289 115 и другие изотопы этого элемента. В отличие от первого цикла химических экспериментов, которые дубнинская группа проводила самостоятельно, позднее, в 2007 году, химическое выделение продукта распада — 268 Db осуществлялось уже с привлечением американских специалистов из Ливермора, и была достаточно убедительно доказана принадлежность этого элемента — продукта распада 115-го элемента — к V группе Периодической системы.
Более того, в 2013 году коллаборации из немецкого Центра исследований c тяжелыми ионами в Дармштадте (GSI) удалось повторить дубнинские результаты по получению изотопов элемента 115 в ядерной реакции 48 Ca + 243 Am. Таким образом, приоритет в открытии элемента 115 был признан за российско-американской группой.
Элемент 117 предложено назвать теннеcсин (tennessine, Ts) в честь американского штата Теннесси, где расположена Окриджская национальная лаборатория. Окончание в названии — по аналогии с астатином и другими элементами группы галогенов (на английском языке). Этот элемент также был синтезирован в Дубне, в ядерной реакции 48 Ca + 249 Bk. Роль американских коллег из Окриджа в основном состояла в изготовлении уникальной мишени берклия-249, который получали на высокопоточном реакторе в ORNL. В 2010–2013 годах было зарегистрировано всего 13 цепочек распадов 293 117 и 294 117, причем характеристики (время жизни и энергия альфа-распада) продукта распада 289 115 соответствовали данным, полученным ранее для этого радионуклида в другой ядерной реакции 48 Ca + 243 Am. По этой причине заявка на открытие этого элемента была признана отвечающей установленным критериям.
Элементу 118 авторами предложено название оганесон (oganesson, Og). Он должен являться аналогом радона и других инертных газов, и его открытие завершает седьмой период таблицы Менделеева. Этот элемент предложено назвать в честь Юрия Цолаковича Оганесяна за его пионерский вклад в исследование трансактиноидных элементов и важные ядерно-физические достижения в открытии сверхтяжелых ядер и исследовании «острова ядерной стабильности». В истории существовал только еще один пример, когда имя элемента присваивалось действующему ученому. Элемент 106 был назван в 1997 году сиборгием (Sg) в честь Гленна Сиборга (1912–1999), лауреата Нобелевской премии, автора открытия плутония и целого ряда трансплутониевых элементов.
В 2002–2012 годах в Дубне при облучении мишени 249 Cf ионами 48 Ca было обнаружено несколько событий образования 294 118 (время жизни — порядка 1 миллисекунды), сопровождающихся последовательным распадом 290 Lv (ливермория), 286 Fl (флеровия) и 282 Cn (коперниция). Время жизни и энергии альфа-частиц этих изотопов Fl и Cn были подтверждены американской коллаборацией на циклотроне в Беркли, поэтому объединенная рабочая группа рекомендовала признать открытие.
Следует отметить, что все вновь предложенные названия и символы элементов пока еще не утверждены IUPAC.
Какое значение имеет открытие этих новых элементов?
Вопрос «Сколько хлеба и угля это может дать?» абсолютно некорректен. Пользу от развития определенной ветви фундаментальной науки часто невозможно предсказать, и такого рода аргументы не должны тормозить ее развитие. Попытки заранее расписать доход и политические выгоды от научных открытий смехотворны. Соображения престижа также не должны как-то ограничивать развитие направления, потому что его истинное значение может раскрыться много позже. И наоборот, широко разрекламированные достижения могут не иметь никакого значительного продолжения. Вообще, наука должна руководствоваться своей логикой, а не логикой людей, далеких от нее. Общество должно доверять ученым, и «удовлетворение собственного любопытства за государственный счет» — это нормальное положение в данной области человеческой деятельности. И именно ученые, квалифицированные специалисты должны определять, на что следует тратить деньги, а что может подождать или вообще бесперспективно.
Другой вопрос, какое научное значение может иметь этот результат об открытии новых элементов. Что он изменяет в наших представлениях о структуре ядра и химических свойствах элементов вообще?
С физической точки зрения эти результаты могут иметь значение для лучшего понимания ядерной структуры и ядерного взаимодействия. С 1960-х годов бурно обсуждался вопрос о существовании так называемых островов стабильности в районе зарядов ядер Z = 114 и 126 как проявление оболочечной структуры ядер. Поэтому получение первых трансактиноидных элементов, которые имели гораздо больший период полураспада, чем предсказывалось старой «капельной» моделью строения ядра, было действительно принципиально важно. Сейчас в оболочечной модели никто не сомневается. Полученные результаты по новым элементам и новым изотопам позволяют уточнить существующие модели ядра и ядерных реакций. Хотя и не ожидается принципиально новых явлений, набор новых данных всегда полезен. Очевидно, что вершины острова стабильности существующими методами не достигнуть: просто нет таких комбинаций в ядерных реакциях — в получаемых изотопах не хватает нейтронов. Ранее много лет проводились попытки обнаружения в природных образцах СТЭ, которые были бы настолько долгоживущими, что могли остаться со времен образования Солнечной системы. Но эти попытки не увенчались успехом. Некогда заявленные результаты не нашли ни экспериментального, ни теоретического подтверждения.
С химической точки зрения ситуация несколько иная. Здесь действительно можно ожидать принципиально новых явлений. Дело в так называемых «релятивистских эффектах». В атомах с большим зарядом ядра электроны приобретают релятивистские скорости, и обычное уравнение Шрёдингера, используемое для описания атомов, уже не работает. В частности, знакомые всем «гантельки» р-электронов в VII-периоде претерпевают изменения, и одна из них превращается в шар. В результате электронная структура атомов меняется. У новых элементов возможно значительное отклонение химических свойств от экстраполированных по Периодической таблице и возникновение необычных химических свойств.
В отношении «релятивистских эффектов» существует много спекуляций, очевидно направленных на поднятие интереса к вопросу. Например, высказывалось предположение, что элемент 104 резерфордий (Rf) — формальный аналог титана, циркония и гафния — может оказаться p-элементом, по химическим свойствам близким к свинцу. Или заявлялось, что элемент 114 флеровий (Fl) — аналог свинца — может оказаться инертным газом. На самом деле при аккуратном рассмотрении выясняется, что, хотя атом Rf и имеет необычную конфигурацию внешней электронной оболочки (ds 2 p), по своим химическим свойствам это типичный d-элемент, аналог гафния. А Fl, обладая повышенной летучестью (как это следует и из любых экстраполяций), в конденсированном состоянии остается типичным металлом. Вообще, абсолютно некорректно любое отклонение от экстраполяции по Периодической системе приписывать «релятивистским эффектам»: оно может быть обусловлено совершенно другими причинами, например межконфигурационным взаимодействием.
Так или иначе, исследование релятивистских эффектов позволяет лучше понять и химические свойства давно известных и повсеместно применяемых элементов. Также это позволяет лучше разобраться в том, каким образом электронное строение атомов и молекул, которое можно рассчитать, определяет их конкретные химические свойства. Это до сих пор является далеко не до конца решенным вопросом. Дальнейшее продвижение по Периодической таблице может привести к образованию совсем новой группы элементов — g-элементов (начиная с элемента 121) с интересными свойствами. Все эти вопросы еще ждут подробного исследования.
Однако приходится отметить, что в последних открытиях исследования химических свойств новых элементов вообще не фигурируют (химически выделялся лишь продукт распада элемента 115 — элемент 105, Db, чтобы подтвердить конец цепочки распада). Но такое исследование трудно было провести ввиду низкого выхода и коротких периодов полураспада полученных изотопов. Тем не менее это возможно, хотя требует нового подхода к постановке химических экспериментов.
Открытие новых элементов дает еще один пример того, что значительные достижения российских ученых возможны в тесной коллаборации с учеными из США, Германии и других развитых стран. Именно такие работы и поднимают престиж нашей науки.