номер цинк в таблице менделеева
Цинк (Zn, Zincum)
История цинка
Цинк в чистом виде впервые выделил Уильям Чемпион в 1738 году, хотя латунь (сплав меди с цинком) использовали в Древнем Египте и Древней Греции (calorizator). Иногда первооткрывателем цинка называют немца С. Маргграфа, который в 1746 году разработал аналогичный способ выработки цинка и описал его более подробно, чем Чемпион.
Названием цинк обязан Парацельсу, в чьих трудах встречаются слова zincum и zinken, которыми назван металл, видимо, из-за схожести его кристаллитов с иглами (zinke – зубец).
Общая характеристика цинка
Цинк является элементом побочной подгруппы II группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 30 и атомную массу 65,39. Принятое обозначение – Zn (от латинского Zincum).
Нахождение в природе
Цинк достаточно распространённый элемент, он содержится в земной коре, практически во всех водных ресурсах Мирового Океана и во многих живых организмах. На сегодняшний день известно более 60-ти минералов цинка (сфалерит, цинкит, каламин и др.). крупные месторождения цинка обнаружены в Австралии, Боливии, Иране и Казахстане.
Физические и химические свойства
Цинк является хрупким, пластичным переходным металлом, имеет бело-голубоватый цвет, на воздухе покрывается слоем оксида цинка, что приводит к потускнению. При высоких температурах сгорает, образуя белый оксид цинка.
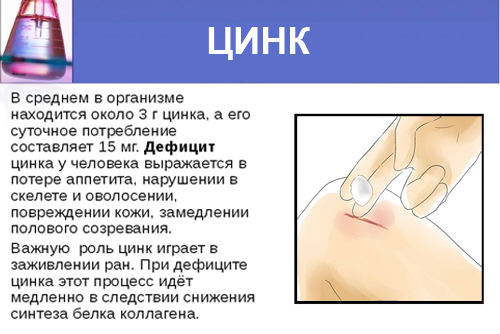
Суточная потребность в цинке
В сутки организм взрослого здорового человека должен получать от 9 до 11 мг цинка, дети – чуть меньше, от 2 до 8 мг, женщины в период беременности и кормления грудью – от 11 до 13 мг.
Продукты питания богатые цинком
Основные поставщики цинка – продукты питания, важный для жизнедеятельности организма элемент содержится в зелёных листовых овощах, брокколи, цветной капусте и редисе, моркови и кукурузе, зелёном луке, фасоли, горохе и чечевице, авокадо и ягодах, арахисе, кокосе, грецких и кедровых орехах, кунжуте, пшенице, овсянке и рисе. Присутствует цинк и в продуктах животного происхождения – свинине и баранине, говядине и индейке, мясе утки и говяжьем языке, морепродуктах и рыбе, плавленом сыре и яичном желтке.
Полезные свойства цинка и его влияние на организм
Функции и полезные свойства цинка:
Взаимодействие с другими
Признаки нехватки цинка
Нехватка цинка в организме человека характеризуется следующими симптомами:
Признаки избытка цинка
Избыточное содержание цинка в организме человека как правило обусловлено приёмом БАДов и препаратов цинка, характеризуется головными болями, приступами слабости и тошнотой.
Применение цинка в жизни
Цинк в чистом виде используется как восстановитель благородных металлов, как защита стали от коррозии, для производства аккумуляторов, в полиграфической промышленности, в медицине, производстве различных сплавов, резиновых шин и масляных красок.
Цинк Zn
Цинк в таблице менделеева занимает 30 место, в 4 периоде.
| Символ | Zn |
| Номер | 30 |
| Атомный вес | 65.3800000 |
| Латинское название | Zincum |
| Русское название | Цинк |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема цинка
Zn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Короткая запись:
Zn: [Ar]4s 2 3d 10
Порядок заполнения оболочек атома цинка (Zn) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Цинк имеет 30 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
Степень окисления цинка
Атомы цинка в соединениях имеют степени окисления 2, 1, 0.
Ионы цинка
Валентность Zn
Атомы цинка в соединениях проявляют валентность II, I.
Валентность цинка характеризует способность атома Zn к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Zn
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Новое в блогах
Цинк. Таблица Менделеева Д. И.
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк (CAS-номер: 7440-66-6) при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
История и происхождение названия
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в.
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium II. Это слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллы металлического цинка похожи на иглы).
Получение
Цинк в природе как самородный металл не встречается. Цинк добывают из полиметаллических руд, содержащих 1-4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50-60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожженный концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углем или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожженной глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьем. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка 99,95 %, полнота извлечения его из концентрата (при учете переработки отходов) 93-94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Собственная концентрация носителей заряда в цинке 13,1×1028 м-3
Кого, в своё время, не забавлял кусочек цинка брошенный в соляную кислоту? Пузырьки, шипение. водород. Ну, а если учитель вышел, на мгновение, а в кармане(по какой то случайности) оказались спички.
Короче, поговорим о цинке.
Так что же ты такое, цинк? Цинк в природе как самородный металл не встречается. Цинк это простое вещество которое при обычных условиях — хрупкий металл голубовато-белого цвета, тускнеющий на воздухе, покрываясь тонким слоем оксида цинка. Состав соединений цинка оставался неизученным вплоть до 18 века, хотя некоторые из них, например белый купорос (сульфат цинка), использовали для получения латуни, добавляя к расплаву меди вместе с порошком угля. В 1721 г. саксонский металлург Иоганн Фридрих Генкель (учитель Ломоносова) подробно описал цинк и его некоторые минералы и соединения.
Не занижая заслуги Генкеля стоит упомянуть, что о латуни упоминают многие авторы, в том числе Аристотель, который рассказывает о производстве латуни в стране моссинеков, но. Может Аристотель зачитывался приключениями аргонавтов? Кто же теперь узнает? «. проплыли страну страну моссинеков, живущих в деревянных домах, беспорядочно совокупляющихся и носящих неописуемой длины копья и белые щиты в форме листьев плюща. » Может речь о Колхиде.
В древнем мире производство латуни восходит, вероятно, ко II веку до н. э. Небольшие количества цинка, присутствующие в образцах древнеегипетской меди отражают состав местных руд, но для выплавки латуни, датируемой 1400–1000 гг до н.э. и содержащей около 23% цинка, уже должны были преднамеренно смешивать медную руду с цинковой. Что же касается производства металлического цинка, то есть основания полагать, что оно зародилось в Индии около 12 века. Латунь получали и на Кипре. Сплав цинка с медью был известен ещё в Древней Греции и Египте, в Индии (в 7 веке), Китае (в 11веке). Но долгое время не удавалось выделить чистый цинк. Почему? Да потому что при получение сплавов цинка из смешанных руд не требует выделения самого цинка. А вот китайские мастера овладели искусством выплавки цинка. Цинковые монеты использовались в годы правления династии Минь (1368–1644). Если говорить про средневековую Европу, то специального производства цинка ещё не было, хотя небольшие количества всё же получались при производстве свинца, серебра и латуни, поэтому ввозился индийский и китайский цинк.
Но история не стоит на месте. И в 1738 году англичанин Уильям Чэмпион запатентовал дистилляционный способ получения цинка, т.е. процесс перегонки металлического цинка из каламина с использованием древесного угля в плавильной печи, что послужило началу выплавки цинка в промышленном масштабе. И в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чэмпионом. Но во всей этой истории есть небольшой «душок». А дело в том, что в Германии, в 1746 году Андреас Сигизмунд Маргграф разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха, в глиняных огнеупорных ретортах(перегонных аппаратах) с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка.
И в двух словах, как всё быстренько-быстренько пошло в «гору». В 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка способом прокатки при 100—150 °C.
1 января 1905 году первый в России цинк был получен на заводе «Алагир» во Владикавказе(сейчас это завод «Электроцинк»). Первые заводы, где цинк получали электролитическим способом, появились в 1915 году в Канаде и США Сейчас известно 66 минералов цинка.
Цинк — энергичный водный «мигрант», особенно это характерно в термальных водах. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным «осадителем» для него является сероводород.
Что бы не занимать слишком много места и времени пропустим перечисления месторождений и процесс добычи цинка из полиметаллических руд(не-е-е, если кому надо, только «цинканите»).
Притормозим чуть на применении. Ну во первых; чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро), во вторых с помощью цинка извлекают то же золото и серебро из чернового свинца в виде интерметаллидов(химических соединений двух или более металлов) цинка. Не забудем и про оцинковку поверхностей для защиты от коррозии. Да-да самое обыкновенное ведро тоже его «рук» дело. Ну, а без оцинкованного днища какого ни будь авто и поста не было бы. Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах. Он вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Сплавы цинка с алюминием и магнием, благодаря сравнительно высоким механическим и очень высоким литейным качествам широко используются в машиностроении, а именно для точного литья. Кстати, в оружейном деле из некоторых сплавов, иногда, отливают затворы пистолетов, которые рассчитаны на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов(поэтому их в цветмет и не принимают). Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры. Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах. Перечислять можно до бесконечности.
Цинк играет и огромную биологическую роль.
В организме взрослого человека содержится в среднем около 2 г цинка, в виде его соединений, который концентрируется преимущественно в простате, мышцах, печени и поджелудочной железе. На этом чуть задержимся.
Цинк необходим для продукции спермы и мужских гормонов( а тут как ни крути, 50 миллилитрах человеческой спермы содержится около 10 миллиграммов цинка), необходим для метаболизма витамина E, необходим для расщепления алкоголя в организме, важен для нормальной деятельности простаты, участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста.
Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в тыквенных и подсолнечных семечках, кунжуте, мясе, сыре, овсяной крупе, бобовых, шоколаде, ну и на любителей, в устрицах. Цинк – одно из наиболее важных биологически активных элементов и необходим для всех форм жизни.
Цинк влияет на вкус и обоняние. Из-за нехватки цинка, необходимого для полноценного развития плода, многие женщины в первые 3 месяца беременности жалуются на капризы вкуса и обоняния.
Номер цинк в таблице менделеева
Цинк —элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк (CAS-номер: 7440-66-6) при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
История
Латинское zincum переводится как «белый налет». Происхождение этого слова точно не установлено. Предположительно, оно идет от персидского «ченг», хотя это название относится не к цинку, а вообще к камням. Слово «цинк» встречается в трудах Парацельса и других исследователей 16—17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Общеупотребительным название «цинк» стало только в 1920-х гг.
Нахождение в природе
Наиболее распространенный минерал цинка — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Видимо, за это минерал и называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Получение
Цинк в природе как самородный метал не проявляется. Цинк добывают из полиметаллических руд, содержащих 1-4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50-60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты.
От ZnO к Zn идут двумя путями. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожженный концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углем или коксом при 1200—1300 °С: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожженной глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьем. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка 99,95 %, полнота извлечения его из концентрата (при учете переработки отходов) 93-94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Химические свойства
Типичный амфотерный металл. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
Оксид цинка реагирует как с растворами кислот:
Цинк обычной чистоты активно реагирует с растворами кислот:
и растворами щелочей:
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и ее аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
Применение
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций). Также используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (ЭДС 1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм³, малое сопротивление и колоссальные разрядные токи, ртутно-цинковый элемент (ЭДС 1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм³), диоксисульфатно-ртутный элемент, йодатно-цинковый элемент, медно-окисный гальванический элемент (ЭДС 0,7—1,6 Вольт, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм³), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (ЭДС 1,82 Вольт, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм³), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др). Очень важна роль цинка в цинк-воздушных аккумуляторах, в последние годы интенсивно разрабатываются на основе системы цинк-воздух — аккумуляторы для компьютеров (ноутбуки) и в этой области достигнут значительный успех (большие, чем у литиевых батарей, ёмкость и ресурс, меньшая в 3 раза стоимость), так же эта система очень перспективна для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км). Входит в состав многих твёрдых припоев для снижения их температуры плавления. Цинк — важный компонент латуни. Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники.
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов»):
| Список стран по производству цинка |
|---|
Биологическая роль
Содержание в продуктах питания
Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах. Однако в тыквенных семечках содержится всего на 26 % меньше цинка, чем в устрицах. Например, съев 45 грамм устриц, человек получит столько же цинка, сколько содержится в 60 граммах тыквенных семечек.
0,25 мг/кг — яблоки, апельсины, лимоны, инжир, грейпфруты, все мясистые фрукты, зеленые овощи, минеральная вода.
2—8 мг/кг — малина, черная смородина, финики, большая часть овощей, большинство морских рыб, постная говядина, молоко, очищенный рис, свекла обычная и сахарная, спаржа, сельдерей, помидоры, картофель, редька, хлеб.
8—20 мг/кг — некоторые зерновые, дрожжи, лук, чеснок, неочищенный рис, яйца.
20—50 мг/кг — овсяная и ячменная мука, какао, патока, яичный желток, мясо кроликов и цыплят, орехи, горох, фасоль, чечевица, зеленый чай, сушёные дрожжи, кальмары.
30—85 мг/кг — говяжья печень, некоторые виды рыб.
130—202 мг/кг — отруби из пшеницы, проросшие зерна пшеницы, тыквенные семечки, семечки подсолнечника.


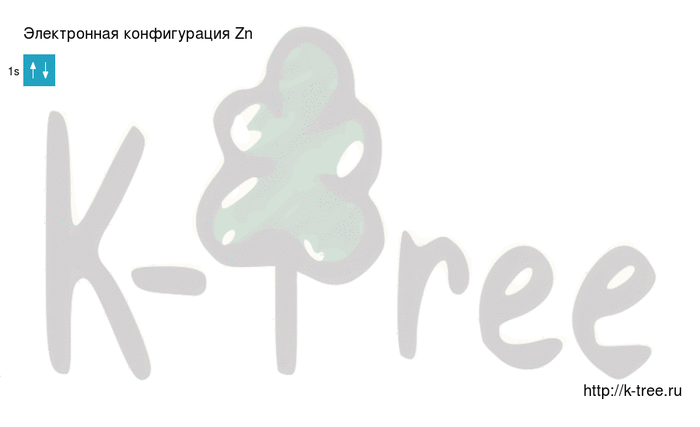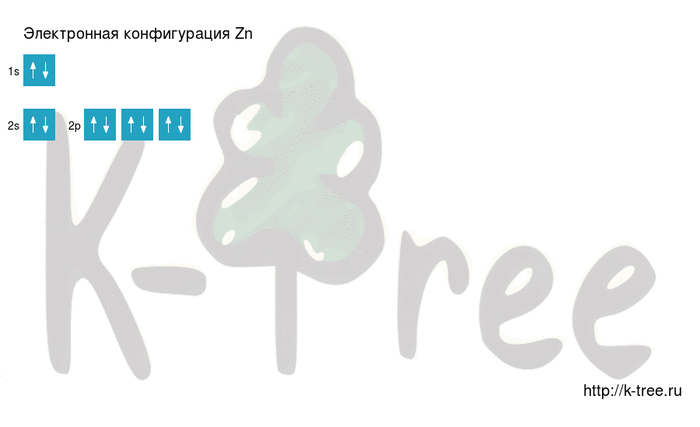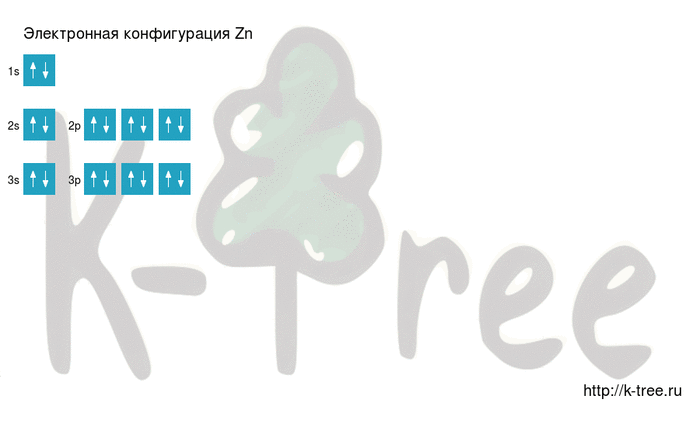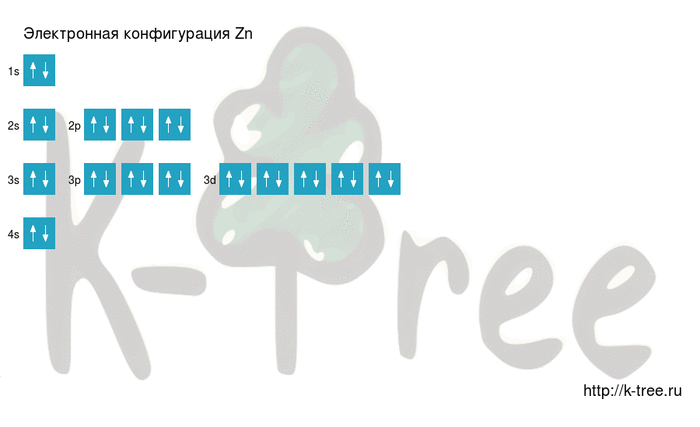



 Весь мир
Весь мир Китай
Китай Австралия
Австралия Перу
Перу США
США Канада
Канада Мексика
Мексика Ирландия
Ирландия Индия
Индия Казахстан
Казахстан Швеция
Швеция Россия
Россия Бразилия
Бразилия Боливия
Боливия Польша
Польша Иран
Иран Марокко
Марокко Намибия
Намибия Северная Корея
Северная Корея Турция
Турция Вьетнам
Вьетнам Таиланд
Таиланд Гондурас
Гондурас Финляндия
Финляндия ЮАР
ЮАР Чили
Чили Аргентина
Аргентина Болгария
Болгария Румыния
Румыния Япония
Япония Алжир
Алжир Саудовская Аравия
Саудовская Аравия Грузия
Грузия Босния и Герцеговина
Босния и Герцеговина Мьянма
Мьянма