гаплоидентичный донор что значит
Гаплоидентичная трансплантация стволовых клеток в онкогематологии.
Отсутствие идеальных донорских клеток, совместимых по человеческому лейкоцитарному антигену (HLA), ограничивает шансы на аллогенную трансплантацию у большого числа больных. Чтобы преодолеть это ограничение используются HLA-гаплоидентичные донорские клетки от ближайших родственников с последующим введением высокой дозы циклофосфамида.
Результаты метаанализа показали, что у пациентов, которым была произведена гаплоидентичная трансплантация от ближайших родственников с дальнейшим введением циклофосфамида, показатели смертности или рецидива были в среднем выше, чем при трансплантации стволовых клеток от ближайших совместимых родственников. При этом смертность от всех причин у таких пациентов была сравнима со смертностью пациентов, получивших клетки от совместимых неродственных доноров и была ниже, чем смертность пациентов после трансплантации от несовместимых неродственных доноров. Риск рецидива после гаплоидентичной трансплантации от ближайших родственников был повышен у пациентов с лимфомами, но практически не отличался у пациентов с лейкозами, при сравнении с исходами после трансплантации от совместимых неродственных доноров.
Таким образом, данный метод лечения представляется приемлемым и более предпочтительным, чем трансплантация от несовместимых неродственных доноров. Гаплоидентичные стволовые клетки также являются наиболее доступными, что особенно важно в случаях, когда запас времени для поиска донора ограничен. Исследователи рекомендуют провести проспективное сравнение данного метода с трансплантацией от совместимых неродственных доноров.
Источник: JAMA Oncol. 2019 Oct 17. doi: 10.1001/jamaoncol.2019.3541. [Epub ahead of print]
Haploidentical Stem Cell Transplantation With Posttransplant Cyclophosphamide Therapy vs Other Donor Transplantations in Adults With Hematologic Cancers: A Systematic Review and Meta-analysis.
IMPORTANCE:
Use of haploidentical (HAPLO) stem cell transplantation with posttransplant cyclophosphamide is rapidly increasing in adults with hematologic cancers. However, its specific role compared with other transplant strategies has yet to be identified.
OBJECTIVE:
To synthesize the existing evidence regarding outcomes of stem cell transplantations comparing HAPLO stem cell transplantation and posttransplant cyclophosphamide therapy with transplantations from matched related donors (MRDs), matched unrelated donors (MUDs), or mismatched unrelated donors (MMUDs).
DATA SOURCES:
PubMed, Cochrane Library, ClinicalTrials.gov, and meeting abstracts were searched for the key words haploidentical and cyclophosphamide from inception through March 1, 2019.
STUDY SELECTION:
Studies comparing HAPLO stem cell transplantation and posttransplant cyclophosphamide therapy with transplantations from other donors in adults with hematologic cancers were eligible for meta-analysis.
DATA EXTRACTION AND SYNTHESIS:
Pooled odds ratios (ORs) and 95% CIs were calculated using a random-effects model.
MAIN OUTCOMES AND MEASURES:
Main outcomes were all-cause mortality, nonrelapse mortality, and relapse.
RESULTS:
A total of 30 studies including 22 974 participants were analyzed. HAPLO stem cell transplantation with posttransplant cyclophosphamide therapy was associated with increased all-cause mortality compared with MRDs (OR, 1.17; 95% CI, 1.05-1.30), similar all-cause mortality compared with MUDs (OR, 1.06; 95% CI, 0.96-1.18), and reduced all-cause mortality compared with MMUDs (OR, 0.75; 95% CI, 0.61-0.92). Regarding nonrelapse mortality, HAPLO stem cell transplantation with posttransplant cyclophosphamide was associated with worse outcomes compared with MRDs (OR, 1.20; 95% CI, 1.04-1.40) but better outcomes compared with MUDs (OR, 0.75; 95% CI, 0.61-0.92) and MMUDs (OR, 0.51; 95% CI, 0.25-1.02). In terms of relapse, HAPLO stem cell transplantation with posttransplant cyclophosphamide was associated with similar outcome compared with MRDs (OR, 1.01; 95% CI, 0.86-1.17) and MMUDs (OR, 1.06; 95% CI, 0.77-1.47) but showed increased relapse compared with MUDs (OR, 1.20; 95% CI, 1.03-1.40).
CONCLUSIONS AND RELEVANCE:
Results of this meta-analysis suggest that MRDs, if available, remain the optimal donors regarding mortality and HAPLO stem cell transplantation with posttransplant cyclophosphamide may be preferred over MMUDs. Prospective comparisons with MUDs are needed.
Нет совместимого донора? Больше не приговор!
В последнее десятилетие получил распространение такой вид трансплантации костного мозга, при котором трансплантируют наполовину HLA-совместимые стволовые клетки.
О новом виде трансплантации и о внедрении его в Центре Алмазова рассказал врач-гематолог отделения химиотерапии онкогематологических заболеваний и трансплантации костного мозга № 2 к.м.н., Дмитрий Васильевич Моторин.
С чего все начиналось
Первые трансплантации костного мозга (ТКМ) в Центре Алмазова стали проводить в конце 2009 года. На станции переливания крови с помощью Галины Ивановны Петренко были освоены методики фракционирования костного мозга, замораживания стволовых клеток, хранения их в азоте, чтобы в дальнейшем можно было использовать эти клетки для трансплантации. В 2009 году было сделано всего 8 трансплантаций, тогда как в настоящее время в Центре Алмазова выполняется примерно по 100 пересадок в каждом из двух гематологических отделений.
Первыми были аутологичные трансплантации
Аутологичными называются пересадки, при которых пациенту пересаживается его собственный костный мозг, заготовленный в периоде ремиссии. В дальнейшем, после проведения высокодозной химиотерапии, аутологичные стволовые клетки возвращаются обратно пациенту, чтобы ускорить восстановление гемопоэза. Именно с проведения аутологичных пересадок мы и начинали. В настоящее время технология ауто-ТКМ у нас хорошо отработана. Такие пересадки составляют около 60% от всего объёма трансплантаций и применяются как при опухолевых заболеваниях (чаще всего миелома и лимфомы), так и при аутоиммунных заболеваниях (системная склеродермия, системная красная волчанка).
В 2011 году начали проводить уже аллогенные пересадки. При этом виде трансплантаций в качестве источника стволовых клеток используются клетки донора. Это должен быть либо родственный донор — сиблинг, полностью совместимый по антигенам гистосовместимости HLA (брат или сестра), либо неродственный донор, которого ищут в донорском регистре.
«Поиск донора сопряжен с определенными трудностями. По европейской статистике пациент имеет примерно 30% шансов найти родственно совместимого донора. В остальных случаях приходится искать донора в регистре — шансы найти там донора примерно такие же — около 30%. Но даже если подходящий человек найден, еще не факт, что он станет донором. До непосредственного донорства доходит только четверть доноров. В России ситуация с донорским регистром непростая — он пока еще не очень большой, около 80 000 доноров. К тому же генетическая разнородность населения России очень большая. Если для людей, живущих в европейской части, шанс найти донора более высокий, то для пациентов, например, из Хакасии, Бурятии, Якутии, Дагестана или Чечни — шансы найти полностью совместимого донора в регистре намного меньше», — подчеркнул гематолог.
Мы знаем, что при многих онкогематологических заболеваниях аллогенная трансплантация — это единственный шанс на излечение. И чем быстрее пересадка будет проведена, тем эффективнее будет лечение. Фактор времени очень важен, а с того момента, когда донор в регистре найден, до реального забора стволовых клеток и доставки может пройти 3–4 месяца, а если донор из международного регистра, то и до полугода.
Гаплоидентичная трансплантация костного мозга
Первый пациент Центра Алмазова, которому была проведена гаплотрансплантация в 2014 году и врач-гематолог к. м. н. Д. В. Моторин
Настоящей революцией в терапии стала гаплоидентичная трансплантация. Например, если у пары несколько детей, но они полностью между собой не совместимы по HLA-антигенам, то все равно у каждого ребенка один набор хромосом («гаплотип») от мамы, а второй от папы. Значит — любой ребенок может быть потенциальным гаплоидентичным донором как для отца, так и для матери, а оба родителя — донорами для своих детей. Также повышается вероятность, что дети между собой совместимы по материнскому или отцовскому гаплотипу. Кроме этого, донорами могут стать даже родственники второй линии (тети, дяди, племянники или бабуши и дедушки). Таким образом, шансы найти донора стали более 90%.
Что помогло внедрить этот метод?
Гаплоидентичная ТКМ имеет ряд трудностей — высокая частота отторжения трансплантата, реакция «трансплантат против хозяина» (РТПХ) и повышенный риск инфекционных осложнений. «Упрощая, можно сказать, что большой проблемой при гапло-ТКМ являются цитотоксические лимфоциты — это лимфоциты, которые сохраняются в трансплантате и могут атаковать организм пациента, а также собственные цитотоксические лимфоциты пациента, которые, в свою очередь, могут атаковать трансплантат», — объяснил Д. В. Моторин.
Применение высоких доз алкилирующего химиопрепарата — циклофосфамида в раннем посттрансплантационном периоде позволило производить элиминацию (удаление) от активированных цитотоксических лимфоцитов in vivo, что и открыло возможности для проведения гаплоидентичной трансплантации костного мозга.
И лишь в XXI веке выяснилось, что циклофосфан — это отличный метод профилактики реакции «трансплантат против хозяина». Это заложило основы для проведения в дальнейшем гаплоидентичной трансплантации костного мозга.
В Центре Алмазова накоплен самый большой опыт по гаплотрансплантациям у взрослых в России
Гаплотрансплантаций у взрослых в России делают очень мало. Это связано с тем, что требуется целый ряд условий: наличие стерильных боксов с ламинарным потоком воздуха, высокотехнологичные лаборатории для обследования и мониторинга больных, особый уход за пациентами после трансплантации и наблюдение за ними после выписки и, главное, высококвалифицированные специалисты, необходимые на всех этапах лечебного процесса.
«Центр Алмазова является учреждением полного цикла. Например, пациент в прогрессии острого миелобластного лейкоза или в рецидиве. Мы его вводим в ремиссию с помощью химиотерапии, за это время мы успеваем обследовать донора. После достижения ремиссии ему выполняется пересадка. И дальнейшее наблюдение мы можем тоже проводить у себя. Получается весь цикл ведения пациента. Отделений полного цикла, способных проводить все виды ТКМ, в России очень мало. Наши результаты по гапло-ТКМ схожи с результатами европейских и американских коллег», — подчеркнул Дмитрий Васильевич.
При этом, по нашим наблюдениям, данные общей выживаемости после гапло-ТКМ сравнимы с данными трансплантаций от полностью HLA-совместимых доноров, а в чем-то даже их превосходят. На данный момент доля гапло-ТКМ, выполняемых в Центре Алмазова, составляет 80–90% от всех аллогенных трансплантаций.
«Внедрение метода гапло-ТКМ стало прекрасным решением, дающим шанс на выздоровление тем пациентам, которым раньше мы были не способны помочь. С 2014 года, после внедрения у нас гапло-ТКМ, около 75% пациентов с острым миелобластным лейкозом, имеющих показания к ТКМ, получают этот вид лечения. Средний срок от выявления показаний к ТКМ до самой трансплантации составляет в этой группе пациентов около 1,5 месяцев, и это хороший результат, которым мы можем по праву гордиться», — сказал Дмитрий Васильевич.
Гаплоидентичный донор что значит
Спасти свою половинку: как возможны гаплоидентичные трансплантации
Никто не возьмется за неродственную пересадку костного мозга при совпадении менее восьми генов из десяти. А при родственной достаточно и пяти. Как так?
В «элементарной теории трансплантации» есть один парадокс. Обычно врачи стараются найти неродственного донора, который совпадает с реципиентом по девяти или десяти генам тканевой совместимости. В самом крайнем случае – по восьми. Но если речь о родственниках, работают другие законы: отец или мать все чаще становятся донорами для ребенка, хотя они с ним совпадают обычно лишь по пяти генам из десяти. Эту странность нелегко объяснить.
То вместе, то поврозь
Может ли так получиться, что у ребеночка губы будут как у мамы, а, скажем, уши – как у папы? То есть насколько независимо друг от друга наследуются эти признаки? Точного ответа нет, но теоретически найти его можно. Для этого нужны прежде всего две вещи: понять, от каких генов зависит форма губ и ушей, и выяснить, как далеко друг от друга расположены в человеческом геноме эти гены. Нахождение на одной хромосоме сильно повышает вероятность того, что они будут унаследованы вместе. И вероятность еще увеличивается, если на этой хромосоме гены расположены близко друг к другу. Близость важна, потому что мы не передаем хромосому по наследству целиком.
При образовании половой клетки две парные хромосомы обмениваются друг с другом отдельными участками. И если гены недалеко друг от друга, то они вряд будут разделены при этом обмене.
Гены тканевой совместимости (их принято называть HLA) как раз такие: они очень компактно расположились на одной хромосоме – шестой.
Хотя бывает и так, что некий гражданин, получив от своих папы и мамы два набора HLA, передает ребенку гибрид – кусочек одного набора плюс кусочек другого. Но – редко. Обычно нам достается целиком один из HLA отца (фактически HLA от бабушки или дедушки по отцовской линии) и один из HLA матери. Каждый из этих наборов называется гаплоидным. А мы с нашими родителями гаплоидентичны – совпадаем по одному из наборов. Генов, так или иначе связанных с иммунитетом, много, больше сотни. Но для успеха трансплантации важнее всего пять: A, B, C, DR и DQ. Одна из таких пятерок у нас с каждым из родителей общая, а вторая – нет.
Как все начиналось
Вообще с гаплоидентичными донорами костного мозга поначалу были одни проблемы. Так что использовать их стали намного позже всех прочих. Примерная хронология развития трансплантации аллогенных (то есть донорских) кроветворных клеток выглядит так.
– В начале 1950-х костный мозг начали пытаться пересаживать мышам: было замечено, что иногда это помогает выжить грызунам, получившим дозу радиации.
– В конце 1950-х первые в мире «человеческие» трансплантации провел американец Эдвард Донналл Томас, он же доктор Дон. Донорами для двух девочек-реципиентов стали их сестры-близнецы, а результат был, мягко говоря, не очень. Уточню на всякий случай: иногда пишут, что примерно в те же годы француз Жорж Мате провел и первые удачные неродственные трансплантации молодым физикам, пострадавшим при аварии атомного реактора. Но это не так, время для таких удач еще не пришло – Кровь5 об этом рассказывала.
– В конце 1960-х прошли первые удачные пересадки костного мозга от сиблингов. Про гены как носители наследственной информации тогда уже знали, но понять, какие из них отвечают за тканевую совместимость, да еще и сравнить эти гены у разных людей не могли.
Тканевую совместимость проверяли экспериментально, в пробирке – это позволяло подобрать подходящего для пересадки сиблинга.
– В течение 1970-х шло наступление по всем фронтам – генетическому, медицинскому, фармацевтическому, технологическому, и в результате в конце 1970-х стало быстро расти количество неродственных трансплантаций, а вместе с ним и регистры доноров.
– В конце 1970-х были и первые попытки гаплоидентичных трансплантаций. Идея использовать в качестве доноров родителей или детей выглядела заманчиво, но на этом направлении врачей преследовали неудачи. Только к началу 2000-х годов развитие технологий позволило ввести гаплотрансплантации в медицинскую практику.
Хороший, плохой, злой
Проблема гаплотрансплантации – в неполной тканевой совместимости родителей и детей. Гены HLA кодируют белки на поверхности клеток, по которым иммунная система опознает, свой это или чужой. У родителей и детей эти гены, как ни крути, сильно различаются.
Гаплотрансплантацией врачи начали интересоваться скорее из организационных соображений. У большинства детей есть родители, которые всегда доступны и готовы пожертвовать им что угодно.
Возможна пересадка и от ребенка родителю. Наполовину совпадающий HLA имеют в половине случаев и сиблинги. Могут быть гаплоидентичными и другие родственники. В одной из работ, посвященных таким трансплантациям, утверждается, что у 95% нуждающихся в трансплантации есть по крайней мере один гаплоидентичный донор. А у «среднего пациента» таких доноров более двух.
Неполное совпадение донора и реципиента по HLA чревато реакцией «трансплантат против хозяина» (РТПХ) и отторжением. Но постепенно медики выработали технологии борьбы с этими проблемами. В России детскими гаплоидентичными трансплантациями сейчас много занимаются в московском НМИЦ имени Дмитрия Рогачева, а взрослыми – в НМИЦ имени В.А. Алмазова в Петербурге.
В проблемах гаплоидентичной пересадки виноват иммунитет, и прежде всего одно из главных действующих лиц этой системы – Т-лимфоциты. Донорские лимфоциты вызывают реакцию РТПХ: для них ткани нового хозяина – враг, которого надо уничтожить. А собственные лимфоциты реципиента, выжившие после уничтожения его костного мозга, могут вызвать отторжение трансплантата. Если же пытаться утихомирить лимфоцитов, пациент останется без защиты от всевозможных инфекций.
Вопрос, каким образом врачи решают эту проблему, слишком специальный, чтобы пытаться даже поверхностно в нем разобраться. В основном речь идет о лекарственной терапии. Но есть и более изощренные, удивительные способы, почитать о них можно в уже упоминавшейся работе. Перескажу ее в двух словах.
Каждый лимфоцит имеет строго определенного врага, против которого он умеет бороться. Поэтому одна из возможностей – «искусственный отбор» донорских лимфоцитов, которые направлены против патогенов, но не враждебны по отношению к тканям реципиента.
Один из методов состоит в том, что лимфоциты донора и реципиента совместно культивируются в пробирке. И из этой смеси по ряду признаков отбираются те донорские лимфоциты, которые не опасны для реципиента.
Возможно также уничтожение «наивных» Т-лимфоцитов донора. То есть лимфоцитов, которые еще не встречались с патогенами и от которых, грубо говоря, можно ждать любого подвоха, в том числе и нападения на здоровые клетки реципиента. Возможна работа с регуляторными Т-лимфоцитами, с тем чтобы направить их регуляторную активность в нужное для выживания пациента русло.
Все эти ухищрения приносят плоды. По данным НМИЦ имени Алмазова, где доля гаплотрансплантаций среди всех аллогенных составляла в разные годы 80–90%, выживаемость после гаплопересадок сравнима с исходом неродственных полностью совместимых трансплантаций. О том, что исход трансплантаций костного мозга (ТКМ) от «полусовместимых» родственников и HLA-совместимых неродственников примерно одинаков, говорит и Университет Джонса Хопкинса.
Любопытство и практика
Если схемы «полусовместимой» пересадки так здорово разработаны, почему бы не применить их в неродственном донорстве? У трансплантологов этот как будто очевидный вопрос просто не возникает. Они исходят не из формальной логической схемы, а из практики.
Пересадка от неродственного донора с пятью-семью совпадающими генами – неизведанное поле. Одно дело – рисковать, когда есть всегда доступный родственник, который, если понадобится, пойдет и на повторную донацию. И другое – искать донора с не очень хорошим совпадением, чтобы затем подвергнуться еще не исследованным опасностям.
– Проведение аллогенной трансплантации от неродственного HLA-несовместимого донора сопряжено с увеличением токсичности трансплантации, а также увеличением затрат на обработку трансплантата, что делает этот вид трансплантации практически неиспользуемым, – говорит Лариса Шелехова, заведующая отделением трансплантации гемопоэтических стволовых клеток НМИЦ имени Дмитрий Рогачева.
Дело еще и в том, что гаплоидентичный родственник и просто некто совпавший с больным по пяти генам HLA – это в медицинском плане не одно и то же.
– Помимо основных генов тканевой совместимости, от которых прежде всего зависит успех трансплантации, есть так называемые минорные гены, их совпадение при гаплоидентичной ТКМ увеличивает шансы на успех, – говорит гематолог из НМИЦ имени В.А. Алмазова Дмитрий Моторин.
– При гаплоидентичной ТКМ помимо основных генов тканевой совместимости совпадают и какие-то другие биохимические системы донора и реципиента, – объясняет руководитель Республиканского центра иммунологического типирования тканей в Санкт-Петербурге Людмила Бубнова.
Насколько ухудшится результат, если вместо гаплосовместимого родственника взять неродственника с таким же количеством совпадений в главной десятке генов? Увы, для медиков и этот вопрос не имеет практического смысла. Опасности неполного совпадения хорошо известны, и экспериментировать в этой сфере никто не собираются.
Но есть более важный для потенциальных доноров вопрос: а не получится ли так, что гапло-ТКМ, для которой почти у каждого найдется донор-родственник, постепенно вытеснит неродственную трансплантацию, так что и регистры с их миллионами доноров в конце концов окажутся не нужны?
Сравнительных исследований неродственных полностью совместимых и гапло-ТКМ пока немного. В вышедшем пару лет назад метаисследовании обобщаются их выводы. Авторы нашли примерно десяток заслуживающих внимания работ на эту тему. Их общий результат: существенных различий в выживаемости после гапло- и неродственной пересадки не наблюдается. Но количество изученных случаев гаплотрансплантаций пока недостаточно для окончательных выводов, история таких трансплантаций слишком коротка, а о рандомизации в этих исследованиях нет и речи: гаплопересадка все-таки чаще используется тогда, когда невозможно быстро найти HLA-совместимого неродственного донора.
У неродственных ТКМ долгая история развития – почти 50 лет против 20 лет у гаплоидентичных. И полученный гандикап отчасти сохраняется: неродственные трансплантации по-прежнему лучше изучены.
Неродственные ТКМ предоставляют некоторые возможности, недоступные гаплопересадкам, отмечают авторы исследования.
Например, если для реципиента нашлось сразу несколько доноров – для распространенных генотипов это не редкость, – можно учесть другие важные при трансплантации факторы.
Пол (мужчина-донор обычно предпочтительнее женщины), совпадение по группе крови, резус-фактору, цитомегаловирусному статусу.
– Даже с течением времени неродственное донорство останется востребованным, – уверен Кирилл Киргизов, заместитель директора по научной и образовательной работе НИИ детской онкологии и гематологии НМИЦ онкологии имени Н.Н. Блохина. – Трансплантация проводится не только при лейкозах, но и при многих не злокачественных заболеваниях: первичных иммунодефицитах, так называемых болезнях накопления (мукополисахаридозах) и других. В этих случаях неродственный донор выглядит несколько предпочтительнее, чем гаплоидентичный. Может также быть, что у человека детей нет, а родители уже пожилые и их нельзя использовать в качестве доноров. Есть и другие случаи, когда гаплотрансплантация невозможна. Например, у отца ребенка гепатит, а мать беременна. Кроме того, во многом выбор донора зависит от конкретного медицинского центра.
А вообще гаплоидентичная и HLA-совместимая ТКМ – не конкуренты, а два варианта лечения. Каждый из них может дать шанс на спасение. И хотя среди врачей есть и убежденные сторонники, и противники гаплотрансплантации, трудно представить себе, что в обозримом будущем какой-то один из методов вытеснит другой.
Гаплоидентичный донор что значит
Одним из основных факторов, определяющих успешность выполнения алло-трансплантации гемопоэтических стволовых клеток, является подбор совместимого с реципиентом по HLA-системе донора гемопоэтических стволовых клеток.
Гены HLA-комплекса человека (эквивалент МНС у животных), содержащие более 200 генов, расположены на коротком плече хромосомы 6. Из них только около 40 генов играют центральную роль во многих иммунологических реакциях, обеспечивая кодирование антигенов гистосовместимости (трансплантационные антигены) HLA-системы человека I и II классов, которые различны структурно и функционально.
Антигены HLA-системы I класса представлены а-и b-цепями и имеют около 20 подклассов, основными из которых являются локусы А, В и С. Антигены HLA-системы II класса включают D-регион, специфичность внутри которого определяют 15 генов, в свою очередь разделенных на субрегионы DR, DQ, DP, DM и DO. В зависимости от варианта кодируемой полипептидной цепи (а-цепь и b-цепь) субрегионы принадлежат к подклассу А или В, индивидуальные гены имеют порядковый номер, например DRB1.
При подборе донора для алло-ТГСК наиболее важным является субрегион DR HLA-системы. Около 36 генов кодируют III класс HLA-системы. Они представлены компонентами системы комплемента С2, С4, Bf, структурными генами 21-гидролазы и а- и р-фактора некроза опухоли (ФНО). Роль «малых» антигенов гистосовместимости (mН) для алло-ТГСК в настоящее время изучается.
Типирование антигенов HLA-системы I и II классов осуществляется с помощью специальных иммунных сывороток в стандартном двухступенчатом ком-плементзависимом лимфоцитотоксическом тесте, молекулярно-биологическими способами. Антигены распределяются в соответствии с рекомендациями Комитета по HLA-номенклатуре ВОЗ.
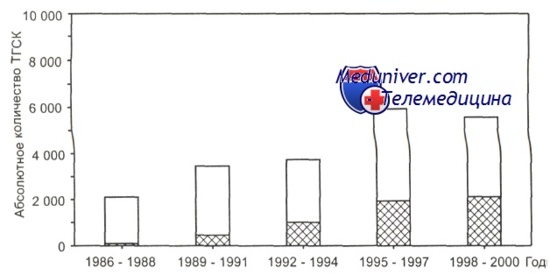
Светлая часть столбиков — гемопоэтические стволовые клетки от родственных доноров, заштрихованная — от неродственных доноров. За 2000 г. данные неполные.
Определение степени совместимости донора и реципиента по HLA-системе II класса возможно в смешанной культуре лимфоцитов (MLC —mixed lymphocyte culture). В настоящее время этот тест не используется ввиду широкого применения типирования антигенов II класса с помощью ПЦР (низкоразрешающее типирование антигенов). Высокоразрешающее типирование до аллелей выполняют с помощью определения полиморфизма рестрикции фрагментов генов (RFLP — restriction fragment length polymorphism analysis), гибридизацией со специфическими олигонуклеотидами (SSO — hybridisation with sequence-specific oligonucleotide conformation polymorphism) и ПЦР со специфическими праймерами (SSP — sequence-specific primer amplification).
Идентичность донора гемопоэтических стволовых клеток с реципиентом по HLA-системе I и II классов подтверждает наличие полностью совместимого донора. Несовпадение по 1, 2 и 3 антигенам HLA-системы свидетельствует о частично совместимом доноре гемопоэтических стволовых клеток. Различие донора и реципиента по антигенам HLA-системы I и II классов одного гаплотипа рассматривается как гаплоидентичная совместимость.
Гаплотип — последовательность антигенов HLA-системы, сцепленно передающаяся ребенку от каждого из родителей. Полный набор у здорового человека состоит из двух гаплотипов I и II классов HLA-системы.
Как правило, донором гемопоэтических стволовых клеток является совместимый по HLA-системе здоровый человек. Различия по группе крови и полу не имеют решающего значения при выборе донора гемопоэтических стволовых клеток. Для доноров не существует биологических ограничений по возрасту, за исключением юридических постановлений и состояния здоровья. В литературе упоминается о самом молодом родственном доноре костного мозга, возраст которого в момент заготовки гемопоэтических стволовых клеток составил 4 мес, а масса тела — 3,95 кг. Родственный донор в этом случае может быть использован с согласия родителей только для сиблинга (брат, сестра) и ни при каких обстоятельствах для иных родственников. При всех других вариантах родственным или неродственным донором может быть только человек, достигший 18 лет.
В случае отсутствия полностью совместимого донора гемопоэтических стволовых клеток обсуждается использование частично совместимого по 1, 2 или 3 антигенам HLA-системы донора. Предпринимаются попытки внедрения алло-трансплантации гемопоэтических стволовых клеток от гаплоидентичного донора не только у детей с тяжелым врожденным иммунодефицитным состоянием, но и у больных острыми лейкозами, хроническим миелолейкозом.
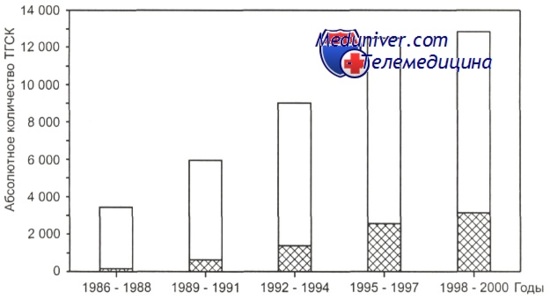
Светлая часть столбиков — родственные трансплантации гемопоэтических стволовых клеток, заштрихованная — неродственные трансплантации гемопоэтических стволовых клеток. За 2000 г. данные неполные.
При проведении гаплоидентичной алло-трансплантации гемопоэтических стволовых клеток особое значение приобретает типирование С-локуса I класса HLA-системы. На основании этого различия достаточно легко определяется донор, обладающий свойством аллореактивности естественных киллеров (NK-alloreactivity) по отношению к клеткам реципиента, что имеет большое значение для профилактики рецидива.
Родственным донором гемопоэтических стволовых клеток наиболее часто является родственник по горизонтали (брат, сестра), поскольку наследование генов HLA-системы от родителей к детям происходит по кодоминантному типу. Потомки получают по одному гаплотипу от родителей, и, следовательно, при наличии 5 сиблингов двое из них будут обязательно совместимыми. Расчетная вероятность обнаружения полностью совместимого сиблинга в семье не имеет прямо пропорционального характера и равна 25 % при наличии одного сиблинга, 43,7 % —двух, 57,8 % — 3 сиблингов. В редких случаях донора ГСК находят при обследовании родственников по вертикали (отец, мать и др.). Таким образом, подбор родственного донора гемопоэтических стволовых клеток существенно ограничен при общей тенденции к снижению рождаемости.
Только 30 % больных в мире (в России 10—15 %) при показаниях к выполнению алло-трансплантации гемопоэтических стволовых клеток имеют совместимого по HLA-системе родственного донора. В связи с этим большое значение приобретает развитие сети регистров неродственных доноров костного мозга, здоровых лиц, на добровольных началах согласных на эксфузию костного мозга или заготовку концентратов гемопоэтических стволовых клеток из крови. В мире насчитывается около 60 регистров в 50 странах с общим числом потенциальных доноров костного мозга более 10 000 000. Самым большим является Северо-Американский регистр доноров костного мозга, имеющий информацию о более чем 5 000 000 доноров (USA National Marrow Donor Program — NMDP).
Динамика изменения спектра алло-трансплантации гемопоэтических стволовых клеток в зависимости от доноров гемопоэтических стволовых клеток (родственные, неродственные) представлена на рисунках.
Наряду с регистрами доноров гемопоэтических стволовых клеток существуют банки пуповинной крови. Самые большие банки этих образцов находятся в США, Испании, Италии и Австралии.
Все данные, полученные в результате тканевого типирования доноров гемопоэтических стволовых клеток и образцов заготовленной пуповинной крови, аккумулируются в базе данных регистров, информация из которых поступает в национальные регистры, а затем в международную базу данных. Эта информация в любое время может быть использована для поиска неродственных доноров гемопоэтических стволовых клеток.
Несмотря на большое количество зарегистрированных в мире потенциальных доноров, вероятность обнаружения неродственного донора гемопоэтических стволовых клеток составляет до 80 % для больных из европейских групп населения и 30 % для пациентов других, особенно редких, национальностей, что делает чрезвычайно актуальным развитие программы трансплантации гемопоэтических стволовых клеток от доноров с различной степенью несовместимости по HLA-системе. Население России имеет промежуточную вероятность (до 70 %) при поиске неродственного донора в международной базе данных, что связано с многонациональным характером населения и большим количеством смешанных браков.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

