гамма интерферон человека что это антитела к гамма интерферону
Иммунотропные свойства анаферона и анаферона детского
Опубликовано в журнале:
«Антибиотики и химиотерапия», 2013, ТОМ 58, № 5-6, с. 17-23
Е. С. ЖАВБЕРТ, Ю. Л. ДУГИНА, О. И. ЭПШТЕЙН
Общество с ограниченной ответственностью «Научно-производственная Фирма «Материа Медика Холдинг», Москва
Препараты анаферон и анаферон детский, созданные на основе релиз-активных антител к интерферону гамма (Р-А антител к ИФН-гамма), эффективны в лечении целого ряда вирусных инфекций. В серии доклинических исследовании, проведенных в ведущих российских и зарубежных научных организациях, были выявлены иммуномодулирующие (иммунотропные) свойства препаратов, обзор которых представлен в настоящей статье. Анаферон и анаферон детский стимулируют гуморальный и клеточный иммунный ответ, повышают фагоцитарную активность нейтрофилов и макрофагов. Ключевым механизмом иммунотропного действия Р-А антител к ИФН-гамма является влияние на систему интерферонов, в частности на ИФН-гамма, и функционально сопряженных с ней цитокинов, приводящее к нормализации функциональной активности естественных факторов иммунной защиты и к усилению противовирусного действия. Благодаря широкому спектру иммунотропной активности препараты анаферон и анаферон детский более 10-ти лет успешно применяются в лечении и профилактике заболеваний, в основе которых лежат нарушения функционального состояния иммунной системы.
Ключевые слова: анаферон, анаферон детский,релиз-активные антитела к ИФН-гамма, иммуннотропная активность, иммуномодулятор противовирусный препарат.
Immunotropic Properties of Anaferon and Anaferon Pediatric
E. S. ZHAVBERT, YU. L. DUDINA, O. I. EPSTEIN
Materia Medica Holding, Ltd, Moscow
Anaferon and pediatric anaferon based a release-active antibodies to interferons-y (R-A antibodies to INF-y) proved to be efficient in the treatment of many viral infections. Immunomodulating (immunotropic) properties of the drugs were revealed in the preclinical studies at many Russian and foreign research medical institutions and are reviewed herein. Anaferon and pediatric anaferon stimulated the humoral and cellular immune responses and increased the neutrophie and macrophage activity. The crucial mechanism of the immunotropic action of R-A antibodies to IFN-y was shown to be bound with the effect on the system of interferons and particular IFN-y and conjugated cytokines, resulting in normalization of the functional activity of the innate factors of the immune defense and increasing of the antiviral action. The broad spectrum of the immunotropic activity provided the success of anaferon and anaferon pediatric for more than 10 years in the treatment and prophylaxis of the diseases associated with disorders in the immune system functional state.
Key words: anaferon, pediatric, release-active antibodies to INF-y, immunotropic activity, immunomodulators, antivirals.
Введение
В 2001 году на основе релиз-активных (РА) антител к ИФН-гамма специалистами компании ООО «НПФ «Материа Медика Холдинг» были разработаны препараты, влияющие на систему интерферонов: анаферон детский (РУ PN000372/01 от 31.05.2007, разрешен к применению у больных с 1 месяца) и анаферон (РУ PN003362/01 от 06.11.2009, разрешен к применению у больных с 18 лет). Р-А антитела к ИФН-гамма также являются компонентом нового эффективного противовирусного препарата эргоферон, зарегистрированного в 2010 году (РУ ЛСР-007362/10 от 29.07.2010).
Используемая в производстве препаратов субстанция антител к ИФН-гамма аффинно очищенных произведена в Великобритании в компании Angel Biotechnology Inc в полном соответствии с международными требованиями надлежащей производственной практики (GMP). Как и другие препараты релиз-активных (Р-А) антител, Р-А антитела к ИФН-гамма оказывают специфическое модифицирующее действие на антиген, к которому они выработаны. С помощью метода ядерно-магнитного резонанса было показано, что Р-А антитела к ИФН-гамма вызывают конформационные изменения в молекуле ИФН-гамма. В подтверждение данного феномена, в радиолигандных исследованиях in vitro было выявлено, что Р-А антитела к ИФН-гамма усиливают взаимодействие ИФН-гамма с его рецептором (количество ИФН-гамма связавшегося с рецептором). Кроме того, Р-А антитела к ИФН-гамма изменяют аффинность связывания ИФН-гамма с антителами к ИФН- гамма, что было обнаружено с использованием иммуносенсорного метода и метода иммуноферментного анализа [3, 4].
Целью настоящего обзора явился анализ данных экспериментальных исследований посвященных изучению иммунотропных свойств Р-А антител к ИФН-гамма (препараты анаферон и анаферон детский).
По заказу ООО «НПФ «Материа Медика Холдинг» было проведено 76 доклинических исследований фармакологической активности и безопасности препаратов Р-А антител к ИФН-гамма: 56 исследований в ведущих научных учреждениях России, в том числе в НИИ фармакологии СО РАМН, Волгоградском медицинском университете, ГНЦ вирусологии и биотехнологии «Вектор», НИИ гриппа РАМН и др., и 20 исследований в зарубежных научных институтах и контрактных организациях, в том числе в компании Apcis SA, Франция, университете Питтсбурга, США, компании Euroscreen, Бельгия, в государственном университете штата Юта, США, компании Cerep, Франция и др. В настоящее время идут и запланированы ряд новых исследований с целью углубленного изучения механизмов действия и эффектов препаратов.
Анаферон и анаферон детский давно и успешно используются в клинической практике для профилактики и лечения острых и хронических вирусных инфекций: гриппа, острых респираторных вирусных инфекций (ОРВИ), герпесвирусных инфекций и др. В доклинических исследованиях была доказана противовирусная эффективность Р-А антител к ИФН-гамма как при профилактическом, так и при лечебном применении в условиях экспериментального заражения животных РНК- (вирусы гриппа А/Н3Ю, А/Н3Ш, «птичий грипп» А/Н5Ш, несколько штаммов пандемического «свиного» гриппа А/Н1Ш) и ДНК- (вирус простого герпеса II типа, штаммы MS и EC) содержащими вирусами [5—7]. Клиническая эффективность и безопасность анаферона и анаферона детского была изучена при следующих инфекциях: грипп (вирусы гриппа А, В), ОРВИ (вызванные аденовирусом, респираторно-синцитиальным вирусом, коронавирусом, вирусом парагриппа, микоплазмой, а также микст-инфекцией); герпесвирусные инфекции (ветряная оспа, инфекционный мононуклеоз, генитальный герпес); острые кишечные инфекции вирусной этиологии (вызванные калицивирусом, коронавирусом, ротавирусом) и др. [8—14].
Ключевым механизмом действия Р-А антител к ИФН-гамма является влияние на функциональное состояние системы интерферонов, в том числе через систему естественных аутоантител к ИФН-гамма [15]. Влияние на систему интерферонов является триггерным механизмом, через который анаферон/анаферон детский вовлекают в реализацию своей фармакологической активности естественные факторы врожденного и приобретенного иммунитета (клеточный и гуморальный иммунитет, фагоцитарная активность нейтрофилов и макрофагов). В клинических исследованиях подтверждено наличие у препаратов Р-А антител к ИФН-гамма противовирусной и иммунотропной активности. Иммунотропные свойства препарата были отмечены при различных патологиях (ОРВИ, грипп, мононуклеоз, калицивирусная, коронавирусная, ротавирусная инфекция) как при профилактическом, так и при лечебном введении [15—19].
Способность препарата увеличивать количество ИФН-гамма, связывающегося со своим рецептором, позволяет сделать предположение, что Р-А антитела к ИФН-гамма увеличивают количество фукнционально активных рецепторов на клеточной мембране и, возможно, являются аллостерическим модулятором рецептора ИФН-гамма. Выявленный эффект нашел подтверждение и в клинических исследованиях препарата — анаферон детский увеличивал субпопуляцию лимфоцитов, экспрессирующих на клеточной мембране рецепторы к ИФН-гамма (СБ119+-лимфоциты) [20].
В экспериментальных исследованиях ex vivo было показано, что Р-А антитела к ИФН-гамма стимулируют продукцию ИФН-гамма. Важно отметить, что использование Р-А антител к ИФН- гамма не приводит к гиперпродукции ИФН-гамма. Так в условиях экспериментальной модели меланомы В-16 было показано отсутствие усиления роста и метастазирования на фоне курсового введения Р-А антител к ИФН-гамма крысам, что позволило сделать вывод об отсутствии гиперпродукции ИФН-гамма, так как известно, что данный цитокин приводит к увеличению метастазирования в легкие и резистентности клеток меланомы к терапии [21].
Механизмы иммунотропного действия Р-А антител к ИФН-гамма.
Материал и методы
Эксперименты проведены на 246 мышах (180 самцах и 66 самках) линии СВА, 25 мышах-гибридах F1 (CBAxC57Bl/6) и 36 мышах-самцах линии C57B1/6 массой 16-18 г. Препараты Р-А антител к ИФН-гамма вводили животным в виде водного раствора внутрижелудочно.
При проведении опытов по оценке влияние Р-А антител к ИФН-гамма на пролиферативную активность Т- и В-лимфоцитов в качестве источника материала была использована периферическая кровь 10 здоровых доноров в возрасте от 22 до 36 лет.
При исследовании влияния Р-А антител к ИФН-гамма на гуморальный иммунный ответ эксперименты были проведены на мышах-самцах линии СВА (16—18 г) и мышах-самцах линии C57B1/6 (16—18 г). Мышей иммунизировали минимальными дозами эритроцитов барана (ЭБ) [22] —5 х 10 6 /мышь (однократно внутрибрюшинно в объеме 0,2 мл). Для моделирования иммуносупрессии мышам однократно внутрибрюшинно вводили циклофосфан в дозе 125 мг/кг (1/2 максимально переносимой дозы). Мышам линии СВА Р-А антитела к ИФН-гамма (n=36) и дистиллированную воду (контроль, n=36) вводили внутрижелудочно в дозе 0,2 мл/мышь в течение 5 дней. Исследования проводили на здоровых мышах, мышах с иммуносупрессией, иммунизированных мышах и иммунизированных мышах с иммуносупрессией. Введение ЭБ и циклофосфана осуществляли в первый день введения дистиллированной воды или Р-А антитела к ИФН-гамма. 6 мышей оставались интактными.
Мышам линии C57B1/6 (здоровым мышам и мышам с иммуносупрессией) Р-А антитела к ИФН-гамма (n=15) и дистиллированную воду (контроль, n=15) вводили внутрижелудочно в дозе 0,2 мл/мышь в течение 5 дней. Шесть мышей оставались интактными. На 5-е сутки после иммунизации общепринятыми методами [22, 23] определяли общее количество лейкоцитов в периферической крови (ОКЛ), весовые индексы (ИТ и ИС) и клеточность (ОКТ и ОКС) иммунокомпетентных органов (тимуса, селезенки), а также относительное (%) и абсолютное (х10 6 ) количество антителообразующих клеток (АО К) в селезенке мышей по методу A. Cunningham [24] и титр антител (АТ) в сыворотке крови с помощью стандартной реакции гемагглютинации (РГА).
Клеточный иммунный ответ изучали в реакции гиперчувствительности замедленного типа (ГЗТ) на мышах-самках линии СВА (16—18 г) и мышах-самцах гибридах F1 (CBAxC57B1/6) (16—18 г). Р-А антитела к ИФН-гамма (n=9) и дистиллированную воду (контроль, n=9) вводили мышам внутрижелудочно в дозе 0,2 мл/мышь в течение 10 дней. В конце курсового введения Р-А антитела к ИФН-гамма или дистиллированной воды проводили сенсибилизацию мышей ЭБ 1х107/мышь (подкожно в объеме 0,1 мл), разрешающую дозу ЭБ (1х108 в объеме 20 мкл) вводили в подушечку задней лапы на 5-й день после сенсибилизации [22]. Параллельно в контралатеральную лапу вводили физиологический раствор в том же объеме. Интенсивность реакции оценивали через 24 ч по индексу реакции (ИР), который вычисляли индивидуально для каждого животного по формуле:
ИР (%) = (Ро-Рк)/Рк X 100,
где Ро — масса опытной лапы; Рк — масса контрольной лапы.
В отдельной серии экспериментов при постановке реакции ГЗТ у части опытных и контрольных животных (в каждой группе n=6, кроме контроля, где n=7) на 4-й и 5-й дни после инъекции сенсибилизирующей дозы ЭБ внутрибрюшинно вводили специфический ингибитор NO-синтазы — NMMA (NG-монометил-L-аргинин). Интенсивность реакции оценивали у каждого животного по индексу реакции.
Фагоцитарную активность Р-А антител к ИФН-гамма оценивали на мышах-самках линии СВА (n=48). Мышам- самкам линии СВА (16—18 г) внутрижелудочно в течение 10 дней вводили Р-А антитела к ИФН-гамма (n=24) и дистиллированную воду (контроль, n=24) в дозе 0,2 мл/мышь. Фагоцитарная активность нейтрофилов и макрофагов перитонеального экссудата оценивалась через 24 ч после окончания 10-дневного курса введения Р-А антител к ИФН-гамма или дистиллированной воды по способности этих клеток поглощать суточную культуру S. aureus, штамм 209; концентрация взвеси микробов — 100 млн/мл); учитывали процент нейтрофилов, либо макрофагов, поглотивших микробы (фагоцитарный индекс) и среднее число стафилококков, поглощенное одной клеткой (фагоцитарное число).
Пролиферативную активность Т- и В-лимфоцитов оценивали с помощью реакции бласт-трансформации [22], основанной на способности некоторых лектинов вызывать поликлональную активацию и пролиферацию лимфоцитов, которая оценивается радиометрически по интенсивности включения в клетки 3Н-тимидина. Для активации Т-лимфоцитов использовали фитогемагглютинин (ФГА); для активации В-лимфоцитов — митоген лаконоса (МЛ). В исследовании использовали взвесь мононуклеаров периферической крови 10-ти здоровых доноров. Пролиферативную активность оценивали с помощью реакции индуцированной (смешивая 50 мкл мононуклеаров, 50 мкл митогена и 50 мкл Р-А антител к ИФН-гамма) и спонтанной (смешивая 50 мкл мононуклеаров, 50 мкл Р-А антител к ИФН-гамма и 50 мкл ростовой среды) бласт-трансформации. В контроле вместо Р-А антител к ИФН-гамма добавляли 50 мкл ростовой среды (РС). Оценку результатов опыта определяли по индексу стимуляции (ИС):
ИС = О/К,
где О — радиоктивность в лунках с митогеном; К — радиоактивность в лунках без митогена.
Те же супернатанты культур мононуклеаров использовали и для оценки активности ИЛ-1 по методу Mizel S. B. [25]. Получали 4 вида супернатанта: 1) от клеток, стимулированных липополисахаридом (ЛПС, 75 мкг/мл) — для индукции продукции ИЛ-1 в присутствии препарата (50 мкл/мл); 2) от клеток, стимулированных ЛПС; 3) от клеток, культивируемых в присутствии препарата; 4) от клеток, культивируемых только в РС. Оценку результатов опыта определяли по индексу стимуляции (ИС), который рассчитывался по вышеприведенной формуле.
При оценке влияния Р-А антител к ИФН-гамма in vitro на функциональную активность естественных киллеров (ЕК) в качестве источника ЕК была также использована суспензия мононуклеарных клеток (МНК) периферической крови здоровых доноров. Функциональную активность ЕК определяли в цитотоксической реакции по их способности лизировать клетки миелобластоидной линии К-562, используя радиометрический метод. Р-А антитела к ИФН-гамма в виде водного раствора добавляли в полную ростовую среду из расчета 50 мкл на 1 мл среды.
Эксперименты по изучению влияния Р-А антител к ИФН-гамма на выработку ИФН-гамма, ИЛ-2, ИЛ-4, ИЛ-10 проведены на мышах-самцах линии СВА/CaLac (18—20 г., 2—2,5 мес). Мышам-самцам линии СВА/CaLac ежедневно в течение 10 дней внутрижелудочно вводили Р-А антитела к ИФН-гамма (n=48) или дистиллированную воду (контроль, n=48) в дозе 0,2 мл/мышь. 6 мышей были интактными. Продукцию цитокинов определяли на 1, 2, 3, 4, 5, 6, 7, 10 дни введения препаратов у 6 мышей в каждой точке. Лимфоциты выделяли из взвеси селезеночных клеток мышей на градиенте Фиколла-Пака (плотность 1,077), дважды отмывали средой 199 с 5% эмбриональной телячьей сывороткой. Жизнеспособные лимфоциты опытных и контрольных групп, а также фона доводили до концентрации 2х10 6 клеток/мл и инкубировали в течение суток без (спонтанный вариант) или с добавлением 20 мкг/мл ФГА (стимулированный вариант). ИФН-гамма в культуральных супернатантах тестировали иммуноферментным (ИФА) методом.
Результаты и обсуждение
В экспериментальных исследованиях in vivo Р-А антитела к ИФН-гамма стимулировали гуморальный иммунный ответ. Курсовое введение препарата в течение 5 дней мышам способствовало повышению эффективности гуморального иммунного ответа на корпускулярный тимусзависимый антиген (эритроциты барана) (иммунизация минимальными дозами антигена одновременно с первым введением препарата), при этом отмечалось повышение функциональной активности антителообразующих клеток в селезенке в 1,5 раза (pКурсовое введение Р-А антител к ИФН-гамма мышам в течение 10 дней повышало активность Т-эффекторов, что выражалось в усилении реакции гиперчувствительности замедленного типа, в ответ на сенсибилизацию эритроцитами барана: индекс реакции увеличился в 1,7 раза по сравнению с контрольной группой (pПри изучении фагоцитарной активности нейтрофилов и макрофагов перитонеального экссудата мышей, которую оценивали через 24 часа после 10-дневного курса введения препарата, была выявлена способность Р-А антител к ИФН-гамма стимулировать фагоцитоз за счет увеличения доли нейтрофилов и макрофагов, способных поглощать стафилококки на 37,4 и 62% по сравнению с контрольной группой, соответственно (pIn vitro Р-А антитела к ИФН-гамма при добавлении в культуру мононуклеаров оказывали умеренное комитогенное действие в реакции бласттрансформации, стимулируя пролиферацию как Т-, так и В- лимфоцитов. Добавление Р-А антител к ИФН-гамма к культуре мононуклеаров совместно с Т или В митогеном способствовало повышению индекса стимуляции в 1,7 и 1,6 раза, соответственно (p>0,05). При этом Р-А антитела к ИФН-гамма не оказывали влияния на спонтанную бласттрансформацию лимфоцитов [14].
В культуре мононуклеаров Р-А антитела к ИФН-гамма в 1,8 раза повышали выработку лимфоцитами ИЛ-1 (со стимуляцией ЛПС) и в 1,7 раза (без стимуляции ЛПС) по сравнению с контролем (p>0,05), а также увеличивали функциональную активность естественных киллеров, которые играют важную роль в защите организма от различных внутриклеточных микроорганизмов и опухолевых клеток, на 12,7% по сравнению с контролем (pПри изучении влияния Р-А антител к ИФН- гамма на продукцию ИЛ-2, ИЛ-4, ИЛ-10 было показано, что препарат стимулировал преимущественно функциональную способность Т-хелперов I типа, функциональными маркерами которых являются ИФН-гамма и ИЛ-2. При стимуляции лимфоцитов фитогемагглютинином на фоне введения исследуемого препарата происходило усиление продукции как ИФН-гамма и ИЛ-2, так и ИЛ-4 и ИЛ-10, что также говорит и о стимуляции Т-хелперов II типа [14]. На фоне курсового введения Р-А антитела к ИФН-гамма достоверно повышали спонтанную продукцию лимфоцитами ИФН-гамма относительно контроля на 1-е и 3-7-е сут наблюдения, с максимумом на 3-и сут введения — более чем в 8 раз по сравнению с исходным уровнем и в 6,5 раз по сравнению с контролем (pНа фоне введения P-А антител к ИФН-гамма повышение спонтанной выработки ИЛ-2 лимфоцитами селезенки мышей отмечали со 2-х по 7-е сутки. Однако статистически значимое увеличение в 1,5 раза в продукции исследуемого цитокина наблюдалось лишь на 3-е и 7-е сутки опыта (pПовышение спонтанной выработки ИЛ-4 лимфоцитами в 3 раза и в 1,4 раза относительно контрольной группы было зарегистрировано на 7-е и 10-е сутки, соответственно (pКурсовое введение P-А антител к ИФН-гамма не влияло на спонтанную выработку ИЛ-10 лимфоцитами селезенки, но достоверно повышало его ФГА-стимулированную продукцию на 40,6—84,5% по сравнению с контрольной группой на 1-5-е сутки эксперимента (pНеобходимо отметить, что возрастание продукции того или иного цитокина в спонтанном тесте, вероятно говорит о функциональном состоянии клеток продуцентов, в то время как в стимулированном варианте обусловливается преимущественно резервными возможностями лимфоцитов экспериментальных животных секретировать исследуемые клеточные факторы.
В клинических исследованиях была подтверждена способность препаратов на основе P-А антител к ИФН-гамма стимулировать синтез функционально активных ИФН-гамма и ИФН-альфа, а также активировать функции и повышать функциональный резерв Т хелперов и других иммунокомпетентных клеток (В-лимфоцитов, цитотоксических Т-лимфоцитов, ЕК-клеток, фагоцитов и др.) [28—30].
Проведенные исследования позволяют предположить следующий механизм иммунотропного действия P-А антител к ИФН-гамма (см. рисунок).
Выводы
В серии экспериментальных исследований иммунотропного действия было выявлено, что P-А антитела к ИФН-гамма (препараты анаферон и анаферон детский) in vivo стимулируют гуморальный иммунный ответ, в том числе на фоне иммуносупрессии: повышают функциональную активность антителообразующих клеток в селезенке; активизируют функцию Т-эффекторов, что выражается в усилении реакции гиперчувствительности замедленного типа; повышают фагоцитарную активность нейтрофилов и макрофагов перитонеального экссудата за счет увеличения процента активных фагоцитов. In vitro культуре мононуклеарных клеток P-А антитела к ИФН-гамма стимулируют пролиферативную активность Т- и В-лимфоцитов; повышают функциональную активность естественных киллеров; стимулируют выработку ИЛ-1 (в присутствии липополисахарида). Ex vivo было обнаружено стимулирующее действие P-А антител к ИФН-гамма на продукцию ИФН-гамма и функционально сопряженных цитокинов (ИЛ-2, ИЛ-4, ИЛ-10).
Ключевым механизмом иммунотропного действия P-А антител к ИФН-гамма является влияние на систему интерферонов и функционально сопряженных с ней цитокинов, приводящее к нормализации функциональной активности естественных факторов иммунной защиты (клеточный, гуморальный иммунный ответ, фагоцитарная активность нейтрофилов и макрофагов).
Фармакологической мишенью P-А антител к ИФН-гамма является ИФН-гамма и его рецептор, а точкой приложения иммунотропной активности P-А антител к ИФН-гамма — клетки иммунной системы, чувствительные к действию эндогенного ИФН-гамма. P-А антитела к ИФН- гамма способны стимулировать продукцию не только самого ИФН-гамма, но и ряда функционально сопряженных с ним цитокинов: вырабатываемых макрофагами (ИЛ-1), Т-хелперами I типа (ИЛ-2) и Т-хелперами II типа (ИЛ-4, ИЛ-10) [13, 26]. Это объясняет способность P-А антител к ИФН-гамма стимулировать клеточный и гуморальный иммунный ответ, а также увеличивать фагоцитарную активность нейтрофилов и макрофагов перитонеального экссудата [13, 25].
Полученные данные позволяют сделать вывод, что применение препаратов на основе P-А антител к ИФН-гамма (препараты анаферон и анаферон детский) эффективно для лечения и профилактики развития инфекционных заболеваний, а также для коррекции дисбаланса иммунной системы у иммунокомпрометированных пациентов (в том числе у пациентов в период реконвалесценции после инфекционных заболеваний).
Клинико-вирусологическая оценка эффективности индуктора интерферона, содержащего антитела к гамма-интерферону в релиз-активной форме, в терапии острых вирусных кишечных инфекций
Опубликовано в журнале:
«Инфекционные болезни » № 3, т. 10, 2010
В статье приведены результаты двухцентрового рандомизированного двойного слепого плацебо-контролируемого исследования по оценке эффективности индуктора интерферона, содержащего антитела к гамма-интерферону в релиз-активной форме (Анаферон детский), в терапии острых кишечных инфекций вирусной этиологии у детей. Показана клиническая и санирующая эффективность Анаферона детского, проявляющаяся в сокращении выраженности и продолжительности основных симптомов заболевания, в более быстрой элиминации вируса, а также в снижении риска внутрибольничного инфицирования.
Ключевые слова: Анаферон детский, антитела к гамма-интерферону, индуктор интерферонов, острая кишечная инфекция, дети, релиз-активная форма, элиминация вирусов, этиотропная терапия
A clinico-virological evaluation of the effectiveness of an interferon inductor containing antibodies to gamma-interferon in a release-active form in therapy of acute viral enteric infections
The article presents the results of a two-center randomized double blind placebo-controlled study to evaluate the effectiveness of an interferon inductor containing antibodies to gamma-interferon in a release-active form (Anaferon for children) in therapy of acute enteric infections of viral etiology in children. The clinical and sanitizing effectiveness of Anaferon for children is shown, which is manifested in a less severe and shorter period of the major symptoms of disease, in a faster elimination of virus, and also in a decreased risk for hospital-acquired infection.
Key words: Anaferon for children, antibodies to gamma-interferon, interferon inductor, acute enteric infection, children, release-active form, virus elimination, etiotropic therapy
Детское население, в целом, является наиболее поражаемым контингентом в отношении заболеваемости острыми кишечными инфекциями (ОКИ). Так, среди ОКИ с установленной этиологией 80% случаев приходится на пациентов младше 14 лет, а среди ОКИ неустановленной этиологии на долю детей приходится 59% [1].
Особую актуальность приобретает в настоящее время вспышечная заболеваемость ОКИ. Так, по данным Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, в 2011 г. продолжилась тенденция к увеличению числа вспышек инфекционных и паразитарных болезней в Российской Федерации, сложившаяся в последние 3 года [9]. При этом наибольшая часть выявленных очагов инфекционных заболеваний приходилась на детские учреждения: детские сады, школы, интернаты, летние лагеря (89,2% случаев или 2382 очага), а число пострадавших детей составило 38 460 человек (90,5% от всех заболевших). В прошедшем году на долю ОКИ вирусной этиологии пришлось около 30% от числа всех эпидемических очагов.
Не менее значимую проблему современного здравоохранения страны представляют собой внутрибольничные инфекции.
При обсуждении формы, течения и исходов ОКИ следует признать, что неблагоприятные исходы при острых кишечных вирусных инфекциях связаны с развитием тяжелых форм, которые особенно часто наблюдаются у детей раннего возраста и обусловлены быстрым нарастанием эксикоза, развитием метаболического ацидоза, незрелостью иммунной системы организма. Проведенные ранее исследования показали, что в остром периоде ОКИ у детей отмечается изменение широкого спектра иммунологических реакций. Так, характерной особенностью иммунопатогенеза ОКИ различной этиологии у детей является снижение местного иммунитета, проявляющееся уменьшением секреторного иммуноглобулина А (sIgA). Помимо этого, отмечается активное повышение продукции провоспалительных цитокинов, изменение интерферонового статуса за счет снижения уровня интерферонов, уменьшения показателей спонтанной и индуцированной продукции интерферонов вне зависимости от возраста, типа диареи и тяжести заболевания [10, 11].
Таким образом, развитие транзиторного дисбаланса иммунного гомеостаза у детей в остром периоде ОКИ вирусной этиологии и высокий риск внутрибольничного инфицирования обуславливают включение в комплексную терапию данных заболеваний препаратов, обладающих комбинированной противовирусной и иммуномодулирующей активностью.
Препаратами выбора в терапии ОКИ вирусной этиологии у детей могут быть иммуномодуляторы, в частности, индукторы интерферонов. По мнению Р.М.Хаитова с соавт.: «Для того чтобы тот или иной лекарственный препарат мог быть отнесен к группе иммуномодуляторов, должна быть доказана его способность изменять иммунологическую реактивность в зависимости от ее исходного состояния, т.е. препарат должен повышать пониженные и(или) понижать повышенные, т.е. регулировать и приводить к норме патологически измененные показатели иммунитета» [15].
В отличие от классических индукторов ИФН, Анаферон избирательно влияет на продукцию обоих видов ИФН (α и γ ): в остром периоде повышаются все виды продукции, а к периоду реконвалесценции содержание ИФН-α и ИФН-γ в сыворотке и их спонтанная продукция клетками снижаются до нормальных уровней, в то время как способность к индуцированной продукции ИФН (эквивалент синтеза ИФН при контакте с вирусом) повышается, обеспечивая тем самым высокий профилактический потенциал в отношении повторных инфекций 17.
Пациенты и методы
Клиническое наблюдение за пациентами сравниваемых групп осуществляли ежедневно. Оценивали следующие показатели: температура тела (2 раза в сутки), масса тела ребенка (1 раз в сутки), кратность и характеристика стула в течение суток, наличие симптомов интоксикации, рвоты, катаральных явлений со стороны верхних и нижних дыхательных путей (ВДП и НДП), показатели работы сердечнососудистой и дыхательных систем и другие клинические данные. Клинико-лабораторное обследование включало в себя рутинные методы диагностики (клинический анализ крови, общий анализ мочи, биохимический анализ крови и другие) и установление этиологии заболевания методом полимеразной цепной реакции (ПЦР), проводимой на 1-е и 5-е сутки наблюдения за пациентом.
Для оценки эффективности терапии использовались первичные и вторичные критерии. К первичным относились:
Статистическая обработка данных проводилась с использованием статистического пакета Statistica 6.1 (StatSoft, Inc, USA). Использовались методы параметрической (для непрерывных и интервальных переменных) и непараметрической (частотный анализ по категориальным переменным) статистики.
Результаты исследования и их обсуждение
Динамика лихорадочной реакции у пациентов в группах представлена на рис. 1. Как видно из рисунка, наиболее значимые различия в долях пациентов с нормализацией температуры тела наблюдались на 2-3-и сутки терапии: в основной группе у 48% пациентов на 2-е сутки от начала терапии в утренние часы температура тела была в пределах физиологической нормы, в то время как в группе сравнения только у 14% детей было отмечено снижение температуры тела до нормальных значений (р
Рис. 1. Доли пациентов с нормализацией температуры тела в динамике в группах сравнения.
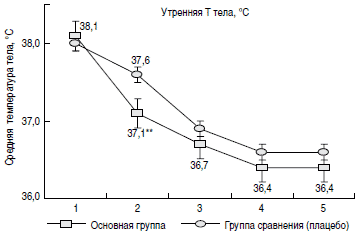 | 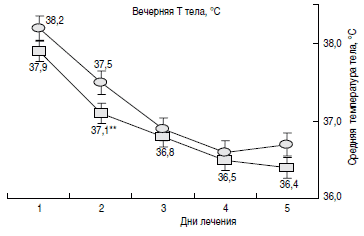 |
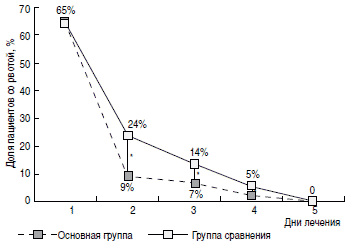
Рис. 3. Динамика рвоты в сравниваемых группах.
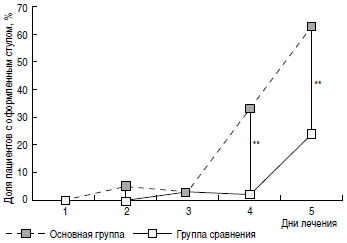
Рис. 4. Динамика появления оформленного стула в сравниваемых группах.
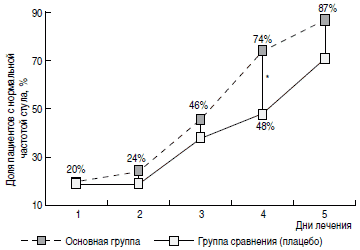
Рис. 5. Динамика восстановления соответствующей возрасту частоты стула в сравниваемых группах на 1-5-е сутки лечения.
Регресс основных клинических симптомов ОКИ также был более быстрым у пациентов основной группы. Так, доля пациентов с наличием рвоты (рис. 3) уже на 2-е сутки терапии была значимо меньшей в основной группе (9%), чем в группе сравнения (24%). На 4-е и 5-е сутки от начала терапии в основной группе пациентов достоверно чаще отмечалась нормализация характера и частоты стула (рис. 4, 5). Динамика исчезновения катаральных симптомов также была более быстрой у пациентов основной группы. Так, на 3-и сутки от начала лечения ринит сохранялся у 24% пациентов основной группы и 37% группы сравнения (р 1 В процессе производства данного лекарственного препарата осуществляется многократное уменьшение концентрации действующего компонента, что приводит к высвобождению особой физико-химической, биологической и фармакологической активности, названной релиз-активностью; форму, содержащую приготовленный таким образом действующий компонент, называют релиз-активной формой [16].