гамалеевская вакцина что это
Вакцина против COVID-19
Общая информация
В настоящее время в мире разрабатывается около 165 различных вакцин против коронавируса. Основные типы вакцин включают: векторные вакцины, инактивированные вакцины, вакцины на основе нуклеиновых кислот (ДНК и мРНК) и вакцины на основе рекомбинантных белков. Российская вакцина на основе аденовирусного вектора была зарегистрирована Министерством здравоохранения России 11 августа и стала первой зарегистрированной вакциной от нового коронавируса SARS-COV-2 на рынке. Это событие создало так называемый «момент Спутника» для мирового сообщества.
Как работают вакцины на основе аденовирусного вектора
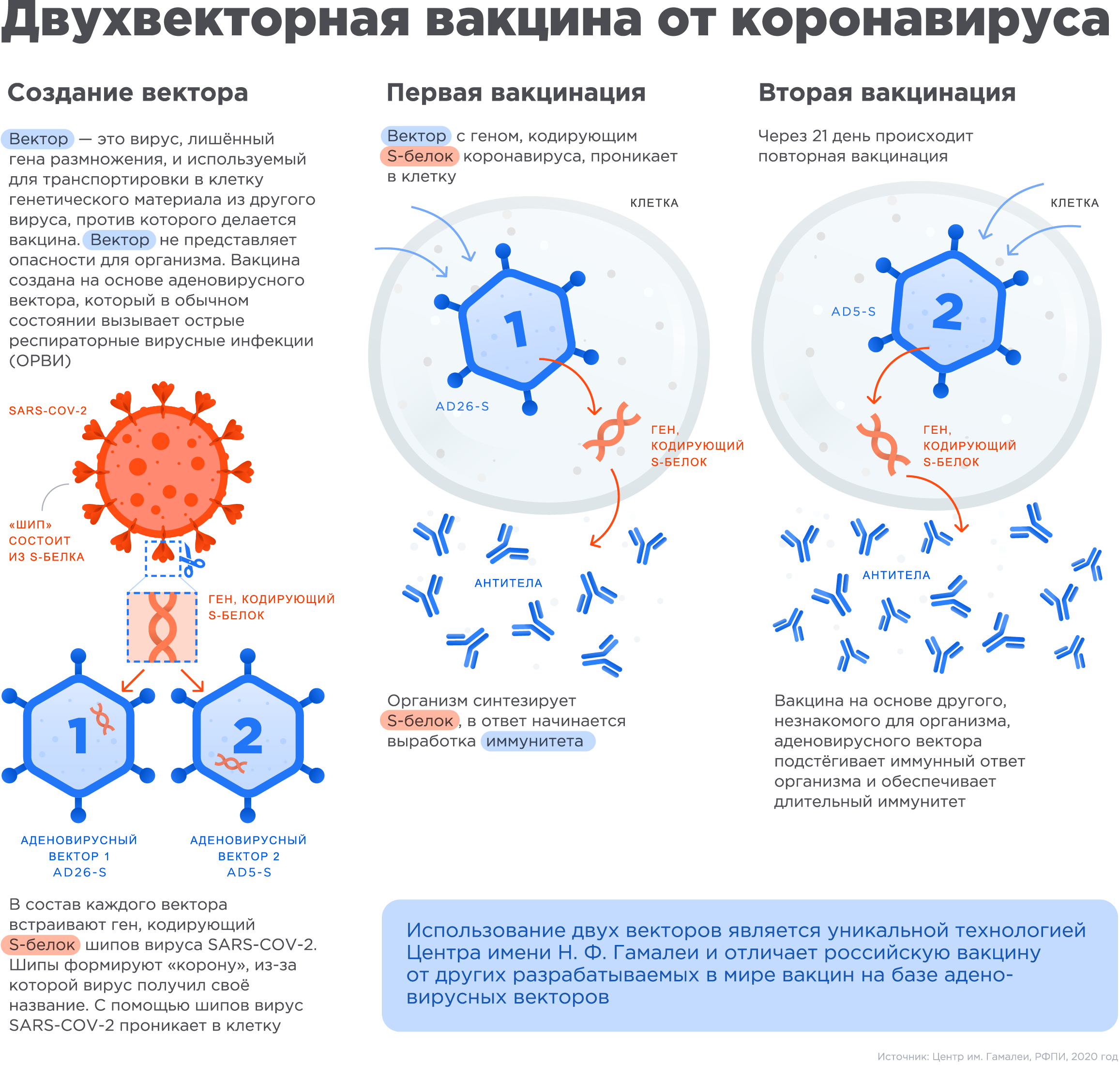
«Векторы» являются носителями, которые могут доставить генетический материал из другого вируса в клетку. При этом генетический материал аденовируса, который вызывает инфекцию, удаляется и вставляется материал с кодом белка от другого вируса, в данном случае от шипа коронавируса. Этот новый элемент безопасен для организма, но он помогает иммунной системе реагировать и вырабатывать антитела, которые защищают от инфекции.
Технологическая платформа векторов на основе аденовирусов упрощает и ускоряет создание новых вакцин путем модификации исходного вектора-носителя генетическим материалом из новых появляющихся вирусов, что позволяет получать новые вакцины в сжатые сроки. Такие вакцины вызывают сильный ответ со стороны иммунной системы человека.
Человеческие аденовирусы считаются одними из самых простых для модификации, поэтому они стали очень популярными в качестве векторов.
После начала пандемии российские исследователи извлекли фрагмент генетического материала нового коронавируса SARS-COV-2, кодирующий информацию о структуре S белка шипа вируса (белок формирующего «корону» вируса и отвечающий за его связывание с клетками человека), и вставили его в уже знакомый им аденовирусный вектор для доставки в человеческую клетку, создав, таким образом, первую в мире вакцину против коронавируса SARS-COV-2.
Чтобы обеспечить длительный иммунитет, российские ученые предложили использовать два разных типа аденовирусных векторов для первой и второй вакцинации, усиливая действие вакцины.
Использование аденовирусов человека в качестве векторов безопасно, так как данные вирусы, вызывающие ОРВИ, не являются новыми и существуют уже тысячи лет.
Клинические испытания
Прежде чем приступать к клиническим испытаниям, вакцина прошла в полном объеме все стадии доклинических испытаний по эффективности и безопасности, которые включали эксперименты на различных видах лабораторных животных, в том числе на 2-х видах приматов.
Фаза 1 и 2 клинических испытаний вакцины были завершены 1 августа 2020 года. Все добровольцы хорошо перенесли испытания, не было зарегистрировано непредвиденных и серьезных нежелательных явлений, вакцина индуцировала формирование высокого как антительного, так и клеточного иммунного ответа. Ни один участник нынешнего клинического испытания не заразился коронавирусом после введения вакцины. Высокая эффективность вакцины была подтверждена высокоточными тестами на антитела в сыворотках крови добровольцев (в том числе проводили анализ на антитела, которые нейтрализуют коронавирус), а также способностью иммунных клеток добровольцев активироваться в ответ на S белок шипа коронавируса, что говорит о формировании и антительного и клеточного иммунного ответа в результате вакцинации.
Пострегистрационные клинические исследования вакцины Спутник V с привлечением более 40 тыс. человек будут запущены в России на неделе, начинающейся с 24 августа. К исследованиям также присоединится ряд стран, среди которых ОАЭ, Саудовская Аравия, Филиппины и, возможно, Индия или Бразилия. Вакцина получила свидетельство о регистрации от Минздрава России 11 августа, и в соответствии с правилами, принятыми во время пандемии, может использоваться для вакцинации населения в России. Массовое производство вакцины, как ожидается, начнется в сентябре.
Активное вещество вакцины Спутник V и способ его использования имеет патентную защиту на территории России, которая принадлежит Национальному исследовательскому центру эпидемиологии и микробиологии имени почетного академика Н. Ф. Гамалеи.
Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
| ▼ Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях медицинских организаций, имеющих право осуществлять вакцинопрофилактику населения в установленном порядке. |
Регистрационный номер:
Торговое наименование:
Гам-КОВИД-Вак-М Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
Международное непатентованное или группировочное наименование:
Вакцина для профилактики COVID-19
Лекарственная форма:
раствор для внутримышечного введения
Состав на 1 дозу
Компонент I содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 26 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (2,0±1,5)×10 10 частиц.
Вспомогательные вещества: трис(гидроксиметил)аминометан – 1,21 мг, натрия хлорид – 2,19 мг, сахароза – 25,0 мг, полисорбат 80 – 250 мкг, магния хлорида гексагидрат – 102,0 мкг, ЭДТА динатриевая соль дигидрат – 19,0 мкг, этанол (спирт этиловый) 95% – 2,5 мкл, вода для инъекций – до 0,5 мл.
Компонент II содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (2,0±1,5)×10 10 частиц.
Вспомогательные вещества: трис(гидроксиметил)аминометан – 1,21 мг, натрия хлорид – 2,19 мг, сахароза – 25,0 мг, полисорбат 80 – 250 мкг, магния хлорида гексагидрат – 102,0 мкг, ЭДТА динатриевая соль дигидрат – 19,0 мкг, этанол (спирт этиловый) 95% – 2,5 мкл, вода для инъекций – до 0,5 мл.
Описание
Компонент I. Раствор замороженный – плотная затвердевшая беловатого цвета масса. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Компонент II. Раствор замороженный – плотная затвердевшая беловатого цвета масса. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Характеристика
Вакцина получена биотехнологическим путем, при котором не используется патогенный для человека вирус SARS-CoV-2. Препарат состоит из двух компонентов: компонент I и компонент II.
В состав компонента I входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген белка S вируса SARS-CoV-2, в состав компонента II входит вектор на основе аденовируса человека 5 серотипа, несущий ген белка S вируса SARS-CoV-2.
Фармакотерапевтическая группа:
Код АТХ:
Фармакологические свойства
Вакцина индуцирует формирование гуморального и клеточного иммунитета в отношении коронавирусной инфекции, вызываемой вирусом SARS-CoV-2.
Иммунологические свойства и безопасность вакцины изучали в клиническом исследовании у добровольцев обоего пола в возрасте от 12 до 17 лет включительно.
Промежуточный анализ иммуногенности показал, что вакцина формирует иммунный ответ у добровольцев. При исследовании гуморального иммунного ответа сыворотки добровольцев были проанализированы на наличие антител, специфичных к рецептор-связывающему домену гликопротеина S вируса SARS-CoV-2 на 42 день от начала вакцинации: уровень сероконверсии составил 100%.
Иммунизация препаратом Гам-КОВИД-Вак-М формирует антиген-специфический клеточный противоинфекционный иммунитет у 93,2% обследованных добровольцев (формирование антиген-специфичных клеток обоих популяций Т-лимфоцитов: Т-хелперных (CD4+) и Т-цитотоксических (CD8+) и достоверное повышение секреции ИФНγ).
Защитный титр антител в настоящее время неизвестен. Продолжительность защиты неизвестна.
Показания к применению
Профилактика COVID-19 у подростков в возрасте от 12 до 17 лет (включительно).
Противопоказания
Противопоказания для введения компонента II:
С осторожностью
Применять вакцину с осторожностью при хронических заболеваниях печени и почек, эндокринных заболеваниях (выраженных нарушениях функции щитовидной железы и сахарном диабете в стадии декомпенсации), тяжелых заболеваниях системы кроветворения, эпилепсии и других заболеваниях ЦНС, остром коронарном синдроме и остром нарушении мозгового кровообращения, миокардитах, эндокардитах, перикардитах.
Вследствие недостатка информации вакцинация может представлять риск для следующих групп пациентов:
Принятие решения о вакцинации должно основываться на оценке соотношения пользы и риска в каждой конкретной ситуации.
Применение при беременности и в период грудного вскармливания
Отсутствует опыт клинического применения Гам-КОВИД-Вак-М при беременности. Согласно результатам изучения репродуктивной токсичности на животных не установлено отрицательного влияния на течение беременности, эмбриофетальное развитие (на самках) и пренатальное развитие потомства. В связи с этим применять препарат Гам-КОВИД-Вак-М при беременности следует только в тех случаях, когда ожидаемая польза для матери превышает потенциальный риск для плода с 22-х недель беременности.
Клинические данные по применению препарата Гам-КОВИД-Вак-М у женщин, кормящих грудью, и младенцев отсутствуют. В настоящий момент нет данных выделяется ли вакцина с молоком. Перед принятием решения о вакцинации кормящей женщины необходимо оценить риски и пользу данной вакцинации.
Способ применения и дозы
Вакцина предназначена только для внутримышечного введения. Строго запрещено внутривенное введение препарата. Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча). При невозможности введения в дельтовидную мышцу – препарат вводят в латеральную широкую мышцу бедра.
Вакцинацию проводят в два этапа: вначале компонентом I в дозе 0,5 мл, затем, через 3 недели – компонентом II в дозе 0,5 мл.
После введения вакцины пациент должен находиться под наблюдением медицинских работников в течение 30 минут.
Перед иммунизацией флакон с компонентом I или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Не допускается хранение размороженного препарата!
Повторное замораживание не допускается!
| ▼ Информация для медицинских работников, выполняющих вакцинацию лекарственным препаратом: данный лекарственный препарат зарегистрирован по особой процедуре регистрации, в связи с чем необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата, путем внесения информации в соответствующий раздел информационной системы ЕГИСЗ. |
Побочное действие
Нежелательные явления (НЯ), характерные для применения вакцины, выявленные в рамках клинических исследований, а также исследований других вакцин на основе аналогичной технологической платформы, бывают преимущественно легкой или средней степени выраженности, могут развиваться в первые-вторые сутки после вакцинации и разрешаются в течение 3-х последующих дней. Чаще других могут развиться кратковременные общие (непродолжительный гриппоподобный синдром, характеризующийся ознобом, повышением температуры тела, артралгией, миалгией, астенией; общим недомоганием; утомляемость, головная боль) и местные (болезненность в месте инъекции, гиперемия, отечность) реакции. Рекомендуется назначение нестероидных противовоспалительных средств (НПВС) при повышении температуры после вакцинации и антигистаминных средств при выраженной местной реакции.
Реже отмечаются: тошнота, диспепсия, иногда – заложенность носа увеличение регионарных лимфоузлов, паническая атака. У некоторых пациентов возможно развитие аллергических реакций, кратковременное изменение лабораторных показателей крови повышение уровня билирубина, снижение уровня нейтрофилов) в сыворотке крови.
В рамках проведенных клинических исследований безопасности, переносимости и иммуногенности препарата Гам-КОВИД-Вак-М после вакцинации были зарегистрированы следующие НЯ:
«Общие нарушения и реакции в месте введения»: гипертермия, боль, отек, зуд в месте вакцинации, астения. Частота развития – очень часто и часто.
«Нарушения со стороны дыхательной системы, органов грудной клетки и средостения»: заложенность носа. Частота развития – редко.
«Нарушения со стороны нервной системы»: головная боль; головокружения – редко. «Желудочно-кишечные нарушения»: тошнота, рвота, диспепсия – редко.
«Лабораторные и инструментальные данные»: разнонаправленные отклонения показателей. Все НЯ завершились выздоровлением без последствий. Лабораторные отклонения не имели клинического значения (не нуждались в проведении дополнительных диагностических процедур и назначении терапии).
Передозировка
О случаях передозировки не сообщалось.
Учитывая, что отпуск лекарственного препарата допускается только для лечебно-профилактических учреждений, а сама вакцинация проводится только квалифицированным медицинским персоналом, риск передозировки крайне низок.
Однако можно предположить, что при случайной передозировке возможно развитие указанных выше токсических и токсико-аллергических реакций в более тяжелой степени.
Специфических антидотов к препарату не существует.
Терапевтические мероприятия в данном случае будут включать симптоматическую терапию в соответствии с показаниями (жаропонижающие/НПВС и десенсибилизирующие средства, кортикостероиды – парентерально при выраженном токсико-аллергическом синдроме). Режим назначения препаратов должен быть выбран согласно рекомендациям по применению и дозировкам данного лекарственного средства.
Взаимодействие с другими лекарственными средствами
Не изучалось. Ввиду отсутствия данных исследований совместимости, вакцину Гам-КОВИД-Вак-М (Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2) нельзя смешивать с другими вакцинами или иными лекарственными средствами в одном шприце.
Особые указания
У пациентов, получающих иммуносупрессивную терапию, и пациентов с иммунодефицитом может не развиться достаточный иммунный ответ. Поэтому прием препаратов, угнетающих функцию иммунной системы, противопоказан в течение, как минимум, 1 месяца до и после вакцинации из-за риска снижения иммуногенности.
Подобно остальным вакцинам, защитный иммунный ответ может возникать не у всех вакцинируемых лиц.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния вакцины на способность управлять транспортными средствами и потенциально опасными механизмами не проводились.
Форма выпуска
Раствор для внутримышечного введения, компонент I – 0,5 мл/доза + компонент II – 0,5 мл/доза.
По 0,5 мл (1 доза) каждого компонента препарата во флаконы нейтрального стекла, герметично укупоренные пробками из резины, обжатые алюмопластиковыми колпачками.
1 флакон компонента I с инструкцией по применению помещают в пачку картонную или в пачку из картона коробочного; 1 флакон компонента II с инструкцией по применению помещают в пачку картонную или в пачку из картона коробочного.
Условия хранения
Хранить в защищенном от света месте, при температуре не выше минус 18 °С. Повторное замораживание не допускается.
Хранить в недоступном для детей месте.
Условия транспортирования
При температуре не выше минус 18 °С.
Срок годности
Компонент I – 6 месяцев. Компонент II – 6 месяцев.
Не применять по истечении срока годности.
Условия отпуска:
для лечебно-профилактических учреждений.
Производитель
ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России), Россия, 123098, г. Москва, улица Гамалеи, д. 18 (все стадии производства).
Выпускающий контроль качества
Филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России, Россия, 123098, г. Москва, улица Гамалеи, д. 18.
Владелец регистрационного удостоверения / организация, принимающая претензии потребителя:
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Министерства здравоохранения Российской Федерации (ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России).
Россия, 123098, г. Москва, улица Гамалеи, д. 18.
Гамалеевская вакцина что это
Минздрав утвердил календарь прививок с вакциной от COVID
Минздрав утвердил национальный календарь профилактических прививок и прививок по.
Новый штамм – новая вакцина
Будет ли эффект от нового препарата ФМБА? Федеральное медико-биологическое агентство (ФМБА).
Стоит ли бояться Штамма Омикрон?
Штамм Омикрон – новая угроза человечеству Состояние пандемии пока не отпускает.
“Спутник М” одобрен для вакцинации детей
Ожидать ли массовую вакцинацию детей в России? На минувшей недели Минздрав заявил о.
Ревакцинация в России и в мире
Бустерные прививки: стоит ли комбинировать вакцины? Со времени начала вакцинации от.
Какие границы открыты официально?
Куда могут полететь россияне? Пандемия усложнила перемещение по миру, однако на сегодняшний.
Ограничения на путешествия из России
Куда не пустят без прививок от коронавируса и QR-кодов? В ноябре 2021 года в России.
Коронавирус: четвертая волна
Ситуация с коронавирусом в России приближается к критической Ежедневно мы слышим информацию.
Египет одобрил использование “Спутника Лайт”
На отдых со «Спутником Лайт» Последнее время мы слышим все больше новостей по поводу.
Новая назальная вакцина из США
Спрей в нос эффективен после первого применения Известно, что распространение вируса.
Ждать ли новую волну COVID-19 в России?
Заболеваемость по сезону Рост заболеваемости коронавирусом увеличивается в России с каждым.
ВОЗ приостановила одобрение “Спутника V”
Что нужно для продолжения процедуры? Препарат против коронавирусной инфекции.
Ответы на самые распространенные вопросы о вакцинах и вакцинации
Существует ли вакцина от коронавируса?
Каким образом исследовалась безопасность?
Что вакцина представляет собой?
Содержит ли вакцина живой вирус?
Будет ли иммунитет от вакцины долгосрочным?
В настоящее время используются 7 вакцин против COVID-19. Разработчики как Российские, так и зарубежные.
Спутник V, «ЭпиВакКорона» , АstraZeneca, Pfizer, Moderna, Sinovac, Novavax, Valneva.
«Спутник V»
Вакцина прошла в полном объеме все стадии доклинических испытаний по эффективности и безопасности, которые включали эксперименты на различных видах лабораторных животных, в том числе на 2-х видах приматов.
Испытуемые нормально перенесли испытания, не было зарегистрировано непредвиденных и серьезных негативных явлений, вакцина индуцировала формирование высокого как антительного, так и клеточного иммунного ответа.
Испытания проводились на пациентах из разных городов, проводятся клинические испытания, I и II фазы, есть промежуточные результаты.
В настоящее время идут испытания так называемые плацебо. Людей разбивают на группы произвольным образом. Так не известно кому колют препарат, а кому – вакцину.
Побочных эффектов выявлено небольшое количество, у некоторых легкая боль в месте укола.
«АstraZeneca»
Во всех ветвях испытаний добровольцев делили на две равные группы: одна получала два укола вакцины, вторая — два укола плацебо.
Общая эффективность вакцины 70, 4 %, среди 168 участников 84 показали серьезные побочные эффекты из группы тех, кто вводил вакцину.
«Pfizer»
Вакцина Pfizer/BioNTech первая получила «добро» от ВОЗ на экстренное применение.
Исследование безопасности проводились путем двойного слепого рандомизированного плацебо-контролируемого клинического исследования.
Среди 94 установленных случаев COVID-19 из всех испытуемых в группе получивших плацебо, было на 90% больше случаев ковида, чем в группе получивших две дозы препарата.
«Moderna»
В испытаниях участвовало небольшое количество человек. Во второй фазе – 45, больше половины которых получили утомляемость, озноб, головную и мышечную боль, болезненные ощущения в месте укола
Однако, тяжелых последствий не было выявлено.
«Sinovac»
Испытания проводились у пациентов, разделенных на три группы: с введением высокой дозы вакцины, низкой дозы и плацебо.
По результатам первой фазы побочные эффекты от прививки возникли менее, чем у трети испытуемых и прошли в течение двух дней, кроме одного случая, когда у участника исследований возникла крапивница, которую удалось снять за три дня.
Испытания второй фазы дали позитивный результат. Антитела встречались чаще, побочные эффекты остались на том же процентном соотношении.
Novavax
В испытаниях приняли участие больше 15 тысяч человек в возрасте от 18 до 84 лет, в том числе 27% старше 65 лет.
по итогам второй фазы испытаний показала эффективность в 49,4%. При этом отмечается, что среди участников испытаний, которые не заражены ВИЧ, эффективность достигала примерно 60%.
Valneva
В испытаниях участие около 150 добровольцев в возрасте 18-55 лет.
Информации о результатах испытаний не опубликовано в открытых источниках.
«Спутник V» двухкомпонентная векторная вакцина от COVID-19, которая не содержит коронавирус и представляет собой рекомбинантные микрочастицы аденовируса человека, в которых есть ген протеина S — белка оболочки коронавируса, в отношении которого формируются антитела.
«ЭпиВакКорона» российская сыворотка ЭпиВакКорона, которая с биологической точки зрения вакциной не является.
АstraZeneca Работает с использованием вирусного вектора, основанного на ослабленной версии вируса простуды (adenovirus), содержащего генетический материал спайкового белка вируса SARS-CoV-2.
Pfizer Вносит в клетки организма генетический материал, необходимый для синтеза иммуногенного белка вируса.
Moderna Moderna делает препарат на основе матричной РНК (мРНК) – чистого генетического материала возбудителя, который создается искусственно.
Sinovac представляет собой инактивированную вакцину, которая использует убитые микрочастицы вируса для активации иммунной системы человека, не вызывая ярко выраженной ответной реакции на острую инфекцию.
Novavax Вакцина состоит и высокоочищенного полноразмерного рекомбинантного гликопротеина S вируса SARS-CoV-2
Препарат Novavax способен быстро производить рекомбинантные вирусные белки очень высокого качества, а также может «изготавливать» наночастицы из рекомбинантных вирусных белков.
Valneva Лекарство Состоит из убитых патогенов, вирус мертвый, воспринимается клетками живого организма, риск аутоиммунных реакций ещё выше, чем у живой вакцины.
«Спутник V» не содержит живой вирус.
АstraZeneca содержит ослабленный вирус
Pfizer не содержит живой вирус
Moderna не содержит живой вирус
Sinovac не содержит живой вирус
Novavax содержит фрагменты вируса
Valneva не содержит живой вирус
«Спутник V» прогнозируется длительный иммунитет.
«ЭпиВакКорона» не вызывает устойчивую наработку специфического иммунитета.
АstraZeneca прогнозируется средний иммунитет. Из-за сравнительно низкой специфичности могут потребоваться сравнительно частые ревакцинации
Pfizer прогнозируется средний иммунитет. Из-за сравнительно низкой специфичности могут потребоваться сравнительно частые ревакцинации
Moderna прогнозируется средний иммунитет. Из-за сравнительно низкой специфичности могут потребоваться сравнительно частые ревакцинации.
Sinovac прогнозируется средний иммунитет Из-за сравнительно низкой специфичности могут потребоваться сравнительно частые ревакцинации.
Novavax прогнозируется длительный иммунитет.
Valneva прогнозируется средний иммунитет. Из-за сравнительно низкой специфичности могут потребоваться сравнительно частые ревакцинации.