гам ковид вак что это за вакцина на сколько хватает
Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
| ▼ Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях медицинских организаций, имеющих право осуществлять вакцинопрофилактику населения в установленном порядке. |
Регистрационный номер:
Торговое наименование:
Гам-КОВИД-Вак-М Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2
Международное непатентованное или группировочное наименование:
Вакцина для профилактики COVID-19
Лекарственная форма:
раствор для внутримышечного введения
Состав на 1 дозу
Компонент I содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 26 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (2,0±1,5)×10 10 частиц.
Вспомогательные вещества: трис(гидроксиметил)аминометан – 1,21 мг, натрия хлорид – 2,19 мг, сахароза – 25,0 мг, полисорбат 80 – 250 мкг, магния хлорида гексагидрат – 102,0 мкг, ЭДТА динатриевая соль дигидрат – 19,0 мкг, этанол (спирт этиловый) 95% – 2,5 мкл, вода для инъекций – до 0,5 мл.
Компонент II содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (2,0±1,5)×10 10 частиц.
Вспомогательные вещества: трис(гидроксиметил)аминометан – 1,21 мг, натрия хлорид – 2,19 мг, сахароза – 25,0 мг, полисорбат 80 – 250 мкг, магния хлорида гексагидрат – 102,0 мкг, ЭДТА динатриевая соль дигидрат – 19,0 мкг, этанол (спирт этиловый) 95% – 2,5 мкл, вода для инъекций – до 0,5 мл.
Описание
Компонент I. Раствор замороженный – плотная затвердевшая беловатого цвета масса. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Компонент II. Раствор замороженный – плотная затвердевшая беловатого цвета масса. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Характеристика
Вакцина получена биотехнологическим путем, при котором не используется патогенный для человека вирус SARS-CoV-2. Препарат состоит из двух компонентов: компонент I и компонент II.
В состав компонента I входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген белка S вируса SARS-CoV-2, в состав компонента II входит вектор на основе аденовируса человека 5 серотипа, несущий ген белка S вируса SARS-CoV-2.
Фармакотерапевтическая группа:
Код АТХ:
Фармакологические свойства
Вакцина индуцирует формирование гуморального и клеточного иммунитета в отношении коронавирусной инфекции, вызываемой вирусом SARS-CoV-2.
Иммунологические свойства и безопасность вакцины изучали в клиническом исследовании у добровольцев обоего пола в возрасте от 12 до 17 лет включительно.
Промежуточный анализ иммуногенности показал, что вакцина формирует иммунный ответ у добровольцев. При исследовании гуморального иммунного ответа сыворотки добровольцев были проанализированы на наличие антител, специфичных к рецептор-связывающему домену гликопротеина S вируса SARS-CoV-2 на 42 день от начала вакцинации: уровень сероконверсии составил 100%.
Иммунизация препаратом Гам-КОВИД-Вак-М формирует антиген-специфический клеточный противоинфекционный иммунитет у 93,2% обследованных добровольцев (формирование антиген-специфичных клеток обоих популяций Т-лимфоцитов: Т-хелперных (CD4+) и Т-цитотоксических (CD8+) и достоверное повышение секреции ИФНγ).
Защитный титр антител в настоящее время неизвестен. Продолжительность защиты неизвестна.
Показания к применению
Профилактика COVID-19 у подростков в возрасте от 12 до 17 лет (включительно).
Противопоказания
Противопоказания для введения компонента II:
С осторожностью
Применять вакцину с осторожностью при хронических заболеваниях печени и почек, эндокринных заболеваниях (выраженных нарушениях функции щитовидной железы и сахарном диабете в стадии декомпенсации), тяжелых заболеваниях системы кроветворения, эпилепсии и других заболеваниях ЦНС, остром коронарном синдроме и остром нарушении мозгового кровообращения, миокардитах, эндокардитах, перикардитах.
Вследствие недостатка информации вакцинация может представлять риск для следующих групп пациентов:
Принятие решения о вакцинации должно основываться на оценке соотношения пользы и риска в каждой конкретной ситуации.
Применение при беременности и в период грудного вскармливания
Отсутствует опыт клинического применения Гам-КОВИД-Вак-М при беременности. Согласно результатам изучения репродуктивной токсичности на животных не установлено отрицательного влияния на течение беременности, эмбриофетальное развитие (на самках) и пренатальное развитие потомства. В связи с этим применять препарат Гам-КОВИД-Вак-М при беременности следует только в тех случаях, когда ожидаемая польза для матери превышает потенциальный риск для плода с 22-х недель беременности.
Клинические данные по применению препарата Гам-КОВИД-Вак-М у женщин, кормящих грудью, и младенцев отсутствуют. В настоящий момент нет данных выделяется ли вакцина с молоком. Перед принятием решения о вакцинации кормящей женщины необходимо оценить риски и пользу данной вакцинации.
Способ применения и дозы
Вакцина предназначена только для внутримышечного введения. Строго запрещено внутривенное введение препарата. Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча). При невозможности введения в дельтовидную мышцу – препарат вводят в латеральную широкую мышцу бедра.
Вакцинацию проводят в два этапа: вначале компонентом I в дозе 0,5 мл, затем, через 3 недели – компонентом II в дозе 0,5 мл.
После введения вакцины пациент должен находиться под наблюдением медицинских работников в течение 30 минут.
Перед иммунизацией флакон с компонентом I или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Не допускается хранение размороженного препарата!
Повторное замораживание не допускается!
| ▼ Информация для медицинских работников, выполняющих вакцинацию лекарственным препаратом: данный лекарственный препарат зарегистрирован по особой процедуре регистрации, в связи с чем необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата, путем внесения информации в соответствующий раздел информационной системы ЕГИСЗ. |
Побочное действие
Нежелательные явления (НЯ), характерные для применения вакцины, выявленные в рамках клинических исследований, а также исследований других вакцин на основе аналогичной технологической платформы, бывают преимущественно легкой или средней степени выраженности, могут развиваться в первые-вторые сутки после вакцинации и разрешаются в течение 3-х последующих дней. Чаще других могут развиться кратковременные общие (непродолжительный гриппоподобный синдром, характеризующийся ознобом, повышением температуры тела, артралгией, миалгией, астенией; общим недомоганием; утомляемость, головная боль) и местные (болезненность в месте инъекции, гиперемия, отечность) реакции. Рекомендуется назначение нестероидных противовоспалительных средств (НПВС) при повышении температуры после вакцинации и антигистаминных средств при выраженной местной реакции.
Реже отмечаются: тошнота, диспепсия, иногда – заложенность носа увеличение регионарных лимфоузлов, паническая атака. У некоторых пациентов возможно развитие аллергических реакций, кратковременное изменение лабораторных показателей крови повышение уровня билирубина, снижение уровня нейтрофилов) в сыворотке крови.
В рамках проведенных клинических исследований безопасности, переносимости и иммуногенности препарата Гам-КОВИД-Вак-М после вакцинации были зарегистрированы следующие НЯ:
«Общие нарушения и реакции в месте введения»: гипертермия, боль, отек, зуд в месте вакцинации, астения. Частота развития – очень часто и часто.
«Нарушения со стороны дыхательной системы, органов грудной клетки и средостения»: заложенность носа. Частота развития – редко.
«Нарушения со стороны нервной системы»: головная боль; головокружения – редко. «Желудочно-кишечные нарушения»: тошнота, рвота, диспепсия – редко.
«Лабораторные и инструментальные данные»: разнонаправленные отклонения показателей. Все НЯ завершились выздоровлением без последствий. Лабораторные отклонения не имели клинического значения (не нуждались в проведении дополнительных диагностических процедур и назначении терапии).
Передозировка
О случаях передозировки не сообщалось.
Учитывая, что отпуск лекарственного препарата допускается только для лечебно-профилактических учреждений, а сама вакцинация проводится только квалифицированным медицинским персоналом, риск передозировки крайне низок.
Однако можно предположить, что при случайной передозировке возможно развитие указанных выше токсических и токсико-аллергических реакций в более тяжелой степени.
Специфических антидотов к препарату не существует.
Терапевтические мероприятия в данном случае будут включать симптоматическую терапию в соответствии с показаниями (жаропонижающие/НПВС и десенсибилизирующие средства, кортикостероиды – парентерально при выраженном токсико-аллергическом синдроме). Режим назначения препаратов должен быть выбран согласно рекомендациям по применению и дозировкам данного лекарственного средства.
Взаимодействие с другими лекарственными средствами
Не изучалось. Ввиду отсутствия данных исследований совместимости, вакцину Гам-КОВИД-Вак-М (Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2) нельзя смешивать с другими вакцинами или иными лекарственными средствами в одном шприце.
Особые указания
У пациентов, получающих иммуносупрессивную терапию, и пациентов с иммунодефицитом может не развиться достаточный иммунный ответ. Поэтому прием препаратов, угнетающих функцию иммунной системы, противопоказан в течение, как минимум, 1 месяца до и после вакцинации из-за риска снижения иммуногенности.
Подобно остальным вакцинам, защитный иммунный ответ может возникать не у всех вакцинируемых лиц.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния вакцины на способность управлять транспортными средствами и потенциально опасными механизмами не проводились.
Форма выпуска
Раствор для внутримышечного введения, компонент I – 0,5 мл/доза + компонент II – 0,5 мл/доза.
По 0,5 мл (1 доза) каждого компонента препарата во флаконы нейтрального стекла, герметично укупоренные пробками из резины, обжатые алюмопластиковыми колпачками.
1 флакон компонента I с инструкцией по применению помещают в пачку картонную или в пачку из картона коробочного; 1 флакон компонента II с инструкцией по применению помещают в пачку картонную или в пачку из картона коробочного.
Условия хранения
Хранить в защищенном от света месте, при температуре не выше минус 18 °С. Повторное замораживание не допускается.
Хранить в недоступном для детей месте.
Условия транспортирования
При температуре не выше минус 18 °С.
Срок годности
Компонент I – 6 месяцев. Компонент II – 6 месяцев.
Не применять по истечении срока годности.
Условия отпуска:
для лечебно-профилактических учреждений.
Производитель
ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России), Россия, 123098, г. Москва, улица Гамалеи, д. 18 (все стадии производства).
Выпускающий контроль качества
Филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России, Россия, 123098, г. Москва, улица Гамалеи, д. 18.
Владелец регистрационного удостоверения / организация, принимающая претензии потребителя:
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Министерства здравоохранения Российской Федерации (ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России).
Россия, 123098, г. Москва, улица Гамалеи, д. 18.
Гам-КОВИД-Вак, Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2 : инструкция по применению
Состав
Компонент I содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 26 серотипа, содержат ген белка S вируса SARS-CoV-2, в количестве (1,0±0,5) х 10 11 частиц/доза.
Компонент II содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (1,0±0,5) х 10 11 частиц/доза.
Описание
Компонент I. Раствор замороженный. Представляет собой плотную затвердевшую беловатого цвета массу. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Компонент II. Раствор замороженный. Представляет собой плотную затвердевшую беловатого цвета массу. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Характеристика: Вакцина получена биотехнологическим путем, при котором не используется патогенный для человека вирус SARS-CoV-2. Препарат состоит из двух компонентов: компонент I и компонент II. В состав компонента I входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген белка S вируса SARS-CoV-2, в состав компонента II входит вектор на основе аденовируса человека 5 серотипа, несущий ген белка S вируса SARS-CoV-2.
Фармакотерапевтическая группа
Фармакологические свойства
Вакцина индуцирует формирование гуморального и клеточного иммунитета в отношении коронавирусной инфекции, вызываемой вирусом SARS-CoV-2.
Иммунологические свойства и безопасность вакцины изучали в клиническом исследовании у взрослых добровольцев обоего пола в возрасте старше 18 лет.
Иммунизация препаратом Гам-КОВИД-Вак, формирует напряженный антиген-специфический клеточный противоинфекционный иммунитет, практически у всех обследованных добровольцев (формирование антиген-специфичных клеток обоих популяций Т лимфоцитов: Т хелперных (CD4+) и Т киллерных (CD8+) и достоверному повышению секреции ИФНɣ).
Защитный титр антител в настоящее время неизвестен. Продолжительность защиты неизвестна.
Клинические исследования по изучению эпидемиологической эффективности продолжаются в настоящее время. По данным промежуточного анализа эффективность составляет более 91%.
Показания к применению
Профилактика новой коронавирусной инфекции (COVID-19) у взрослых старше 18 лет.
Противопоказания
— Гиперчувствительность к какому-либо компоненту вакцины или, вакцины, содержащей аналогичные компоненты;
— тяжелые аллергические реакции в анамнезе;
— беременность и период грудного вскармливания;
— возраст до 18 лет (в связи с отсутствием данных об эффективности и безопасности)
Противопоказания для введения компонента II
— тяжелые поствакцинальные осложнения (анафилактический шок, тяжелые генерализованные аллергические реакции, судорожный синдром, температура выше 40 °C и т.д.) на введение компонента I вакцины;
Применять вакцину с осторожностью при хронических заболеваниях печени и почек, эндокринных заболеваниях (выраженных нарушениями функции щитовидной железы и сахарный диабет в стадии декомпенсации), тяжелых заболеваниях системы кроветворения, эпилепсии и других заболеваниях ЦНС, остром коронарном синдроме и остром нарушении мозгового кровообращения, миокардитах, эндокардитах, перикардитах.
Вследствие недостатка информации вакцинация может представлять риск для следующих групп пациентов:
— с аутоиммунными заболеваниями (стимуляция иммунной системы может привести к обострению заболевания, особенно следует с осторожностью относиться к пациентам с аутоиммунной патологией имеющей тенденцию к развитию тяжелых и жизнеугрожающих состояний)
— со злокачественными новообразованиями
Принятие решение о вакцинации должно основываться на оценке соотношения пользы и риска с каждой конкретной ситуации.
Применение при беременности и в период грудного вскармливания
Препарат противопоказан при беременности и в период грудного вскармливания, так как его эффективность и безопасность в этот период не изучались.
Способ применения и дозы
После введения вакцины пациент должен находиться под наблюдением медицинских работников в течение 30 минут.
Приготовление раствора для инъекций.
Перед вакцинированием флакон или ампулу с компонентом I или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон или ампулу снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона или ампулы!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого флакона по 3,0 мл не более 2 часов при комнатной температуре. Хранение вскрытого флакона (ампулы) по 0,5 мл не допускается!
Повторное замораживание флакона с раствором не допускается!
К использованию непригоден препарат с нарушенной целостностью и/или маркировкой флакона или ампулы, при изменении физических свойств (мутность, окрашиваний), неправильном хранении и/или с истекшим сроком годности.
| ▼Информация для медицинских работников, выполняющих вакцинацию лекарственным препаратом: данный лекарственный препарат зарегистрирован по особой процедуре регистрации |
Побочное действие
Нежелательные явления, характерные для применения вакцины, выявленные в рамках клинических исследований, а также исследований других вакцин на основе аналогичной технологической платформы, бывают преимущественно легкой или средней степени выраженности, могут развиваться в первые-вторые сутки после вакцинации и разрешаются в течение 3-х последующих дней. Чаще других могут развиться кратковременные общие (непродолжительный гриппоподобный синдром, характеризующийся ознобом, повышением температуры тела, артралгией, миалгией, астенией, общим недомоганием, головной болью) и местные (болезненность в месте инъекции, гиперемия, отечность) реакции). Рекомендуется назначение нестероидных противовоспалительных средств (НПВС) при повышении температуры после вакцинации и антигистаминных средств при выраженной местной реакции.
В рамках проведенных клинических исследований безопасности, переносимости и иммуногенности препарата Гам-КОВИД-Вак после вакцинации были зарегистрированы следующие нежелательные явления (НЯ):
«Лабораторные и инструментальные данные»: разнонаправленные отклонения показателей иммунологического статуса: повышение числа Т-лимфоцитов, увеличение процентного содержания лимфоцитов, снижение числа естественных клеток-киллеров, увеличение количества СD4-лимфоцитов, снижение количества СD4-лимфоцитов, повышение числа В-лимфоцитов, снижение числа В-лимфоцитов, повышение числа естественных клеток-киллеров, повышение количества CD8-лимфоцитов, повышение уровня иммуноглобулина Е (IgE) в крови, увеличение соотношения CD4/CD8, уменьшение соотношения CD4/CD8, повышение уровня иммуноглобулина A (IgA) в крови, уменьшение процентного содержания лимфоцитов CD8. Отклонения в общем анализе крови: увеличение процентного содержания лимфоцитов, снижение показателя гематокрита, увеличение числа лимфоцитов, повышение скорости оседания эритроцитов, повышение числа лейкоцитов, повышение числа моноцитов, повышение числа тромбоцитов, снижение числа нейтрофилов, снижение числа тромбоцитов. Отклонения в общем анализе мочи: эритроциты в моче.
Большинство НЯ завершились выздоровлением без последствий. Лабораторные отклонения не имели клинического значения (не нуждается в проведении дополнительных диагностических процедур и назначения терапии).
Передозировка
О случаях передозировки не сообщалось.
Учитывая, что отпуск лекарственного препарата допускается только для лечебно-профилактических учреждений, а сама вакцинация проводится только квалифицированным медицинским персоналом, риск передозировки крайне низок.
Однако можно предположить, что при случайной передозировке возможно развитие указанных выше токсических и токсико-аллергических реакций в более тяжелой степени. Специфических антидотов к препарату не существует.
Вакцина Спутник V (Гам-Ковид-Вак)
Весь мир продолжает бороться с COVID-19. На конец ноября 2021 года зарегистрировано более 256 млн случаев заболевания, погибли более 5 млн человек⁵. Для массовой профилактики коронавируса были созданы вакцины. Одна из них — «Спутник V», которая широко применяется для иммунизации населения не только в России, но и в других странах. Расскажем об особенностях этой вакцины, ее преимуществах, эффективности и ответим на самые распространенные вопросы о «Спутник V».
Описание вакцины Спутник V
Вакцину разработали сотрудники Национального исследовательского центра эпидемиологии и микробиологии им. Н. Ф. Гамалеи, и 11 августа 2020 года она прошла официальную регистрацию в Министерстве здравоохранения РФ.
У препарата два наименования:
Коммерческое название вакцина получила в честь первого советского космического спутника, запущенного в 1957 году — «Спутник-1». Буква V символизирует английское слово victory, которое переводится на русский язык как «победа». Таким «громким» названием создатели вакцины образно показали, что при разработке препарата использовали самые современные технологии, а его применение поможет победить коронавирусную инфекцию.
Первую и вторую фазы клинических испытаний «Гам-Ковид-Вак» завершили в августе 2020 года. В феврале 2021 года в авторитетном медицинском журнале The Lancet опубликовали итоги третьей фазы исследований препарата в России.
Производители вакцины
Сегодня производство «Спутника V» в России идет на 9 промышленных площадках — это гарантирует бесперебойные поставки препарата для населения РФ. Кроме того, российскую вакцину производят и во многих зарубежных странах:
Производители вакцины в Бразилии не только покрывают потребности внутреннего рынка, но и направляют препарат в другие страны Латинской Америки.
Вне зависимости от того, где производят вакцину «Спутник V», упрепарата одинаковый состав и эффективность.
Применение
Люди старше 60 лет находятся в зоне риска, смертность среди них велика. Вакцину «Спутник V» успешно испытали на добровольцах. Поэтому Минздрав одобрил применение «Спутника V» для людей старше 60 лет.
В настоящее время проводятся исследования, направленные на изучение возможного тератогенного действия (нарушения эмбрионального развития) вакцины «Спутник V». Промежуточные результаты показывают, что препарат не оказывает на развитие плода негативного влияния. Поэтому применение вакцины «Спутник V» одобрено для беременных и кормящих женщин.
Прививаться ли беременным?
«Беременным женщинам прививаться нужно обязательно, так как для них ковид особенно опасен. Случаи гибели плода у больной матери не единичны, в то же время нет данных, говорящих о том, что «Спутник V» провоцирует выкидыши, скорее наоборот — вакцина защищает мать и дитя. Привитая кормящая мать через молоко передаст антитела младенцу и тем защитит его от коронавируса тоже».
Отличия «Спутника V» от других векторных вакцин
Векторные вакцины представляют собой отдельный класс препаратов для создания иммунной защиты. При их производстве используют относительно безопасные для человека неспособные к репликации вирусы, которые «доставляют» в организм один или несколько генов белков возбудителя инфекции.
Векторные вакцины отличаются высокой эффективностью и безопасностью, в том числе и в долгосрочной перспективе. Это подтвердили результаты свыше 250 клинических исследований, которые проводили на протяжении последних 20 лет.⁴
«Спутник V» создали на платформе аденовирусов — возбудителей обычных простудных заболеваний у людей. Свойства этих вирусов хорошо известны, поэтому реакции организма на их введение предсказуемы.
Разработка института им. Н. Ф. Гамалеи отличается от других векторных вакцин способом изготовления — в основе лежит принцип гетерогенного бустирования. На каждом из двух этапов людям вводят разные векторы. Такой вариант вакцинирования определяет более выраженный иммунный ответ и надежную защиту от инфекционного заболевания.

Суть вакцины «Спутника V»
Болезнетворные микроорганизмы, которые способны вызвать развитие заболевания, называются антигенами. При их попадании в организм иммунная система начинает образовывать защитные антитела. Она как солдаты-защитники атакует антигены и тем самым предотвращает возникновение заболевания, либо обеспечивает его легкое протекание.
Суть вакцины «Спутник V» заключается в том, что человеку вводится «программа» для выработки клетками антигена коронавируса. Она не вызовет развитие заболевания, но «обучит» иммунную систему распознавать и активно атаковать при встрече вирус SARS-CoV-2. Благодаря этому у вакцинированных людей значительно снижается риск развития тяжелых форм коронавирусной инфекции.
Эффективна ли вакцина «Спутник V»?
«Эффективность вакцины «Спутник V» высокая, хотя к ней были вопросы по поводу проведения клинических исследований. Но сейчас уже опубликованы результаты 1-2 фазы и промежуточной стадии 3-й фазы клинических испытаний, а также накопилось довольно много свидетельств из других стран, да и в России тоже. Люди, вакцинированные «Спутником V», практически не попадают в больницу с коронавирусом. Этого уже вполне достаточно для того чтобы считать эту вакцину достаточно эффективной. Среди тех, кто вакцинировался «Спутником V», госпитализированных с коронавирусом меньше 1%. Это единичные случаи среди людей, у которых нарушена иммунная система или им не повезло с формированием иммунитета. Может показаться, что таких сообщений много, но по сравнению с количеством вакцинированных, это доли процента. А антипрививочникам я бы посоветовал сходить на экскурсию в реанимацию ковидного госпиталя, где в ужасных мучениях лежат непривитые люди. Они хрипят, им не хватает воздуха. Тот, кто там побывал, испытал настоящий шок от увиденного».
Состав вакцины «Спутник V»
Действующее вещество вакцины — аденовирусный вектор. Он представляет собой аденовирус человека, неспособный к размножению, поскольку у него удалена часть генетического материала. Вместо удаленной части в него искусственно «встраивают» ген, который кодирует синтез S-белка коронавируса SARS-CoV-2.
«Спутник V» состоит из двух компонентов:
В качестве вспомогательных компонентов в состав вакцины входят:
Вакцина состоит из двух компонентов, которые необходимо ввести с разницей в 3 недели. В качестве первого препарата человек получает вектор Ad26, затем ему вводят вторую дозу с вектором Ad5. Вспомогательные вещества в обоих растворах остаются неизменными.

Принцип действия
Аденовирусный вектор в вакцине представляет собой «транспортное средство», которое доставляет генетический материал SARS-CoV-2 в клетки тела человека. В результате они начинают вырабатывать S-белок коронавируса — эта структура входит в состав оболочки вируса и образует его характерные «шипы».
Если человек, который получил прививку, в дальнейшем встретится с коронавирусом, выработанные антитела «распознают» уже знакомый S-белок и начнут «атаковать» его, а затем Т-лимфоциты будут уничтожать зараженные им клетки. Благодаря этому заболевание либо не разовьется совсем, либо будет протекать в легкой форме.
После введения первого компонента иммунная система начинает вырабатывать антитела не только к S-белку, но и к «вектору», к белкам аденовируса. Поэтому для повторного введения препарата нельзя использовать первоначальный аденовирусный компонент — иначе он может быть уничтожен антителами еще до момента внедрения в клетки. Для предотвращения такого развития событий производители вакцины «Спутник V» решили использовать два разных серологических типа аденовируса.
После введения второго компонента препарата «Спутник V» происходит формирование большего числа иммунных В-клеток памяти — они «запоминают» возбудителя заболевания и дают организму длительный иммунитет. Так, первая доза прививки помогает иммунной системе «ознакомиться» с вирусом, а вторая уже «обучает» ее активной защите.
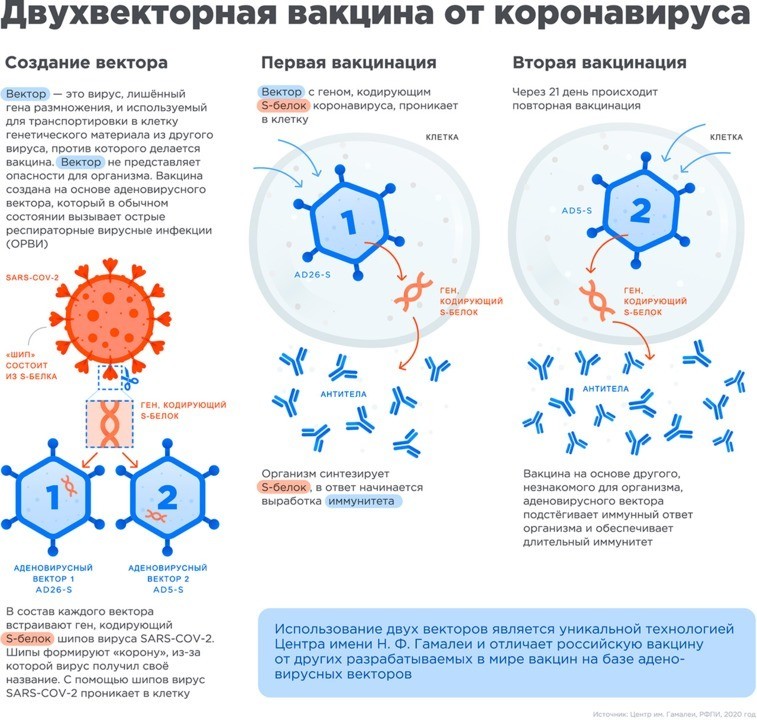
Полноценный иммунный ответ формируется на 42-й день от момента начала вакцинации или через 21 день после введения второго компонента препарата.
Для определения поствакцинального иммунитета можно сделать тест ИФА на антитела к S-белкам коронавируса. Но следует внимательно подойти к сдаче анализа и не перепутать методы исследования. Существуют тест-системы, которые предназначены для обнаружения антител к N-белку коронавируса. Они позволяют выявить постинфекционный иммунитет — ответ, который сформировался после перенесенной болезни. У людей после вакцинации этот показатель, как правило, отрицательный, но это не означает отсутствие иммунитета к коронавирусу. Эту разницу в тест-системах необходимо учитывать при сдаче анализа.¹
Что происходит в организме после вакцинации?
«Принцип действия векторной вакцины «Спутник V» очень простой — он как бы имитирует заражение, заставляет клетку саму производить шиповидный белок коронавируса, поэтому активируются оба звена иммунитета — и гуморальное, и клеточное.
После проникновения в клетку аденовирус теряет оболочку, его ДНК идет в ядро клетки, но никуда не встраивается, а пользуется фабрикой клетки для производства в цитоплазме спайк-белка. Частично он встраивается в мембрану клетки, секретируется в межклеточную жидкость, частично разрушается и представляется на ее поверхности комплексом гистосовместимости. Место инъекции ни аденовирусный вектор, ни сам спайк-белок не покидают и в кровоток практически не попадают.
Секретируемый спайк-белок в межклеточном пространстве подбирают дендритные клетки и макрофаги. Они представляют его эпитопы В- и Т- лимфоцитам. В-клетки и сами могут связать антиген и поглотить его, а затем представить на поверхности. Т-хелперы узнают такие В-лимфоциты, связываются с ними и активируют их клональное размножение и дифференцировку. В результате образуются плазматические клетки, производящие антитела и В-клетки памяти. Отличительной особенностью векторных вакцин является активация клеточного иммунитета и образование Т-клеток памяти, причем как хелперов, так и киллеров. Этим векторные вакцины выгодно отличаются от инактивированных, где Т-клеточный ответ развивается значительно слабее.
В зависимости от степени активации иммунной системы образуется много или мало антител и клеток памяти. При встрече с антигеном клетки памяти способны быстро активироваться, размножиться и дать сильный ответ — на этом основан эффект буста, или усиления иммунного ответа при повторной встрече с антигеном. Поэтому переболевшие люди, уже имеющие клетки памяти, развивают более сильный ответ после вакцинации, чем не болевшие. Прививка выделяет и усиливает у них протективную составляющую из уже имеющегося иммунитета к ковиду».