галий что за металл вреден ли он
Жидкий металл: подводные камни. Взгляд глазами химика
Написать эту статью меня сподвиг пост NotSlow Не так страшен жидкий металл. Там все просто: подстраховался от замыкания, нанес тонким слоем, прикрутил и радуйся низким температурам. Но так ли все хорошо на самом деле?
Для начала нужно выяснить, что это за жидкий металл такой. Среди чистых металлов единственный, который может быть жидким при комнатной температуре — это ртуть. В здравом уме никто сейчас не станет применять ртуть в качестве термоинтерфейса из-за ее крайней токсичности и испаряемости. Два других становятся жидкими уже при температуре человеческого тела — это цезий и галлий. Цезий — это «фтор наоборот» по своей химической активности, он возгорается и взрывается от малейших следов воздуха и влаги и даже разрушает стекло. Остается галлий (на КПДВ именно он). При комнатной температуре галлий все же твердый, однако с некоторыми другими легкоплавкими металлами он образует эвтектики, плавящиеся при 20,5°С (галлий-олово) и даже 15,3 °С (галлий-индий). Еще ниже — в районе 5 °С — плавится тройная эвтектика галлий-индий-олово (62, 25 и 13% соответственно). Имеющиеся в продаже термоинтерфейсы типа «жидкий металл» — это как раз и есть сплавы на основе этих трех элементов, возможно с некоторыми дополнительными присадками.
Исходя из этого, ясны и подводные камни. Первый из них — это абсолютная несовместимость галлийсодержащих сплавов с алюминием!
Во времена, когда уроки химии в школе непременно сопровождались демонстрацией опытов, был среди них и опыт по амальгамированию алюминия. Алюминий покрывали слоем ртути и он тотчас начинал бурно окисляться, рассыпаясь прямо на глазах. Ртуть защищала алюминий от образования оксидного слоя и он образовывался уже на поверхности амальгамы, но не был способен остановить окисление, так как на поверхности жидкости он не удерживался сплошным слоем, растрескивался, и в трещинах открывалась свежая, неокисленная поверхность амальгамы.
Ровно так же действует и галлиевый сплав с той только разницей, что он способен буквально пропитывать алюминий насквозь, проникая в межкристаллитные промежутки. Алюминий, пропитанный жидким галлием, не только окисляется на глазах, но еще и крошится в руках.
Так что ЖМ следует держать от алюминия подальше. И это касается не только алюминиевых радиаторов: случайная капелька «жидкого металла» может уничтожить и корпус ноутбука, если тот из алюминиевого сплава, и любую другую алюминиевую деталь. Хотя бы корпус какого-нибудь конденсатора. Причем капелька эта является классическим катализатором — делает свое черное дело, не расходуясь сама.
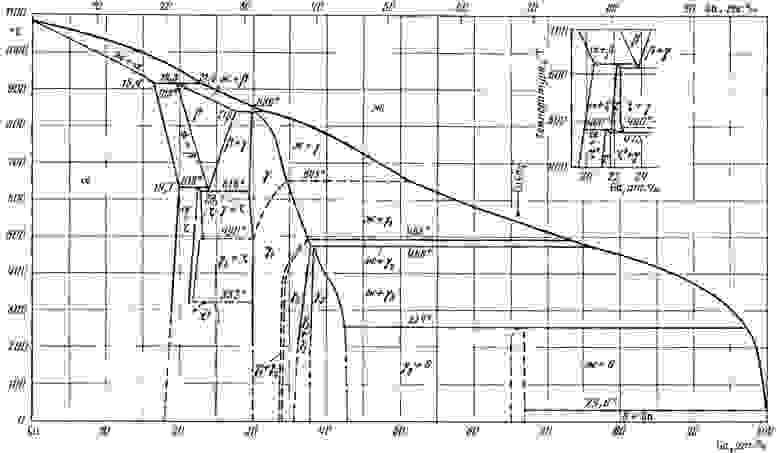
Но и медь к галлию небезразлична. На рисунке выше я привел T-x диаграмму системы медь-галлий (из справочника «Диаграммы состояния двойных металлических систем» под ред. Лякишева), на которой видно бесчисленное множество интерметаллических соединений. Как только галлий вступит в контакт с медью, они тут же начинают образовываться. Жидкий галлий (к его сплавам это тоже относится) вообще очень охотно смачивает и металлы, и неметаллы, а явное химическое сродство этому крайне способствует. Так что «жидкий металл» будет просто впитываться в медь, образуя на границе между металлами корку интерметаллидов. Последние не являются металлами с физической точки зрения, они тугоплавки, хрупки и обладают плохой тепло- и электропроводностью, но главное — «жидкий металл» будет расходоваться на их образование и просто уйдет из зазора. Многие из тех, кто пробовал в деле ЖМ, сообщают, что со временем он перестает работать, и сняв радиатор, они обнаружили, что жидкий металл «испарился». Испариться он не мог — заметное давление пара у его компонентов появляется только свыше тысячи градусов — он просто впитался в медь, прореагировал с ней. Устранить это явление помогает никелевое покрытие на меди, хоть оно и является дополнительным препятствием для тепла.
Кстати, впитываемость галлия и его сплавов в металлы еще касается паяных соединений — помните про ту маленькую капельку, которая может разрушить алюминиевый корпус? Так вот, такая же капелька, попавшая на припой, сделает и его хрупкой, а пайку ненадежной. В какой-то момент это «сработает». Поэтому лично я бы держал «жидкий металл» как можно дальше от любой электроники.
И последнее, о чем следовало бы написать: «жидкий металл», увы, небезвреден. Галлий по некоторым данным сравним по токсичности с мышьяком, второй его компонент, индий — также является токсичным тяжелым металлом. В отличие от ртути сплавы на основе галлия все же абсолютно нелетучи при обычной температуре, так что отравиться их парами не получится, однако из-за своей способности легко прилипать ко всему на свете эти сплавы невероятно мазучие. Испачкать ими, к примеру, руки — легче легкого, а отмыть их до конца очень сложно. Потом это все попадет в рот. Поэтому — работаем с «жидким металлом» и всем, что с ним контактировало только в резиновых перчатках и отдельно от еды, питья и курения. И да, никогда не делайте так, как на КПДВ!
Галлий – польза, особенности и опасность металла
Этот металл не относится к редким, но на мировых биржах за него расплачиваются миллионами. Галлий – материал номер один для нового тысячелетия.
Что представляет собой
Как был открыт
Существование вещества предсказал Дмитрий Менделеев (1869 год):
Через шесть лет все подтвердилось. Французский химик Эмиль де Буабодран выделил из цинковой руды, добытой в Пиренеях, простое вещество, описал его свойства.
О новизне просигнализировала фиолетовость линий в спектре элемента.
Ученый предложил именовать элемент галлием – по латинизированному названию Франции (Галлия). Так он и вошел в историю.
Нахождение в природе
Галлий как металл в природе отсутствует, микродозы его соединений содержат цинковые руды и бокситы. Рассеянный элемент, не формирующий мегаскоплений.
Галлием богаты два десятка минералов, среди которых – полудрагоценные самоцветы гранат, берилл, турмалин, сподумен.
Элемент не особо редок – тонна земной коры содержит 19 г галлия, литр морской воды – 3 мкг.
Физико-химические характеристики
Еще Менделеев установил сходство химических свойств галлия с алюминием. Но «галлиевые» реакции идут неспешно, спокойно.
Металл наделен небанальными характеристиками:
Расплавляемость при комнатной температуре – признак, по которому галлий легко отличить от остальных металлов.
Нагретый галлий разрушает материалы сильнее любого расплавленного металла.
| Свойства атома | |
|---|---|
| Название, символ, номер | Галлий / Gallium (Ga), 31 |
| Атомная масса (молярная масса) | 69,723(1) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p1 |
| Радиус атома | 141 пм |
| Химические свойства | |
| Ковалентный радиус | 126 пм |
| Радиус иона | (+3e) 62 (+1e) 81 пм |
| Электроотрицательность | 1,81 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | (+1) +3 |
| Энергия ионизации (первый электрон) | 578,7 (6,00) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 5,91 г/см³ |
| Температура плавления | 302,9146 К (29,7646°C) |
| Температура кипения | 2477 К (2203,85°C) |
| Уд. теплота плавления | 5,59 кДж/моль |
| Уд. теплота испарения | 270,3 кДж/моль |
| Молярная теплоёмкость | 26,07 Дж/(K·моль) |
| Молярный объём | 11,8 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a=4,519 b=7,658 c=4,526 Å |
| Температура Дебая | 240 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 28,1 Вт/(м·К) |
| Номер CAS | 7440-55-3 |
Особо опасен галлий для алюминия и меди. Он пропитывает их насквозь, внедряясь в кристаллическую структуру. Алюминий окисляется, затем рассыпается.
Галлий держат подальше от электроники, алюминиевых радиаторов, конденсаторов, ноутбуков с корпусом из алюминиевого сплава, других деталей.
Технология производства
Основой производства металлического галлия часто служит минерал галлит (формула CuGaS2), а также уголь, нефелины, бокситы.
Традиционный способ получения продукта – из глиноземов, выделенных переработкой бокситов:
Особо чистый материал (примесей не более 0,0001%) получают рафинированием либо восстановлением водородом.
Где используется
До цифровой эры галлий использовался как компонент легкоплавких сплавов. Сегодня главная сфера применения металла (96,7%) – микроэлектроника.
Промышленность
На практике эксплуатируются полезные свойства галлия:
Легкоплавкость – не всегда достоинство. Она затрудняет хранение, перемещение вещества и продукции из него. Для устранения этого недостатка кусочки галлия упаковывают в полиэтилен, на который галлий не воздействует.
Медицина
Элемент нашел применение в медицине:
Медицина оценила сходство воздействия соединений галлия и железа на биологическом уровне. Они используются как дублеры.
Воздействие на человека
О токсичности вещества единства нет, диапазон оценок – от малой до высокой степени.
Об интоксикации галлием сигнализируют следующие симптомы:
Результатом может стать паралич ног, кома, летальный исход.
Вдыхание аэрозоля с галлием в составе (49,9 мг на кубометр) либо инъекция солей вещества (0,011-0,026 г/кг массы тела человека) выводит из строя почки.
Галий что за металл вреден ли он
Суточная потребность организма человека не определена.
В основном галлий поступает в организм с пищей и содержится в тканях в незначительных количествах (0,01–0,06 мкг/г). Существуют единичные данные, свидетельствующие о присутствии галлия в железах внутренней секреции, в частности, в гипофизе. «Депо» галлия в организме – костная ткань и печень.
Биологическая роль в организме человека. Галлий не влияет на резорбцию костной ткани, стимулируется витамином D, но предупреждает резорбцию, связанную с метаболизмом паратгормона, тироксина и интерлейкина–1–β.
Галлий – ультрамикроэлемент, входящий в оболочку эритроцитов, он является постоянным компонентом крови, ускоряет скорость кровотока, способствует оттоку крови из периферических сосудов, препятствует тромбообразованию.
Недавно американскими учеными было сообщено об обнаружении у галлия антибактериальной активности, которая проявлялась даже у самых резистентных к широкому спектру антибиотиков бактерий. Эффективность некоторых ионов металлов в отношении микроорганизмов известна достаточно давно – серебро, например, не одну сотню лет используется для обработки и хранения питьевой воды. Однако галлий действует на микробы совсем иным образом: бактерии, благодаря определенной аналогии в строении атомов галлия и железа, могут ошибочно использовать галлий вместо железа, при этом их рост прекращается. Галлий, таким образом, играет роль своеобразного «троянского коня», поскольку он легко проникает через мембраны, и внутри клетки оказывает губительное действие.
Синергисты и антагонисты галлия. Не установлены.
Признаки недостаточности галлия: научные данные отсутствуют.
Основные проявления избытка галлия: у животных при отравлении галлием наблюдается поражение нервной системы, что сопровождается морфологическими изменениями в печени и почках. Наблюдаются значительные колебания в содержании калия и натрия в сыворотке крови, повреждение слизистых оболочек желудочно-кишечного тракта.
Широкое использование арсенида галлия (прежде всего в производстве полупроводников) с начала 80-х годов прошлого столетия привело к увеличению риска интоксикации этим элементом не только работников электронной промышленности, но и населения, поскольку методы утилизации и рециркуляции отходов, содержащих арсенид галлия, не были разработаны. Основной «мишенью» для арсенида галлия в организме является иммунная система. Этот элемент также способен нарушать образование гелей в организме, за счет усиления экскреции аминолевулиновой кислоты и порфиринов.
Галлий необходим: в медицине нитрат галлия используется при лечении гиперкальциемии у онкологических больных, где эффект действия достигается за счет подавления активности остеокластов.
Радиоизотопы галлия применяют в диагностике и лечении опухолевых заболеваний. Галлий сравнительно мало токсичен.
Изучается возможность применения галлия для лечения хронических инфекционных заболеваний легких (в том числе, возможно, и туберкулеза) и особенно кистозного фиброза (муковисцидоза).
Пищевые источники галлия: пшеничная крупа (особенно – манная), мед, многие виды грибов (в том числе – белые грибы).
Галлий как химический элемент таблицы Менделеева
Как был открыт Галлий
История такого химического элемента как галлий очень занимательна. Русский ученый и химик Дмитрий Иванович Менделеев в 1871 году при составлении своей элементарной таблицы предсказал наличие нового химического элемента. Он предсказал его атомную массу и некоторые свойства, и назвал его эко-алюминий. Дмитрий Иванович предсказал, что этот элемент будет обнаружен с помощью спектроскопа. Не обнаруженный на тот момент эко-алюминий не должен реагировать с воздухом и будет медленно растворяться в кислотах.
В 1875 году французский химик Поль Эмиль Лекок Буасбаудран с помощью спектроскопии открыл новый химический элемент при изучении сфалерита. Название Галлий ему было дано в честь Родины первооткрывателя. Отделил чистый элемент так же Лекок методом электролиза водного раствора гидроксида калия.
Где и как добывают Галлий
Мировое производство галлия составляет ежегодно порядка 300 тонн. Он является побочным продуктом при переработке руд других металлов, поэтому объем его добычи зависит именно от них. Основным источником при добыче галлия является боксит(руда для получения алюминия), но в гораздо меньших количествах его можно получить из сфалерита(руда для получения цинка). При переработке бокситов галлий накапливается в растворе гидроксида натрия. Из этого раствора можно извлечь элемент множеством способов.
Самый последний метод извлечения заключается в использовании ионообменной смолы. Конечная эффективность добычи зависит от того сколько галлия присутствовало в бокситной руде. Если концентрация составляла стандартное значение 50 частей на миллион, то извлечь возможно только 7.5 частей. Количество, которое можно извлечь обычно составляет около 15%. После этого методом двойного электролиза получают очищенный элемент. После первого электролиза чистота элемента получается порядка 80%.Чистота галлия после второго электролиза при использовании этого метода составяет 99.997%. Правда на выходе чистого элемента получается гораздо меньше. Из добытых 300 тонн галлия на выходе чистого элемента получается всего 180 тонн.
Распространенность Галлия
Распространенность галлия является понятием относительным. Во Вселенной этот элемент пока не оценен, потому что это сделать пока непредставляется возможным. На нашей планете он является довольно редким элементом. В земной коре его присутствие оценивается в 19 частей на миллион. Его распространенность сопоставима с литием и свинцом. Ученые оценивают мировые запасы галлия в 1.6 миллионов тонн. В свободном виде этот химический элемент в природе не встречается или пока он просто не был обнаружен. Сегодня его принято добывать из алюминиевых, цинковых и германиевых руд в качестве побочного продукта. Содержание галлия в этих рудах обычно очень низкое.
В бокситах(алюминиевая руда) его содержание не превышает 0,008%. Самое высокое содержание галлий находит в германиевой руде. Его концентрация составляет в ней не более 1%. Были предприняты попытки добычи галиия из германиевой руды, но это производство оказалось нерентабельным и от этой идеи отказались. Так же галлий можно обнаружить в некоторых минералах, но они являются очень редкими. К таким минералам относится галлит, сонгеит и цумгаллит. К слову, эти минералы являются настолько редкими, что к примеру сонгеит встречается в единственном, известном на сегодняшний день, месте в мире. Сонгеит добывается только в Республике Намибия в шахте Цумеб. Пока его распространенность редкая, но, возможно, все изменится.
Применение Галлия
В силу своих свойств 98% применения галлия составляют полупроводниковые элементы. Для этих нужд используется высокочистый галлий(чистота 99,999%) в соединении с другими элементами и сплавами. Самыми коммерчески важными соединениями являются арсенид, антимонид, фосфид и нитрид галлия. Чтобы было понятно, арсенид галлия представляет собой соединение с мышьяком. Антимонид в свою очередь является соединением галлия с сурьмой.
Среди вышеперечисленных материалов арсенид галлия является вторым по распространенности полупроводниковым материалом после кремния. Если брать в сравнение с кремнием арсенид галлия по некоторым свойствам значительно превосходит его. Этот материал обладает более высокой пропускной способностью. Это позволяет найти ему более широкое применение в электросфере. Например, в мобильных электронных устройствах радиоприемные антенны изготавливаются именно из арсенида галлия, которые обеспечивают прием интернета и телефонной связи. Спрос на него с каждым годом только увеличивается с появлением технологий передачи данных 4G и 5G, за счет которого они и развиваются. Другие сплавы так же находят применение в печатных платах электронных устройств, в устройствах чтения компакт-дисков, светодиодах(испускают синий цвет) и многом другом.
В военной промышленности так же галлий находит свое применение в радиоэлектронных устройствах. В пример можно поставить исполнительные элементы связи со спутниками и марсоходами.
Так же этот элемент является компонентом исполнительных элементов солнечных батарей в качестве замены кремнию. В медицине галлий используется в медицинских термометрах(сплав галлия, олова и индия), так как использовать ртуть запретили. Радиоизотоп галлия-67 используется для обнаружения очагов воспаления таких болезней как туберкулез, остеомиелит, пневмонии и другого рода инфекции и опухолей(в том числе и раковых). В ядерной промышленности этот элемент используется в составе сплава теплообменников в ядерных реакторах.
Интересные факты
Интересных фактов связанных с галлием из-за его редкости не так уж и много, но все же они есть. Стоит начать с самого открытия. Дело в том, что Поль Эмиль Лекок Буасбаудран назвал этот элемент галлий в честь своей Родины, но на тот момент было альтернативное предположение. Научный мир предположил, что Лекок назвал этот элемент в честь себя. Это заявление было обосновано тем, что слово «петух» на французском выглядит как «Le coq» и на латыни пишется «Gallus». В статье 1877 года французский химик опроверг это предположение.
Еще одним интересным моментом является то, что металлический галлий является сам по себе не токсичным веществом. В принципе, как и роль его в организме в качестве микроэлемента тоже пока не выяснена. Внешне он очень напоминает алюминий в твердом состоянии, но его температура плавления составляет всего 29°C. В связи с этим его свойством у химиков существует своего рода шутка. Суть ее заключается в том, чтобы вылепить из галлия чайную ложку, заварить горячий чай своему товарищу и поместить туда эту ложку. Интересной становится реакция объекта шутки, когда металлическая ложка начинает растворяться в горячем чае при помешивании.
p_i_f
ДЛЯ ВСЕХ И ОБО ВСЕМ
Пожалуй, самое известное свойство галлия, это его температура плавления, она составляет 29.76 °C. Это второй по легкоплавкости металл в периодической системе (после ртути). Легкоплавкость, а также низкая токсичность металлического галлия позволили сделать эту фотографию. Кстати, галлий – один из немногих металлов, расширяющихся при затвердевании расплава (другие – Bi, Ge).
Галлодент, эвтектика галлия с оловом
Металлический галлий малотоксичен, одно время он даже применялся для изготовления пломб (вместо амальгамных). Это применение основано на том, что при смешивании порошка меди с расплавленным галлием получается паста, которая через несколько часов затвердевает (из-за образования интерметаллического соединения) и потом может выдержать нагрев до 600 градусов без плавления. Галлий очень хрупок (его можно расколоть как стекло).
Большие кристаллы галлия
Еще одна интересная особенность галлия – способность его расплава к переохлаждению. Расплавленный галлий можно охладить примерно на 10-30 градусов ниже точки плавления, и он останется жидким, но если бросить в такой расплав кусочек твердого галлия или сухого льда, из него мгновенно начнут расти крупные кристаллы. На фотографии – затвердевающий слиток галлия. На фото хорошо видно, что кристаллизация началась в трех местах, и одновременно начали расти три больших монокристалла, которые затем встретились и образовали слиток (это произошло примерно через два часа после съемки).
Галлиевая ложка
Самодельная ложка из галлия. Видео с плавлением этой ложки:
Интересный эксперимент можно провести не только с плавлением, но так же и с затвердеванием галлия. Во первых, галлий это одно из немногих веществ, которые расширяются при затвердевании (так же как и вода), а во вторых, цвет расплавленного металла довольно сильно отличается от цвета твердого.
Небольшое количество жидкого галлия, наливаем в стеклянный пузырек и сверху помещаем маленький кусочек твердого галлия (затравка для кристаллизации, так как галлий способен переохлаждаться). На видео хорошо видно как начинают расти кристаллы металла (они имеют синеватый оттенок, в отличие от серебристо-белого расплава). Через некоторое время, расширяющийся галлий разрывает пузырек.
Средняя часть видео (рост кристаллов галлия) ускорена в десять раз, чтобы видео было не очень длинным.
Так же как и из ртути, из расплавленного галлия можно сделать «бьющееся сердце», правда из-за того, что галлий более электроположительный металл чем железо, оно работает наоборот. При касании кончиком гвоздя, капли расплавленного галия, она «расплывается» из-за уменьшения поверхностного натяжения. А как только контакт с гвоздем прерывается, поверхностное натяжение увеличивается и капля снова собирается, до касания гвоздя.
Желающие могут скачать первое сообщение об открытии галлия, Лекока де Буабодрана (скан, французский язык).