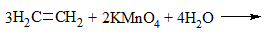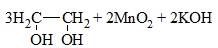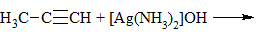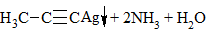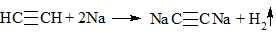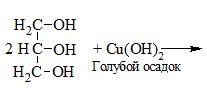что обесцвечивает перманганат калия
Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 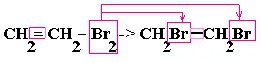 2. Изменение окраски раствора 2. Изменение окраски раствора3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: 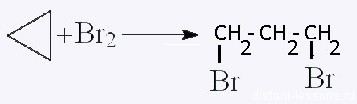 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди:  3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 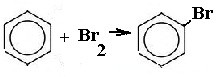
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 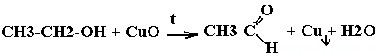 |
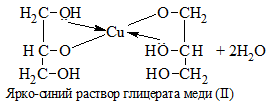
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 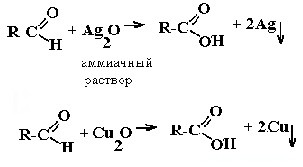 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Пособие-репетитор по химии
Продолжение. Cм. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19/2008
10-й класс (первый год обучения)
Марганец. Перманганат калия и продукты его восстановления
в различных средах

2. Краткая история открытия и происхождение названия.
3. Физические и химические свойства.
4. Нахождение в природе и основные методы получения.
5. Важнейшее соединение марганца – перманганат калия. Продукты его восстановления в зависимости от среды раствора.
Марганец расположен в побочной подгруппе VII группы периодической системы Д.И. Менделеева. Это элемент, обладающий переменной валентностью. В соединениях марганец проявляет степени окисления +2, +3, +4, +6, +7, основными из которых являются степени окисления +2 и +4.
Марганец был открыт в 1774 г. шведскими химиками К.Шееле и Ю.Ганном при прокаливании минерала пиролюзита (MnO2) с углем. Название элемента, вероятно, представляет собой искаженное слово «манганес», что означает «обесцвечиваю, навожу блеск». Это название имеет ремесленное происхождение и связано с обесцвечивающим действием пиролюзита на стекло при плавлении.
Ф и з и ч е с к и е и х и м и ч е с к и е с в о й с т в а
Марганец – серебристый, довольно тугоплавкий металл. На воздухе и в воде он пассивируется, но в мелкораздробленном состоянии может быть окислен и взаимодействует с водой с образованием гидроксида. В целом марганец можно охарактеризовать как достаточно активный металл (особенно в мелкодисперсном состоянии).
Mn + O2 
Mn + Cl2 
Mn + S 
3Mn + N2 
Mn + 2HCl = MnCl2 + H2
Mn + 2H2SO4(конц.) = MnSO4 + SO2 
3Mn + 8HNO3(р-р) = 3Mn (NO3)2 + 2NO 
Mn + 4HNO3(конц.) = Mn (NO3)2 + 2NO2 
Mn + CаCl2 
В п р и р о д е марганец в основном встречается в виде оксидов, поэтому основным промышленным м е т о д о м п о л у ч е н и я марганца является его восстановление (обычно с помощью кремния, углерода или алюминия):
MnO2 + C 
Кроме того, марганец получают, проводя электролиз растворов его солей, например:
Важнейшее соединение марганца – перманганат калия.
Продукты его восстановления в зависимости от среды раствора
Перманганат калия (KMnO4) – соль марганцовой кислоты HMnO4. Марганцовая кислота является очень сильной, существует только в водном растворе. Перманганат калия – самая известная и широко применяемая соль этой кислоты. Это кристаллическое вещество темно-фиолетового, почти черного цвета, умеренно растворимое в воде. Растворы перманганата калия слабой концентрации имеют малиновый цвет, при повышении концентрации цвет становится фиолетовым (такая окраска свойственна перманганат-иону). В водных растворах эта соль не подвергается гидролизу, т.к. образована сильным основанием и сильной кислотой. При нагревании перманганат калия легко разлагается с образованием манганата калия, оксида марганца(IV) и кислорода:
2KMnO4 

Перманганат калия является сильным окислителем за счет перманганат-иона, содержащего марганец в высшей степени окисления +7. Характер продуктов восстановления KMnO4 зависит от того, в какой среде происходит реакция.
В нейтральной среде перманганат-ионы восстанавливаются до оксида марганца(IV), выпадает бурый осадок MnO2, степень окисления марганца понижается от +7 до +4.
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 
В щелочной среде перманганат-ионы восстанавливаются до манганат-ионов. В результате раствор приобретает зеленый цвет; степень окисления марганца понижается от +7 до +6.
Как окислитель перманганат калия широко применяется в лабораторной практике. Кроме того, марганцовку широко применяют в медицине в качестве антисептического средства. Находит применение перманганат калия и как твердый источник для получения кислорода.
Тест по теме «Марганец и его соединения»

2. Соединение, содержащее 
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| г | в | г | а, г | г | б | в | г | г | б |
Качественные задачи на обсуждение
попарного взаимодействия веществ

1. Обсудите возможность попарного взаимодействия между следующими веществами: соляная кислота, хлорид кальция, нитрат серебра, карбонат калия, гидроксид натрия, хлор. Напишите уравнения реакций.
Решаем с помощью решетки Плетнера.
| Вещества | HCl | CaCl2 | AgNO3 | K2CO3 | NaOH | Cl2 |
| HCl | – | – | + (1-е уравнение) | + (2-е уравнение) | + (3-е уравнение) | – |
| CaCl2 | – | – | + (4-е уравнение) | + (6-е уравнение) | + (7-е уравнение) | – |
| AgNO3 | + (1-е уравнение) | + (4-е уравнение) | – | + (5-е уравнение) | + (8-е уравнение) | – |
| K2CO3 | + (2-е уравнение) | + (6-е уравнение) | + (5-е уравнение) | – | – | – |
| NaOH | + (3-е уравнение) | + (7-е уравнение) | + (8-е уравнение) | – | – | + (9-е и 10-е уравнения) |
| Cl2 | – | – | – | – | + (9-е и 10-е уравнения) | – |
1) HCl + AgNO3 = AgCl 
2) 2HCl + K2CO3 = 2KCl + H2O + CO2
3) HCl + NaOH = NaCl + H2O.
4) CaCl2 + 2AgNO3 = 2AgCl 
5) 2AgNO3 + K2CO3 = Ag2CO3 
6) CaCl2 + K2CO3 = CaCO3 
7) CaCl2 + 2NaOH = Ca(OH)2 
8) 2AgNO3 + 2NaOH = Ag2O 
9) 2NaOH + Cl2 
10) 6NaOH + 3Cl2 
Ответ. 9 вариантов возможных попарных
взаимодействий (10 уравнений реакций).
2. Какие из перечисленных веществ будут реагировать между собой: медь, концентрированная азотная кислота, углерод, сера, алюминий, хлорид железа(III), карбонат натрия? Напишите уравнения реакций.
Ответ. 14 вариантов возможных попарных
взаимодействий (14 уравнений реакций).
3. Определите, какие вещества могут взаимодействовать между собой: цинк, хлор, угарный газ, оксид натрия, гидроксид натрия, азотная кислота, хлорид меди(II). Напишите уравнения реакций.
Ответ. 12 вариантов возможных попарных
взаимодействий (15 уравнений реакций).
4. Какие из перечисленных веществ могут взаимодействовать между собой: бром, гидроксид калия, аммиак, соляная кислота, йодид калия, цинк. Напишите уравнения реакций.
Ответ. 8 вариантов возможных попарных
взаимодействий (10 уравнений реакций).
5. Определите, какие вещества могут взаимодействовать между собой: кальций, вода, оксид меди(II), водород, гидроксид кальция, концентрированная серная кислота, йодид натрия. Напишите уравнения реакций.
Ответ. 7 вариантов возможных попарны
взаимодействий (7 уравнений реакций).
6. Обсудите возможность попарного взаимодействия между следующими веществами: сульфат натрия, ацетат свинца(II), сульфид калия, хлорид алюминия, нитрат бария. Напишите уравнения реакций.
Ответ. 5 вариантов возможных попарных
взаимодействий (5 уравнений реакций).
*Знак (+/–) означает, что данная реакция протекает не со всеми реагентами или в специфических условиях.
Некоторые темы органической химии для подготовки к ЕГЭ
Задание 25. Качественные реакции (подробно)
1. Как распознать алкены и стирол (в случае стирола в реакции вступает только двойная связь боковой цепи, а не бензольное кольцо)
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях)
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
Раствор перманганат калия фиолетового цвета. В результате реакции окраска исчезает, образуется осадок MnO2 бурого цвета.
2. Как распознать алкины
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях):
3) + [Ag(NH3)2]OH → выпадение осадка в случае концевой тройной связи:
4) + Металл → выпадение осадка и выделение водорода в случае концевой тройной связи
3. Как распознать бензол
1) Бензол горит коптящим пламенем из-за большого содержания углерода.
Благодаря устойчивой ароматической системе бензол не вступает в реакции с водным раствором Br2 и раствором KMnO4.
4. Как распознать одноатомные спирты
1) + CuO → наблюдаем выделение металлической меди:
CH3-CH2-OH + CuO → CH3-CHO + Cu + H2O (t, окисление спиртов до альдегидов)
С основаниями одноатомные спирты не взаимодействуют.
5. Как распознать многоатомные спирты
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора:
С щелочами многоатомные спирты не взаимодействуют.
6. Как распознать фенолы
1) + Br2 → выпадение белого осадка 2,4,6-трибромфенола
2) + FeCl3 → раствор фиолетового цвета
7. Как распознать альдегиды
1) + [Ag(NH3)2]OH → восстановление металлического серебра
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета
8. Как распознать карбоновые кислоты
1) раствор лакмуса → изменение окраски на красную
2) + Na2CO3/NaHCO3  → выделение газа CO2
9. Как распознать соли высших карбоновых кислот
1) + HCl (любая сильная кислота) → появление хлопьев нерастворимых высших кислот
10. Как отличить муравьиную кислоту от уксусной
Муравьиная кислота содержит и альдегидную группу тоже, следовательно, возможны реакции, характерные альдегидам:
1) + [Ag(NH3)2]OH → восстановление металлического серебра и выделение газа (так как кислота окисляется до CO2)
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета и выделение газа (так как кислота окисляется до CO2).
11. Как распознать низшие амины
1) раствор лакмуса → изменение окраски на синюю (так как среда раствора щелочная)
1) раствор фенолфталеина → изменение окраски на малиновую
12. Как распознать анилин
1) + Br2 → выпадение белого осадка 2,4,6-триброманилина
13. Как распознать белок
1) + HNO3 → желтое окрашивание (ксантопротеиновая реакция)
2) + Cu(OH)2 → фиолетовое окрашивание (биуретовая реакция)
14. Как распознать глюкозу C6H12O6
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора (реакция на несколько гидроксильных групп)
2) + Cu(OH)2 → при нагревании образуется осадок Cu2O красного цвета (реакция на альдегидную группу)
3) + [Ag(NH3)2]OH → восстановление металлического серебра
15. Как распознать крахмал
1) + I2 → появление синей окраски.
Перманганат калия
В каждой домашней аптечке обязательно есть марганцовка —бытовое дезинфицирующее средство.
Научное название этого соединения — перманганат калия КМnО4. Оно представляет собой калиевую соль сильной марганцевой кислоты НМnO4, в которой марганец находится в высшей степени окисления (+7). Поэтому неудивительно, что КМnO4 является сильным окислителем. На свету он окисляет даже воду с выделением молекулярного кислорода.
Растворите в воде несколько кристалликов КМnO4 и подождите некоторое время. Вы заметите, что малиновая окраска раствора постепенно станет более бледной, а затем и совсем исчезнет. На стенках сосуда образуется коричневый налет оксида марганца (IV):
4 КМп04 + 2 Н20 = 4 MnO2 + 4 КОН + 3O2.
Многие считают, что перманганат калия хорошо растворим в воде. На самом деле растворимость этой соли при комнатной температуре (20°С) составляет всего 6,4 г на 100 г воды. Однако раствор имеет настолько интенсивную окраску, что кажется концентрированным.
В промышленности КМпO4 получают электролизом концентрированного раствора гидроксида калия с марганцевым анодом (анод — это электрод, на котором идет процесс окисления).
В процессе электролиза материал анода постепенно растворяется с образованием знакомого всем фиолетового раствора, содержащего перманганат-ионы.
На катоде происходит выделение молекулярного водорода. Схему электролиза можно представить в виде уравнений реакций:
Мn + 8 ОН — 7 е = МпO4ˉ+ 4 Н20 (анод);
4 Н2O + 2 е = Н2 + 2 ОНˉ (катод).
Суммарное уравнение реакции можно записать следующим образом:
2 Мn + 2 КОН+ 6 Н20 = 2 КМпO4 + 7 Н2.
Умеренно растворимый в воде перманганат калия выделяется в виде осадка.
Было бы заманчиво вместо привычной марганцовки производить перманганат натрия, ведь гидроксид натрия доступнее, чем гидроксид калия. Однако в этих условиях выделить NaMn04 практически невозможно: в отличие перманганата калия, он прекрасно растворим в воде — при 20 °C его растворимость составляет 144 г на 100 г воды.
Перманганат калия — очень сильный окислитель. Он может реагировать со многими органическими и неорганическими соединениями. Чем больше электронов способен принять окислитель в ходе реакции, тем большее количество молей другого вещества он окислит.
Число электронов, переходящих к окислителю, зависит от условий проведения реакции, например от кислотности среды. Так, в нейтральной или слабощелочной среде перманганат-ион восстанавливается до диоксида марганца:
МnO4ˉ+ 2 Н2O + 3 еˉ = MnO2 + 4ОНˉ
Но особенно ярко окисляющая способность перманганата проявляется в кислой среде:
МnO4ˉ+ 8 Н+ + 5 еˉ = Мn2+ + 4 Н2O
Подкисленный крепкий раствор перманганата буквально сжигает многие органические соединения, превращая их в углекислый газ и воду. Этим иногда пользуются химики для мытья лабораторной посуды, загрязненной плохо смываемыми остатками органических веществ.
В домашних условиях тоже можно использовать марганцовку для пользы дела, например, чтобы почистить фаянсовую раковину в ванной.
Для того чтобы получить самодельное «моющее средство», надо смешать марганцовку с кислотой. Конечно, не со всякой. Некоторые кислоты могут сами окисляться. В частности, если взять соляную кислоту, то из нее выделится ядовитый хлор:
2 КМпO4 + 16 HCI = 5 CI2 + 2 MnCI2 + 2 KCI + 8 Н20.
Так его часто и получают в лабораторных условиях. Поэтому для наших цепей лучше использовать разбавленную (примерно 5-процентную серную кислоту). В крайнем случае, ее можно заменить разбавленной уксусной кислотой — столовым уксусом.
Возьмем примерно 50 мл (четверть стакана) раствора кислоты, добавим 1−2 г перманганата калия (на кончике ножа) и тщательно перемешаем деревянной палочкой. Затем промоем ее под струей воды и привяжем к концу кусок поролоновой губки.
Вот этой «кисточкой» быстро, но аккуратно размажем окислительную смесь по загрязненному участку раковины. Вскоре жидкость начнет менять цвет на темно-вишневый, а затем — на коричневый. Значит, реакция окисления пошла полным ходом.
Работать надо очень осторожно. Чтобы смесь не попала на руки и одежду, хорошо бы надеть клеенчатый фартук.
И не следует медлить, так как окислительная смесь очень едкая и со временем съедает даже поролон.
После использования поролоновую «кисть» нужно погрузить в заранее приготовленную банку с водой, промыть и выбросить.
Во время подобной очистки раковины может появиться неприятный запах, издаваемый продуктами неполного окисления органических загрязнений на фаянсе и самой уксусной кислоты. Поэтому помещение должно проветриваться.
Минут через 15−20 побуревшую смесь следует смыть струей воды. И хотя раковина предстанет в ужасном виде — вся в бурых пятнах, волноваться не стоит: продукт восстановления перманганата калия (диоксид марганца Мп02) легко удалить, восстановив его до хорошо растворимой соли марганца (II).
Сделать это лучше всего с помощью такого восстановителя как пероксид водорода Н2O2. Лучше взять, аптечный 3-процентный раствор. Вместо аптечного пероксида можно использовать таблетки гидроперита — соединения пероксида водорода с мочевиной состава CO (NH2)2∙H2O2.
Это не химическое соединение, поскольку между молекулами мочевины и пероксида водорода нет химических связей. Молекулы Н2O2 как бы включаются в длинные узкие каналы в кристаллах мочевины и не могут оттуда выйти, пока вещество не растворят в воде. Поэтому такие соединения называют соединениями включения.
Одна таблетка гидроперита соответствует 15 мл (столовая ложка) 3-процентного раствора пероксида водорода. Для получения 1-процентного раствора Н2O2 берут две таблетки гидроперита и 100 мл воды.
Используя Н2O2 в качестве восстановителя Мп02, нужно знать одну тонкость. Мп02 — хороший катализатор разложения пероксида водорода на воду и кислород:
И если просто обработать раковину раствором Н202, то он мгновенно «вскипит», выделяя кислород, а бурый налет так и останется (ведь катализатор не должен расходоваться в ходе реакции). Кстати аналогичную реакцию иногда рекомендуют для лечения больных десен: их сначала обрабатывают слабым раствором марганцовки, а потом пероксидом водорода. Выделяющийся при реакции молекулярный кислород и является главным лечебным средством. Поэтому процедуру так и называют — «кислородные ванночки»
Чтобы избежать каталитического разложения Н2O2, нужна кислая среда. Здесь тоже подойдет уксус. Сильно разбавим аптечную перекись, добавим немного уксуса и этой смесью промоем раковину. Произойдет настоящее чудо: грязно-бурая поверхность засверкает белизной и станет как новая. А чудо случится в полном соответствии с реакцией:
МnO2 + Н2O2 + 2 Н+ = O2 + Мn2+ + 2 Н2O.
Остается только смыть хорошо растворимую соль марганца струей воды.
Для снятия налета МпO2 можно использовать в качестве восстановителей также водные растворы органических кислот: щавелевой, лимонной, винной и др. Причем специально подкислять их не понадобится — кислоты сами создают в водном растворе достаточно кислую среду.