что обеспечивает мышечное сокращение
Биомеханика мышечного сокращения
В. Н. Селуянов, В. А. Рыбаков, М. П. Шестаков
Глава 1. Модели систем организма
1.1.5. Биомеханика мышечного сокращения
Сила — векторная величина, являющаяся мерой механического воздействия на материальную точку или тело со стороны других тел или полей (Б. М. Яворский, А. А. Детлаф, 1974). Сила полностью задана, если указаны ее численное значение, направление и точка приложения.
В теории и методике физического воспитания рассматривают физическое качество силу как способность человека напряжением мышц преодолевать механические и биомеханические силы, препятствующие действию (Зациорский В. М., 1972; Л. П. Матвеев, 1991).
Мышцы могут проявлять силу: без изменения своей длины (изометрический режим), при уменьшении длины (изотонический режим), при удлинении (эксцентрический режим), при использовании специальной аппаратуры возможно соблюдение изокинетического режима (в ходе сокращения мышц соблюдается либо постоянная скорость, либо сила).
Силовое проявление мышцы зависит от:
— интенсивности активации мотнейронного пула спинного мозга данной мышцы;
— количества активированных двигательных единиц и мышечных волокон;
— количества миофибрилл в каждом мышечном волокне;
— скорости сокращения миофибрилл, которая зависти от активности миозиновой АТФ-азы и величины внешнего сопротивления;
— законов механики мышечного сокращения (сила — длина мышцы, сила — скорость сокращения);
— начального состояния исполнительного аппарата (утомленные мышечные волокна демонстрируют меньшую силу).
Спортсмен при желании сократить какую-либо мышцу активизирует соответствующий двигательный нейрон в коре головного мозга, который посылает импульсы в спинной мозг к мотонейронному пулу, обслуживающему данную мышцу. Поскольку в мотонейронном пуле размеры мотонейронов различаются, то при низкой частоте импульсации из ЦНС могут активироваться только низкопороговые мотонейроны. Каждый мотонейрон иннервирует свои мышечные волокна. Поэтому активация мотонейрона приводит к рекрутированию или возбуждению соответствующих мышечных волокон. Каждое активное мышечное волокно под влиянием электрических импульсов выпускает из СПР ионы кальция, которые снимают ингибитор с активных центров актина. Это обеспечивает образование актин-миозиновых мостиков и начало их поворота и мышечного сокращения. На поворот мостиков и отсоединение актина от миозина тратится энергия одной молекулы АТФ. Продолжительность работы мостика составляет 1 мс. Вероятность образования мостиков зависит от взаимного расположения между собой нитей актина и миозина, отсюда возникает зависимость сила — длина активной мышца, а также от скорости взаимного перемещения (скольжения) их одной по отношению к другой, соответственно, имеем зависимость «сила-скорость».
Зависимость «сила — длина активного мышечного волокна» определяется, как правило, относительным расположением между собой головок миозина и активных центров актина. Максимальное количество мостиков возникает при некоторой средней длине мышцы. Отклонение от этой длины в большую или меньшую сторону ведет к снижению силовых проявлений мышечного волокна (мышцы). Однако, в случае растяжения некоторых мышц, еще не в активном состоянии, могут возникать значительные силы сопротивления растяжению, например, в мышцах сгибателях голеностопного или лучезапястного сустава. Эти силы связаны с растяжением соединительных тканей, например, перемезиума. В биомеханике в таком случае говорят о параллельном упругом компоненте мышцы. Упругостью обладают сухожилия, зет-пластинки саркомеров и нити миозина, к которым прикреплены головки. Такую упругость называют последовательной упругой компонентой.
Растягивание активной мышцы приводит не только к накоплению энергии упругой деформации в последовательной упругой компоненте, но и к прекращению работы мостиков, а именно, они перестают отцепляться за счет энергии молекул АТФ. Разрыв мостиков происходит благодаря действию внешней — механической силы. В итоге отрицательная работа мышц выполняется с очень высоким коэффициентов полезного действия, с минимальными затратами АТФ, а значит и кислорода.
Мышечное сокращение
Мы́шечное сокраще́ние — реакция мышечных клеток на воздействие нейромедиатора, реже гормона, проявляющаяся в уменьшении длины клетки. Эта жизненно важная функция организма, связанная с оборонительными, дыхательными, пищевыми, половыми, выделительными и другими физиологическими процессами.
Все виды произвольных движений — ходьба, мимика, движения глазных яблок, глотание, дыхание и т. п. осуществляются за счёт скелетных мышц. Непроизвольные движения (кроме сокращения сердца) — перистальтика желудка и кишечника, изменение тонуса кровеносных сосудов, поддержание тонуса мочевого пузыря — обусловлены сокращением гладкой мускулатуры. Работа сердца обеспечивается сокращением сердечной мускулатуры.
Содержание
Введение
Основой всех типов мышечного сокращения служит взаимодействие актина и миозина. В скелетных мышцах за сокращение отвечают миофибриллы (примерно две трети сухого веса мышц). Миофибриллы — структуры толщиной 1 — 2 мкм, состоящие из саркомеров — структур длиной около 2,5 мкм, состоящих из актиновых и миозиновых (тонких и толстых) филаментов и Z-дисков, соединённых с актиновыми филаментами. Сокращение происходит при увеличении концентрации в цитоплазме ионов Ca 2+ в результате скольжения миозиновых филаментов относительно актиновых. Источником энергии сокращения служит АТФ. КПД мышечной клетки около 50 %.
Скольжение миозина относительно актина
Головки миозина расщепляют АТФ и за счет высвобождающейся энергии меняют конформацию, скользя по актиновым филаментам. Цикл можно разделить на 4 стадии:
Далее цикл повторяется до уменьшения концентрации ионов Ca 2+ или исчерпании запаса АТФ (в результате смерти клетки). Скорость скольжения миозина по актину ≈15 мкм/сек. В миозиновом филаменте много (около 500) молекул миозина и, следовательно, при сокращении цикл повторяется сотнями головок сразу, что и приводит к быстрому и сильному сокращению. Следует заметить, что миозиин ведёт себя как фермент — актин-зависимая АТФаза. Так как каждое повторение цикла связано с гидролизом АТФ, а следовательно, с положительным изменением свободной энергии, то процесс однонаправленный. Миозин движется по актину только в сторону плюс-конца.
Источник энергии для сокращения
Для сокращения мышцы используется энергия гидролиза АТФ, но мышечная клетка имеет крайне эффективную систему регенерации запаса АТФ, так что в расслабленной и работающей мышце содержание АТФ примерно равно. Фермент фосфокреатинкиназа катализирует реакцию между АДФ и креатинфосфатом, продукты которой — АТФ и креатин. Креатинфосфат содержит больше запасённой энергии, чем АТФ. Благодаря этому механизму при вспышке активности в мышечной клетке падает содержание именно креатинфосфата, а количество универсального источника энергии — АТФ — не изменяется. Механизмы регенерации запаса АТФ могут различаться в зависимости от парциального давления кислорода в окружающих тканях (см. Анаэробные организмы).
Механизм регуляции
В основном в регуляции мышечной активности участвуют нейроны, но есть случаи, когда сокращением гладкой мускулатуры управляют и гормоны (например, адреналин и окситоцин). Сигнал о сокращении можно разделить на несколько этапов:
От клеточной мембраны до саркоплазматического ретикулума
От выделения ионов Ca 2+ до сокращения миофибрилл
Для того, чтобы контролировать сокращение, к актиновому филаменту прикрепляется белок тропомиозин и комплекс из трёх белков — тропонин (субъединицы этого комплекса называются тропонинами T,I и C). Тропонин C — близкий гомолог другого белка, кальмодулина. Через каждые семь субъединиц актина расположен только один тропониновый комплекс. Связь актина с тропонином I перемещает тропомиозин в положение, мешающее связи миозина с актином. Тропонин C связывается с четырьмя ионами Ca 2+ и ослабляет действие тропонина I на актин, и тропомиозин занимает положение, не препятствующее связи актина с миозином.
Что обеспечивает мышечное сокращение
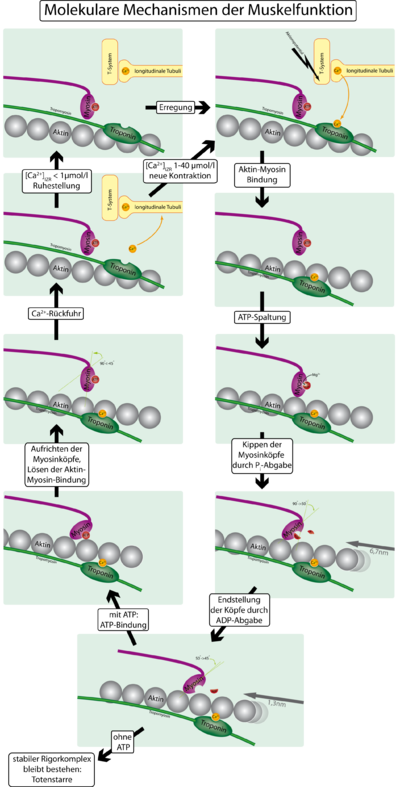
Выделяют несколько последовательных этапов запуска и осуществления мышечного сокращения.
1. Потенциал действия распространяется вдоль двигательного нервного волокна до его окончаний на мышечных волокнах.
2. Каждое нервное окончание секретирует небольшое количество нейромедиатора ацетилхолина.
3. Ацетилхолин действует на ограниченную область мембраны мышечного волокна, открывая многочисленные управляемые ацетилхолином каналы, проходящие сквозь белковые молекулы, встроенные в мембрану.
4. Открытие управляемых ацетилхолином каналов позволяет большому количеству ионов натрия диффундировать внутрь мышечного волокна, что ведет к возникновению на мембране потенциала действия.
5. Потенциал действия проводится вдоль мембраны мышечного волокна так же, как и по мембране нервного волокна.
6. Потенциал действия деполяризует мышечную мембрану, и большая часть возникающего при этом электричества течет через центр мышечного волокна. Это ведет к выделению из саркоплазматического ретикулума большого количества ионов кальция, которые в нем хранятся.
7. Ионы кальция инициируют силы сцепления между актиновыми и миозиновыми нитями, вызывающие скольжение их относительно друг друга, что и составляет основу процесса сокращения мыщц.
8. Спустя долю секунды с помощью кальциевого насоса в мембране саркоплазматического ретикулума ионы кальция закачиваются обратно и сохраняются в ретикулуме до прихода нового потенциала действия. Удаление ионов кальция от миофибрилл ведет к прекращению мышечного сокращения.
Далее мы обсудим молекулярные механизмы этого процесса.
Молекулярные механизмы мышечного сокращения
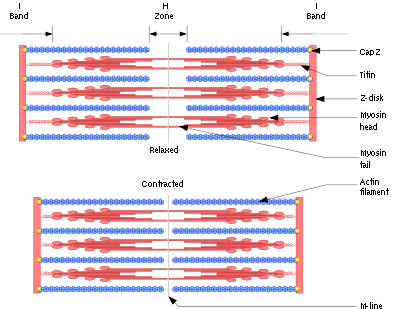
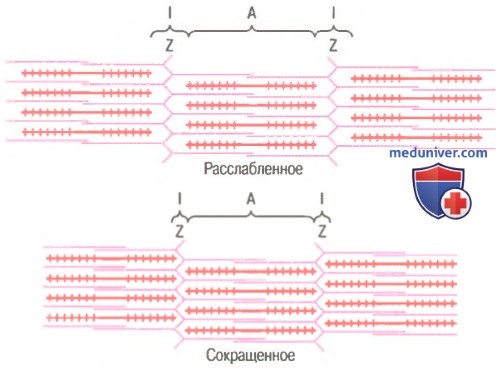
Механизм скольжения нитей для мышечного сокращения. На рисунке показан основной механизм мышечного сокращения. Показано расслабленное состояние саркомера (вверху) и сокращенное состояние (внизу). В расслабленном состоянии концы актиновых нитей, отходящие от двух последовательных Z-дисков, лишь незначительно перекрываются. Наоборот, в сокращенном состоянии актиновые нити втягиваются внутрь между миозиновыми так сильно, что их концы максимально перекрывают друг друга. При этом Z-диски притягиваются актиновыми нитями к концам миозиновых. Таким образом, мышечное сокращение осуществляется путем механизма скольжения нитей.
Что заставляет нити актина скользить внутрь среди нитей миозина? Это связано с действием сил, генерируемых при взаимодействии поперечных мостиков, исходящих от нитей миозина, с нитями актина. В условиях покоя эти силы не проявляются, однако распространение потенциала действия вдоль мышечного волокна приводит к выделению из саркоплазматическо-го ретикулума большого количества ионов кальция, которые быстро окружают миофи-бриллы. В свою очередь, ионы кальция активируют силы взаимодействия между нитями актина и миозина, в результате начинается сокращение. Для осуществления процесса сокращения необходима энергия. Ее источником являются высокоэнергетические связи молекулы АТФ, которая разрушается до АДФ с высвобождением энергии. В следующих разделах мы приведем известные детали молекулярных процессов сокращения.
Молекулярные особенности сократительных нитей
Миозиновая нить. Она состоит из множества молекул миозина, молекулярная масса каждой составляет около 480000. На рисунке показана отдельная молекула; и также — объединение многих молекул миозина в миозиновую нить, а также взаимодействие одной стороны этой нити с концами двух актиновых нитей.
В состав молекулы миозина входят 6 полипептидных цепей: 2 тяжелые цепи с молекулярной массой около 200000 каждая и 4 легкие цепи с молекулярной массой около 20000 каждая. Две тяжелые цепи спирально закручиваются вокруг друг друга, формируя двойную спираль, которую называют миозиновым хвостом. С одного конца обе цепи изгибаются в противоположных направлениях, формируя глобулярную полипептидную структуру, называемую миозиновой головкой. Таким образом, на одном конце двойной спирали молекулы миозина образуются 2 свободные головки; 4 легкие цепи также включены в состав миозиновой головки (по 2 в каждой). Они помогают регулировать функцию головки во время мышечного сокращения.
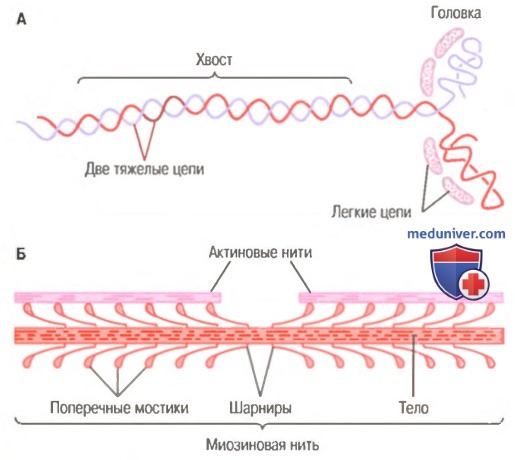
Б. Объединение многих молекул миозина в одну миозиновую нить.
Показаны также тысячи миозиновых поперечных мостиков и взаимодействие их головок с прилежащими актиновыми нитями.
Миозиновая нить состоит из 200 или более отдельных молекул миозина. Видно, что хвосты молекул миозина объединяются, формируя тело нити, а многочисленные головки молекул выдаются наружу по сторонам тела. Кроме того, наряду с головкой в сторону выступает часть хвоста каждой миозиновой молекулы, образуя плечОу которое выдвигает головку наружу от тела, как показано на рисунке. Выступающие плечи и головки вместе называют поперечными мостиками. Каждый поперечный мостик может сгибаться в двух точках, называемых шарнирами. Один из них расположен в месте, где плечо отходит от тела миозиновой нити, а другой — где головка крепится к плечу. Движение плеча позволяет головке или выдвигаться далеко наружу от тела миозиновой нити, или приближаться к телу. В свою очередь, повороты головки участвуют в процессе сокращения, что обсуждается в следующих разделах.
Общая длина каждой миозиновой нити остается постоянной и равна почти 1,6 мкм. В самом центре миозиновой нити на протяжении 0,2 мкм поперечных мостиков нет, поскольку снабженные шарнирами плечи отходят в стороны от центра.
Сама миозиновая нить сплетена таким образом, что каждая последующая пара поперечных мостиков смещена в продольном направлении относительно предыдущей на 120°, что обеспечивает распределение поперечных мостиков во всех направлениях вокруг нити.
АТФ-азная активность миозиновой головки. Есть и другая особенность миозиновой головки, необходимая для мышечного сокращения: миозиновая головка функционирует как фермент АТФ-аза. Как объясняется далее, это свойство позволяет головке расщеплять АТФ и использовать энергию расщепления высокоэнергетической связи для процесса сокращения.
Актиновая нить. Актиновая нить состоит из трех белковых компонентов: актина, тропомиозина и тропонина.
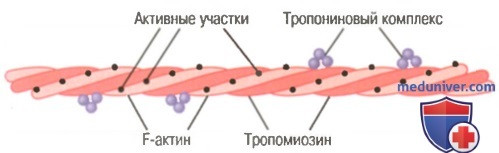
К одному концу каждой молекулы тропомиозина прикреплен тропониновый комплекс, который запускает сокращение.
Основой актиновой нити являются две цепи белковой молекулы F-актина. Обе цепи закручиваются в спираль так же, как и молекула миозина.
Каждая цепь двойной спирали F-актина состоит из полимеризованных молекул G-актина с молекулярной массой около 42000. К каждой молекуле G-актина прикреплена 1 молекула АДФ. Полагают, что эти молекулы АДФ являются активными участками на актиновых нитях, с которыми взаимодействуют поперечные мостики миозиновых нитей, обеспечивая мышечное сокращение. Активные участки на обеих цепях F-актина двойной спирали расположены со смещением таким образом, что вдоль всей поверхности актиновой нити встречается один активный участок примерно через каждые 2,7 нм.
Длина каждой актиновой нити — около 1 мкм. Основания актиновых нитей прочно встроены в Z-диски; концы этих нитей выступают в обоих направлениях, располагаясь в пространствах между миозиновыми молекулами.
Молекулы тропомиозина. Актиновая нить также содержит другой белок — тропомиозин. Каждая молекула тропомиозина имеет молекулярную массу 70000 и длину 40 нм. Эти молекулы спирально оплетают спираль из F-актина. В состоянии покоя молекулы тропомиозина располагаются поверх активных участков актиновых нитей, препятствуя их взаимодействию с миозиновыми нитями, лежащему в основе сокращения.
Тропонин и его роль в мышечном сокращении. По ходу молекул тропомиозина к ним периодически прикреплены другие белковые молекулы, называемые тропонином. Они представляют собой комплексы трех слабосвязанных белковых субъединиц, каждая из которых играет специфическую роль в регуляции мышечного сокращения. Одна из субъединиц (тропонин I) имеет высокое сродство к актину, другая (тропонин Т) — к тропомиозину, третья (тропонин С) — к ионам кальция. Считают, что этот комплекс прикрепляет тропомиозин к актину. Высокое сродство тропонина к ионам кальция, как полагают, инициирует процесс сокращения, о чем говорится в следующей статье.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Что обеспечивает мышечное сокращение
Эффективность двигателя или автомашины рассчитывают как процент потребляемой энергии, которая превращается в работу вместо тепла. В мышцах количество энергии, способной превращаться в работу, даже при наилучших условиях составляет менее 25% всей энергии, доставляемой к мышце (химической энергии питательных веществ), а остальная энергия превращается в тепло. Причина этой низкой эффективности связана с тем, что примерно половина энергии питательных веществ теряется во время образования АТФ, и только 40-45% энергии самой АТФ может позднее превратиться в работу.
Максимальная эффективность реализуется лишь при условии сокращения мышцы с умеренной скоростью. При медленном сокращении мышцы или без какого-либо ее укорочения во время сокращения освобождается небольшое количество поддерживающего тепла, хотя работа практически не выполняется, что снижает эффективность преобразования до нуля. Напротив, если сокращение слишком быстрое, большая доля энергии используется на преодоление вязкого трения внутри самой мышцы, и это также снижает эффективность сокращения. Обычно максимальная эффективность развивается, когда скорость сокращения составляет около 30%.
Характеристики сокращения целой мышцы
Многие особенности сокращения мышцы можно продемонстрировать на примере одиночных мышечных сокращений. Такие сокращения вызывают с помощью одиночного электрического возбуждения, иннервирующего мышцу нерва, или короткого электрического раздражения самой мышцы, что ведет к развитию одиночного сокращения, продолжающегося долю секунды.
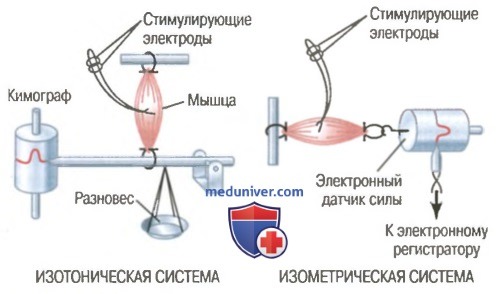
Изометрическое и изотоническое сокращение. Мышечное сокращение называют изометрическим, если мышца не укорачивается во время сокращения, и изотоническим — если мышца укорачивается, но ее напряжение на протяжении всего сокращения остается постоянным.
В изометрической системе мышца сокращается без уменьшения своей длины, а в изотонической системе мышца укорачивается против фиксированной нагрузки: мышца поднимает чашу весов с разновесом. Изометрическая система строго регистрирует изменения силы самого мышечного сокращения, а параметры изотонического сокращения зависят от нагрузки, против которой мышца сокращается, а также от инерции нагрузки. В связи с этим при сравнении функциональных особенностей различных типов мышц чаще всего используют изометрическую систему.
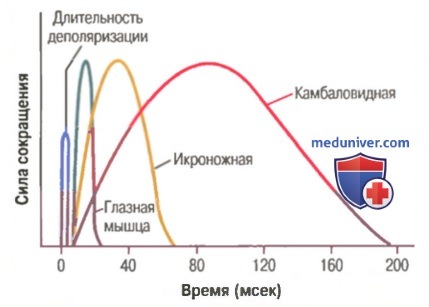
Особенности одиночных изометрических сокращений, зарегистрированных от разных мышц. В теле человека имеются много мышц разного размера — от очень маленькой стременной мышцы в среднем ухе, длиной в несколько миллиметров и диаметром около 1 мм, до очень большой четырехглавой мышцы, в 500000 раз крупнее стременной. При этом диаметр волокон может быть маленьким (10 мкм) или большим (80 мкм). Наконец, энергетика мышечных сокращений значительно варьирует от одной мышцы к другой. Поэтому не удивительно, что механические характеристики сокращений разных мышц различаются.
На рисунке показаны кривые регистрации изометрических сокращений трех типов скелетных мышц: глазной мышцы (длительность изометрического сокращения менее 1/40 сек), икроножной мышцы (длительность сокращения около 1/15 сек) и камбаловиднй мышцы (длительность сокращения примерно 1/3 сек). Интересно, что эти длительности сокращений приспособлены к функциям соответствующих мышц. Движения глаз должны быть чрезвычайно быстрыми, чтобы поддерживать фиксацию глаз на объекте для обеспечения ясного видения. Икроножная мышца должна сокращаться умеренно быстро, чтобы обеспечить скорость движения нижней конечности, достаточную для бега или прыжков. А камбаловидная мышца имеет дело в основном с медленными сокращениями для непрерывной длительной поддержки тела против силы тяжести.
Быстрые и медленные мышечные волокна. Как обсуждается в предыдущих статьях, посвященных спортивной физиологии, каждая мышца тела состоит из совокупности так называемых быстрых и медленных мышечных волокон, а также других волокон с переходными свойствами. В состав быстрореагирующих мышц входят в основном быстрые волокна и лишь небольшое число медленных. И наоборот, медленнореагирующие мышцы составлены главным образом из медленных волокон. Различия между этими двумя типами волокон следующие.
Быстрые волокна: (1) крупные волокна, обеспечивающие большую силу сокращения; (2) имеют хорошо развитый саркоплазматический ретикулум для быстрого выделения ионов кальция, инициирующих сокращение; (3) содержат большое количество гликолитических ферментов для быстрого освобождения энергии путем гликолиза; (4) имеют сравнительно бедное кровоснабжение, поскольку окислительный метаболизм имеет второстепенное значение; (5) содержат немного митохондрий также в связи со второстепенностью окислительного метаболизма.
Медленные волокна: (1) более мелкие волокна; (2) иннервируются также более мелкими нервными волокнами; (3) имеют хорошо развитую систему кровеносных сосудов и капилляров для доставки большого количества кислорода; (4) содержат значительно больше митохондрий для обеспечения высоких уровней окислительного метаболизма; (5) содержат большое количество миоглобина — железосодержащего белка, подобного гемоглобину эритроцитов. Миоглобин связывается с кислородом и хранит его до момента, когда в нем возникнет потребность (это также значительно увеличивает скорость транспорта кислорода в митохондрии). Миоглобин придает медленным волокнам красноватый вид, поэтому их называют красными волокнами, а из-за дефицита красного миоглобина в быстрых волокнах их называют белыми волокнами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что обеспечивает мышечное сокращение
АТФ как источник энергии для сокращения. Химические явления при движении головок миозина. При сокращении мышцы выполняется работа и расходуется энергия. Во время процесса сокращения много молекул АТФ расщепляются с формированием АДФ. Чем больше работа, производимая мышцей, тем больше расщепляется АТФ. Это называют эффектом Фена. При этом, как полагают, происходят следующие явления.
1. До начала сокращения головки поперечных мостиков связываются с АТФ. АТФ-азная активность головки миозина немедленно расщепляет АТФ, но продукты расщепления (АДФ и фосфатный ион) остаются связанными с головкой. В этом состоянии конформация головки такова, что она располагается перпендикулярно нити актина, но еще не прикрепляется к ней.
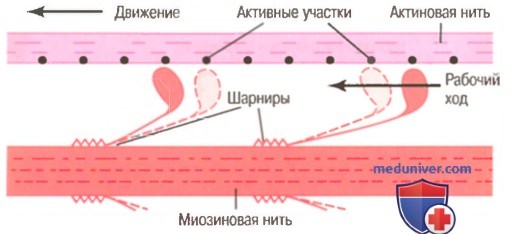
2. Когда тропонин-тропомиозиновый комплекс связывается с ионами кальция, активные участки нити актина открываются, и миозиновые головки соединяются с ними.
3. Связь между головкой поперечного мостика и активным участком на нити актина вызывает конформационное изменение в головке, заставляющее ее наклониться к плечу поперечного мостика. Это обеспечивает рабочий ход для протягивания актиновой нити. Рабочий ход активируется энергией, сохраненной в головке, как во «взведенной» пружине, в виде ее конформационного изменения, происходящего ранее во время расщепления молекулы АТФ.
4. Наклон головки поперечного мостика позволяет освободить АДФ и фосфатный ион, предварительно соединенные с головкой. К месту, от которого выделилась АДФ, прикрепляется новая молекула АТФ, что ведет к отсоединению головки от актина.
5. После отсоединения головки от актина новая молекула АТФ расщепляется, начиная следующий цикл, ведущий к новому рабочему ходу. Это значит, что энергия снова «взводит» головку в перпендикулярное положение, из которого она готова начать новый цикл рабочего хода.
6. Когда «взведенная» головка (с запасом энергии, извлеченной из расщепленной АТФ) связывается с новым активным участком на нити актина, она «разряжается», обеспечивая новый рабочий ход. Таким образом, процесс повторяется снова и снова до тех пор, пока нити актина не притянут Z-диску вплотную к концам миозиновых нитей или пока нагрузка на мышцу не станет слишком большой для осуществления дальнейшей тяги.
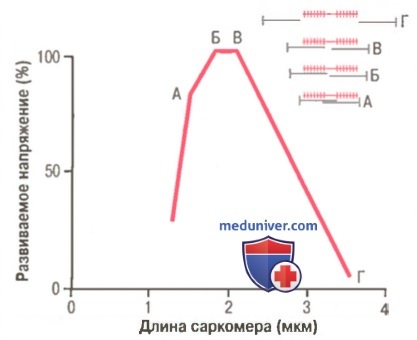
Видно, что максимальная сила сокращения развивается при длине саркомера 2,0-2,2 мкм.
Вверху справа показано относительное расположение актиновых и миозиновых нитей при разной длине саркомера, соответственно точкам от А до Г.
На рисунке демонстрируется влияние длины саркомера и степени перекрытия миозиновых и актиновых нитей на активное напряжение, развиваемое сокращающимся мышечным волокном. Справа черными линиями показаны разные степени перекрытия миозиновых и актиновых нитей при разной длине саркомера. В точке Г на кривой актиновая нить по всей длине оттянута от конца миозиновой нити, и перекрытие между актином и миозином отсутствует. В этом случае напряжение, развиваемое активированной мышцей, равно нулю. Затем по мере укорочения саркомера нить актина начинает перекрывать миозиновую нить, и напряжение постепенно увеличивается до тех пор, пока длина саркомера не уменьшится примерно до 2,2 мкм.
В этом случае актиновая нить перекрывает все поперечные мостики миозиновой нити, но еще не достигает ее центра. При дальнейшем укорочении саркомер сохраняет максимальное на пряжение до тех пор, пока длина саркомера не уменьшится до 2 мкм, что соответствует точке Б на кривой. В этом случае концы двух актиновых нитей начинают перекрывать друг друга в дополнение к перекрытию миозиновых нитей. По мере уменьшения длины саркомера от 2 мкм вплоть до 1,65 мкм, как в точке А, сила сокращения быстро уменьшается. В этой точке два Z-диска саркомера примыкают к концам миозиновых нитей. Если осуществляется сокращение с целью еще большего укорочения саркомера, концы миозиновых нитей изгибаются, и, как видно на рисунке, сила сокращения приближается к нулю, однако вся мышца теперь сжата до своей минимальной длины.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021