что обеспечивает бромную воду
Бромная вода: что это такое и чем опасна для человека, химическая формула брома, методы очистки, взаимодействие с другими веществами
Рассмотрим раствор, активно используемый в промышленности. В фокусе внимания – бромная вода: что это такое, состав, как выглядит, структурная химическая формула и свойства, чем опасен бром для человека – пройдемся по всем этим вопросам, чтобы вы имели полное представление.
Сразу отметим, что особенно важна и востребована оно в лабораториях, где используется для выявления алкенов, которые она идентифицирует, изменяя свой цвет. И развеем один старый миф: что ее якобы давали советским солдатам для снижения потенции. Вряд ли, потому что для этого не было поводов, она не уменьшает либидо и не оказывает отрицательного влияния на мужскую силу. Если ее и подливали в напитки, то лишь в качестве мягкого снотворного, хотя и этому нет никаких доказательств. Ну а теперь сосредоточимся на более специфических моментах.
Определение
Это раствор, состав которого можно записать по схеме:
«бром плюс вода и кислоты» (бромоводородная и бромноватистая)
В обычных условиях это желто-оранжевая по своему цвету жидкость с высокой степенью прозрачности. Является достаточно активным веществом, успешно сочетающимся как с органикой, так и с неорганическими соединениями. Довольно сильный окислитель, быстро воздействующий в щелочной среде на катионы Mn+3, Ni+3, Cr+3, Co+2, Fe+2, а также в отдельном порядке на фенолы.
Формула
Записывается максимально просто – Br2, – не только соответствуя встречающейся в природе молекуле элемента, но и отражая ее количественный и качественный состав.
Но также содержит HBr и HBrO, которые тоже заслуживают внимания, так как определяют особенности хранения. За счет наличия этих свободных кислот значительно снижает pH-уровень той технологической среды, в которую добавлена (и эта ее особенность имеет ключевое значение при фильтрации, естественно, при соблюдении должной дозировки). И является важным компонентом при проведении целого ряда анализов и при изготовлении многих органических препаратов.
Формула бромной воды в химии
Br2 позволяет определить молекулярную массу – из следующих уравнений:
Mr(Br2) = 2 х Ar(Br), то есть Mr(Br2) = 2 х 80 = 160
Одна из наиболее частых реакций:
Br2 + H2O ⇌ HBr + HBrO
Если развернуть это описание и осветить его более подробно, система уравнений приобретет вид:
Br2(K) + nH2O ⇌ Br2 x nH2O(P),
что, в свою очередь, можно преобразовать в:
Br2 x nH2O ⇌ HBr + HBrO + (n – 1) x H2O,
из этого вырастает:
HBrO + H2O ⇌ BrO- + H3O+
К тому, как взаимодействуют оксид брома и вода, нужно добавить, что массовая доля элемента в составе в норме не превышает 3,5%, но при наличии бромидов степень растворимости увеличится благодаря появлению следующих комплексов:
которые подвергаются постепенному разложению под воздействием света:
1,5 м3/ч Для технической воды
1,5 м3/ч Для технической воды
MBFT-75 Мембрана на 75GPD
Последний процесс запускает бромноватистая кислота и, чтобы его предупредить, следует держать вещество в затемненной таре или хотя бы не подвергать его воздействию прямых лучей. При должном хранении с соблюдением всех норм оно сбережет свои полезные в условиях лаборатории свойства в течение долгого срока.
Электронная формула
Оставим на время в стороне вещества, которые взаимодействуют с бромной водой, и посмотрим на строение атома Br. При массовом числе 80 у него 4 орбиты, по которым вокруг ядра вращаются 35 электронов. Также у него есть 45 нейтронов и 35 протонов.
Распределение можно записать так:
История открытия
Сам Br был впервые описан в 1826 году Антуаном Баларом – препаратором из Монпелье. Молодой ученый получил темно-бурую жидкость из сожженных морских водорослей и назвал ее муридом (по аналогии с латинским muria, то есть «рассол»). Хотя немногим раньше, в 1825м, ассистент профессора Гмелина, студент Левиг с помощью хлора выделил элемент из кройцнахского источника. Правда, пока немец собирал достаточное количество материала для проведения исследований, француз его опередил, заявив о своем открытии.
В любом случае заседатели специально собранной комиссии (среди которых был и знаменитый Гей-Люссак) из Парижской академии наук посовещались и признали название Балара неудачным. Дело в том, что в то время семейству солей хлороводородной кислоты было дано имя муриаты. Вот ученые и посчитали, что слишком созвучные термины вызовут путаницу, и вместо этого предложили вариант Brome (с греческого переводится как «зловонный»), потому что открытие неприятно пахло. Его и ввели в употребление по всему миру, естественно, с поправкой на языковые особенности.
Приготовление бромной воды: получение, применение, цвет
Сначала – несколько слов о самом Br. При стабильно комнатной температуре он является жидким (и это единственный неметалл с таким состоянием) и обладает теми же характеристиками, что и галогены. По своей реакционной способности он находится между хлором и йодом. Визуально он тягучий и красно-коричневый, прямо как NO2, но спутать их невозможно из-за запаха, ярко выраженного и негативно воспринимаемого обонянием.
Элемент повсеместно распространен и сегодня, причем наивысшее его содержание фиксируется в соленых озерах и морях (откуда он может попадать и в пресные источники). За счет более высокой плотности бром растворяется в воде очень легко, делая ее оранжевой.
Есть два способа приготовления – рассмотрим каждый. Согласно первому методу, нужно:
При всей кажущейся простоте действия важно соблюдать предельную осторожность и работать только в защитной одежде и в вытяжном шкафу. Все потому, что при соединении двух компонентов выделяются ядовитые испарения.
Более безопасный, а значит и удобный вариант – расщепление порошка NaBr и помощью отбеливателя (с хлором, но без добавок и ароматизаторов) и HCl. Происходит следующим путем:
Чем отличается бромная вода от брома: состав
Растворяясь, рассматриваемый нами элемент запускает реакции оксидации, которые приводят к диспропорциональному выделению бромида и гипобромита – в соответствии с представленной ниже закономерностью:
Br2 + H2O → BrO- + Br- + 2H+
Это продолжается таким же неравным образованием бромата и бромида – следующим образом:
3Br2 + 6OH → BrO3- + 5 Br- + 3H2O
Поведение присутствующих кислот определяет условия хранения. Содержать данный продукт необходимо в затемненной стеклянной посуде и не вынося на свет. Если пренебречь этими правилами и поднести жидкость под прямые солнечные лучи (или в тепло), это спровоцирует выделение кислорода. Что происходит с бромной водой в этом случае? Она не только теряет свои полезные характеристики, но и начинает испускать газ HBr, пары которого ядовиты и очень неприятно пахнут.
Бромная вода: ее свойства и особенности
Бром и приготовление бромной воды
Готовят раствор бромной воды только в вытяжном шкафу из-за ядовитости паров. Для этого берут бром в объеме один миллилитр и заливают в воду (дистиллированную, иначе получится много ненужных примесей) объемом 250 миллилитров, интенсивно мешая стеклянной палочкой. Бромная вода готова. Хранить ее нужно только в темном стекле, герметично закрыв. Будьте осторожны, так как, соприкасаясь с кожей, бром вызывает сильнейшие и болезненные ожоги. Если контакт произошел, срочно промойте пораженное место водой.
Состав бромной воды
Содержатся в этой жидкости не только молекулы брома (Br2), но и бромсодержащие кислоты HBrO и HBr. Именно присутствие первой (бромноватистая кислота) заставляет раствор хранить в темном стекле, так как на свету она разлагается, выделяя кислород.
Свойства химические и физические
Как и все галогеновые растворы, вода бромная является отличным окислителем, но более слабым, чем раствор хлора. Окисляет она металлы и многие органические соединения, в том числе фенолы. А добавление в нее еще брома приводит к уменьшению pH.
Применение
Применяют бромную воду в промышленных лабораториях. Одной из качественных реакций на непредельные углеводороды является именно взаимодействие алкенов и алкинов с раствором бромной воды. В результате этого состав обесцвечивается. Разрывая двойные и тройные связи, бром присоединяется, образуя бромистые соединения.
Происходит обесцвечивание бромной воды и при реакции с непредельными маслами. В них также присутствуют двойные и тройные связи. Взаимодействие с бромной водой йодистого калия приводит к обесцвечиванию первого и постепенному выделению молекул свободного йода (I2). Можно провести с бромной водой качественную реакцию на присутствие CuCl, при добавлении небольшого количества аммиачного раствора произойдет покраснение.
В медицине бромную воду применяют при производстве препаратов. Раньше существовала легенда, что солдатам в пищу добавляют бром, чтобы снизить потенцию. Но оснований для этого утверждения нет никаких, так как вещества, содержащие бром, не оказывают на мужскую силу никакого влияния. Они просто действуют на нервную систему как успокаивающее и мягкое снотворное.
Бромная вода: что это такое и чем опасна для человека, химическая формула брома, методы очистки, взаимодействие с другими веществами
Рассмотрим раствор, активно используемый в промышленности. В фокусе внимания – бромная вода: что это такое, состав, как выглядит, структурная химическая формула и свойства, чем опасен бром для человека – пройдемся по всем этим вопросам, чтобы вы имели полное представление.
Сразу отметим, что особенно важна и востребована оно в лабораториях, где используется для выявления алкенов, которые она идентифицирует, изменяя свой цвет. И развеем один старый миф: что ее якобы давали советским солдатам для снижения потенции. Вряд ли, потому что для этого не было поводов, она не уменьшает либидо и не оказывает отрицательного влияния на мужскую силу. Если ее и подливали в напитки, то лишь в качестве мягкого снотворного, хотя и этому нет никаких доказательств. Ну а теперь сосредоточимся на более специфических моментах.
Определение
Это раствор, состав которого можно записать по схеме:
«бром плюс вода и кислоты» (бромоводородная и бромноватистая)
В обычных условиях это желто-оранжевая по своему цвету жидкость с высокой степенью прозрачности. Является достаточно активным веществом, успешно сочетающимся как с органикой, так и с неорганическими соединениями. Довольно сильный окислитель, быстро воздействующий в щелочной среде на катионы Mn+3, Ni+3, Cr+3, Co+2, Fe+2, а также в отдельном порядке на фенолы.
Формула
Записывается максимально просто – Br2, – не только соответствуя встречающейся в природе молекуле элемента, но и отражая ее количественный и качественный состав.
Но также содержит HBr и HBrO, которые тоже заслуживают внимания, так как определяют особенности хранения. За счет наличия этих свободных кислот значительно снижает pH-уровень той технологической среды, в которую добавлена (и эта ее особенность имеет ключевое значение при фильтрации, естественно, при соблюдении должной дозировки). И является важным компонентом при проведении целого ряда анализов и при изготовлении многих органических препаратов.
Формула бромной воды в химии
Br2 позволяет определить молекулярную массу – из следующих уравнений:
Mr(Br2) = 2 х Ar(Br), то есть Mr(Br2) = 2 х 80 = 160
Одна из наиболее частых реакций:
Br2 + H2O ⇌ HBr + HBrO
Если развернуть это описание и осветить его более подробно, система уравнений приобретет вид:
Br2(K) + nH2O ⇌ Br2 x nH2O(P),
что, в свою очередь, можно преобразовать в:
Br2 x nH2O ⇌ HBr + HBrO + (n – 1) x H2O,
из этого вырастает:
HBrO + H2O ⇌ BrO- + H3O+
К тому, как взаимодействуют оксид брома и вода, нужно добавить, что массовая доля элемента в составе в норме не превышает 3,5%, но при наличии бромидов степень растворимости увеличится благодаря появлению следующих комплексов:
которые подвергаются постепенному разложению под воздействием света:
1,5 м3/ч Для технической воды
1,5 м3/ч Для технической воды
MBFT-75 Мембрана на 75GPD
Последний процесс запускает бромноватистая кислота и, чтобы его предупредить, следует держать вещество в затемненной таре или хотя бы не подвергать его воздействию прямых лучей. При должном хранении с соблюдением всех норм оно сбережет свои полезные в условиях лаборатории свойства в течение долгого срока.
Электронная формула
Оставим на время в стороне вещества, которые взаимодействуют с бромной водой, и посмотрим на строение атома Br. При массовом числе 80 у него 4 орбиты, по которым вокруг ядра вращаются 35 электронов. Также у него есть 45 нейтронов и 35 протонов.
Распределение можно записать так:
История открытия
Сам Br был впервые описан в 1826 году Антуаном Баларом – препаратором из Монпелье. Молодой ученый получил темно-бурую жидкость из сожженных морских водорослей и назвал ее муридом (по аналогии с латинским muria, то есть «рассол»). Хотя немногим раньше, в 1825м, ассистент профессора Гмелина, студент Левиг с помощью хлора выделил элемент из кройцнахского источника. Правда, пока немец собирал достаточное количество материала для проведения исследований, француз его опередил, заявив о своем открытии.
В любом случае заседатели специально собранной комиссии (среди которых был и знаменитый Гей-Люссак) из Парижской академии наук посовещались и признали название Балара неудачным. Дело в том, что в то время семейству солей хлороводородной кислоты было дано имя муриаты. Вот ученые и посчитали, что слишком созвучные термины вызовут путаницу, и вместо этого предложили вариант Brome (с греческого переводится как «зловонный»), потому что открытие неприятно пахло. Его и ввели в употребление по всему миру, естественно, с поправкой на языковые особенности.
Приготовление бромной воды: получение, применение, цвет
Сначала – несколько слов о самом Br. При стабильно комнатной температуре он является жидким (и это единственный неметалл с таким состоянием) и обладает теми же характеристиками, что и галогены. По своей реакционной способности он находится между хлором и йодом. Визуально он тягучий и красно-коричневый, прямо как NO2, но спутать их невозможно из-за запаха, ярко выраженного и негативно воспринимаемого обонянием.
Элемент повсеместно распространен и сегодня, причем наивысшее его содержание фиксируется в соленых озерах и морях (откуда он может попадать и в пресные источники). За счет более высокой плотности бром растворяется в воде очень легко, делая ее оранжевой.
Есть два способа приготовления – рассмотрим каждый. Согласно первому методу, нужно:
При всей кажущейся простоте действия важно соблюдать предельную осторожность и работать только в защитной одежде и в вытяжном шкафу. Все потому, что при соединении двух компонентов выделяются ядовитые испарения.
Более безопасный, а значит и удобный вариант – расщепление порошка NaBr и помощью отбеливателя (с хлором, но без добавок и ароматизаторов) и HCl. Происходит следующим путем:
Чем отличается бромная вода от брома: состав
Растворяясь, рассматриваемый нами элемент запускает реакции оксидации, которые приводят к диспропорциональному выделению бромида и гипобромита – в соответствии с представленной ниже закономерностью:
Br2 + H2O → BrO- + Br- + 2H+
Это продолжается таким же неравным образованием бромата и бромида – следующим образом:
3Br2 + 6OH → BrO3- + 5 Br- + 3H2O
Поведение присутствующих кислот определяет условия хранения. Содержать данный продукт необходимо в затемненной стеклянной посуде и не вынося на свет. Если пренебречь этими правилами и поднести жидкость под прямые солнечные лучи (или в тепло), это спровоцирует выделение кислорода. Что происходит с бромной водой в этом случае? Она не только теряет свои полезные характеристики, но и начинает испускать газ HBr, пары которого ядовиты и очень неприятно пахнут.
Бромная вода: приготовление, состав, свойства и применение
Бром является природным элементом, который можно найти во многих неорганических веществах. Он встречается в природе в солях брома в различных породах земной коры. В результате выщелачивания соли брома накапливаются в морской воде (85 ч/млн), из которой и извлекаются. Бром используют в различных областях промышленности. Например, в аналитической химии применяется бромная вода, а для очистки бассейнов— бромные составы. Органобромины используются в качестве инсектицидов, в огнетушителях и при приготовлении фармацевтических продуктов
Бром и приготовление бромной воды
Бром — единственный не металл, который является жидким при комнатной температуре и имеет характеристики, аналогичные характеристикам галогенов. Он выглядит как тяжелая текучая красно-коричневая жидкость (похожая на жидкость из диоксида азота), которая легко испаряется и характеризуется интенсивным и неприятным запахом. Его химическая реакционная способность аналогична химической активности хлора или йода, и промежуточная по активности этим двум элементам.
Бром плотнее воды, но он легко растворяется в ней и окрашивает ее в специфический оранжевый цвет. Приготовить бромную воду можно двумя способами. Для первого способа берется литр дистиллированной воды и 4 мл жидкого брома. Компоненты помещаются в хорошо закрываемую колбу и интенсивно перемешиваются. К недостаткам такого способа относится то, что пары жидкого брома ядовиты и поэтому при смешивании требуется использование вытяжки и защитной одежды.
Более удобный метод получения— использование отбеливателя и соляной кислоты для расщепления порошка бромида натрия, что исключает риск обращения с чистым жидким бромом. Бром натрия смешивается в колбе или стакане с соляной кислотой. Полученную смесь выливают в стеклянную бутылку и добавляют отбеливатель. Затем бутылку закрывают крышкой и осторожно встряхивают, чтобы смешать ингредиенты. Полученный состав смешивают с дистиллированной водой. Для приготовления этим методом используют отбеливатель, содержащий хлор, без ароматизаторов и бактерицидных добавок.
Хранится вода в темном месте, в бутылке из темного стекла. Она вызывает коррозию и выделяет опасные пары. Работать с ней надо в защитных очках и химически стойких перчатках, в хорошо проветриваемом помещении.
Состав бромной воды
Бром растворяется в воде при температуре 20 С. Бром является окислителем и реагирует с водой в соответствии с реакцией диспропорции с образованием бромида и гипобромита:
Br2 + H2O → BrO- + Br- + 2 H +
В основной среде это диспропорционально дает бромат и бромид:
3 Br2 + 6 OH- → BrO3- + 5 Br- + 3 H2O.
При попадании света на бромную воду выделяется кислород из присутствующей в ней бромноватистой кислоты (HBrO). При этом образуется бромистый водород (HBr) — ядовитый газ с сильным неприятным запахом.
Свойства химические и физические
Если органическое соединение вводят в виде газа (например, этана) или встряхивают в виде жидкости с бромной водой, раствор становится бесцветным, вещество образца содержит, по меньшей мере, одну двойную связь СС. Это доказательство основано на электрофильном сложении. Эту реакцию можно заметить при пропускании этилена через бромную воду. При реакции муравьиной кислоты с бромной водой образуется бром, водород и углекислый газ.
Реакция бромной воды с алканом протекает только с катализатором и/или в условиях яркого света. Он также обесцвечивает ее, и создает HBr, поскольку механизм реакции теперь является радикальной заменой.
Применение
Бромная вода используется в аналитике для быстрого и простого обнаружения множественных связей CC. Если ее соединить с испытуемым веществом (при условии, что оно жидкое), она быстро обесцвечивается, если присутствует хотя бы одна двойная связь CC. Одним из таких тестов является взаимодействие с этиленом.
Почему же этен обесцвечивает растворы бромной воды и перманганата калия. Происходит это потому, что он имеет двойную связь и хорошо вступает в химическую реакцию.
Ионы брома, которые положительно и отрицательно заряжены поляризацией и гетеролитическим расщеплением, образуют связи с р-электронами, ранее участвующими в двойной связи. В этен добавляется бром. Получается 1,2-дибромэтан.
При пропускании этилена через бромную воду или перманганат калия происходит качественная реакция. В результате чего растворы становятся бесцветными. Точно также и толуол реагирует с бромной водой. Преимущество этих анализов заключается в том, что реакция протекает быстро и при отсутствии катализатора.
Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 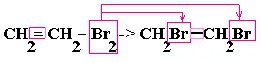 2. Изменение окраски раствора 2. Изменение окраски раствора3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: 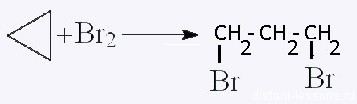 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди:  3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 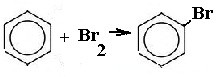
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 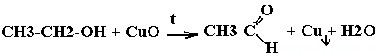 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 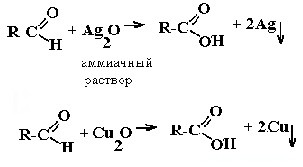 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.