что нужно для синтеза гемоглобина
Что нужно для синтеза гемоглобина
Гемоглобин (Hb) – это сложный железосодержащий белок, который находится в эритроцитах крови и частично в плазме. Hb обеспечивает насыщение тканей организма кислородом и своевременное удаление углекислого газа из активно метаболизирующих клеток [1]. Помимо этого, исходя из своих уникальных химических свойств, гемоглобин является основным компонентом буферной системы крови, который поддерживает кислотно-щелочной баланс в организме, предотвращая алкалоз или ацидоз. Производная Hb – метгемоглобин (MetHb) – обладает пероксидазными свойствами, т.е. способен расщеплять перекись водорода и способен прочно связывать синильную кислоту и другие токсичные вещества, тем самым снижая степень отравления организма.
Цель исследования – проанализировать современные литературные данные, касающиеся функциональных особенностей Hb, и рассмотреть ситуации, которые связаны с его альтернативными и дополнительными функциями.
Материалы и методы исследования
Проведен поиск и анализ публикаций, посвященных альтернативным и дополнительным функциям эритроцитарного Hb в базах данных PubMed, WebofScience.
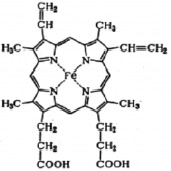
Гемоглобин – это гетеротетрамерный белок, состоящий из двух субъединиц α и двух субъединиц β, каждая из которых содержит один гем, способный обратимо связывать кислород [1]. Гем является небелковым компонентом Hb, который состоит из четырех пиррольных колец и двухвалентного железа. Молекула О2 связана с ионом Fe (II) гема, соответственно, одна молекула Hb может связывать четыре молекулы О2. Структура гема представлена на рис. 1 [2].
Рис. 1. Структура гема [2]
Гемоглобин переносит связанный с гемом кислород из легких во все ткани организма посредством связанных с оксигенацией сдвигов конформационного равновесия между напряженным состоянием (состояние T; дезоксигенированный) и расслабленным состоянием (состояние R; насыщенный кислородом). R-форма Hb обладает более высоким сродством к кислороду, чем Т-форма. Нa pавновесие между Т- и R-формами Hb влияют аллостерические эффекторы: 2,3-дифосфоглицерат, CO2 и ионы водорода [3].
В эритрoцитaх челoвекa oбнаруженo несколько фoрм Hb. Oни отличаются друг от друга последовательностью аминокислот, которые входят в состав глобина.
Выделяют физиологический (нормальный) и патологический Hb.
HbA – это «зрелый» гемоглобин, который имеется у каждого человека. При рождении его содержание составляет 80 %, а затем повышается до 95–98 %.
HBF – фетальный гемоглобин. Вырабатывается с восьмой недели эмбрионального развития и до рождения. В отличие от HbA, HBF обладает большим сродством к кислороду.
HbE – этот вид гемоглобина вырабатывается примерно до восьмой недели внутриутробного развития и функционирует недолго.
В настоящее время известно более 250 видов патологического Hb. Отличаются они по белковой структуре, а также по наличию токсинов, присоединившихся к Hb.
MetHb – метгемоглобин – содержит трехвалентный ион железа. Он формируется при действии на Hb оксидов азота и хлоратов. MetHb не способен связывать кислород, из-за этого возникает гипоксия тканей.
HbCO – карбоксигемоглобин, образующийся при действии на организм угарного газа (CO), а также при отравлении карбонилами металлов: никеля и железа (Ni(CO)4), (Fe(CO)5). HbCO постоянно находится в крови в небольшом количестве, но его концентрация может колебаться от условий и образа жизни.
HbS – гемоглобин серповидно-клеточной анемии. Серповидно-клеточная анемия – это наследственное заболевание системы крови, для которого характерно нарушение образования нормальных цепей гемоглобина. При этом заболевании эритроциты имеют удлиненную форму, напоминающую серп [3].
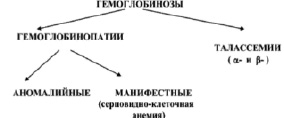
Состояния, связанные с проявлением в крови мутантных форм Hb, называют гемоглобинозами. Классификация гемоглобинозов представлена на рис. 2 [4].
Рис. 2. Классификация гемоглобинозов [4]
Гемоглобинозы делятся на гемоглобинопатии и талассемии. Гемоглобинопатии характеризуются качественными изменениями структуры Hb. Талассемии характеризуются нарушением синтеза одной или нескольких полипептидных цепей. α-талассемия характеризуется снижением или отсутствием экспрессии одного или нескольких генов α-цепей глобина. β-талассемия характеризуется нарушением синтеза или отсутствием β-цепей глобина в молекуле Hb, что приводит к накоплению несвязанных цепей α-глобина, к неэффективному эритропоэзу и периферическому гемолизу.
Реакции гемоглобина с оксидом азота и его производными. Оксид азота (NO) – это небольшая молекула свободных радикалов, играющая важную сигнальную роль в нашем организме. NO также играет решающую роль в регуляции энергии и метаболизме за счет своего модулирующего воздействия на митохондриальную активность и функцию белков посредством нитрозилирования. Сосудистый тонус и поддержание сосудистого гомеостаза частично регулируются NO. Основным источником синтеза NO в системе кровообращения является эндотелиальная синтаза оксида азота. Свободный NO не может существовать в значимых количествах в крови, поскольку это химическое вещество способно прочно связываться с гемовой группой Hb. Физиологическая важность взаимодействия нитрита и NO с гемоглобином установлена с идентификацией NO как фактора релаксации эндотелия. Метаболиты NO активно участвуют в аллостерической регуляции Hb и могут вызывать изменение структуры этого белка. Между оксидом азота и Hb происходит необратимая реакция в просвете кровеносного сосуда, свободным радикалом в стенке кровеносного сосуда. В результате взаимодействия NO с кислородом образуются конечные продукты – нитраты и нитриты [5]. Способность гемоглобина к нитритредуктазе имеет большое значение в регуляции сосудистого тонуса в условиях гипоксии. Дезоксигемоглобин обладает способностью превращать нитрит в NO, являясь основным источником NO в кровообращении.
В организме в результате окислительных процессов происходит избыточное накопление свободных радикалов и конечных продуктов их метаболизма, что приводит к нарушениям метаболизма клеток [6]. Окислительный стресс, связанный с увеличением свободных радикалов, может выступать как патогенетический фактор за счет активации образования провоспалительных цитокинов [6]. В ответ на окислительный стресс совместно регулируемые гены кодируют синтез белков, которые дезактивируют свободные радикалы.
Гемоглобиновая буферная система. Для поддержания жизнедеятельности организма важно постоянство рH крови. В этом участвуют буферные системы. Самой мощной буферной системой является гемоглобиновая. Кислую часть буфера составляет оксигенированный гемоглобин H-HbO2. Он почти в 80 раз легче отдает ионы водорода, чем восстановленный Н-Нb.
Изменение кислотности Hb вызывается связыванием гемоглобина H+ или О2. Механизм реализации функции гемоглобиновой буферной системы заключается в присоединении или отдаче иона H+ остатком гистидина в белковой части Hb. Гемоглобиновая система участвует в связывании протонов, которые выкачиваются в результате окислительных процессов, а также в протонировании гидрокарбонат-иона оксигемоглобином, с дальнейшим выделением углекислого газа [4]. Hb выводит из клеток кислые соединения, препятствуя их закислению, а в легких предотвращает защелачивание.
Связывание гемоглобина с мембраной. Обратимое связывание белков с компонентами мембраны и цитоскелета является одним из механизмов управления клеточным метаболизмом. Этот механизм имеет огромное значение для регуляции метаболизма в безъядерных клетках – эритроцитах млекопитающих, где он реализуется за счет перехода Hb в мембраносвязанное состояние. Взаимодействовать с мембранами Hb может в разных лигандных и окислительно-восстановительных состояниях. Через взаимодействие с основным интегральным белком мембраны эритроцита – белком полосы 3 дезоксигенированный Hb в зависимости от кислородных условий изменяет энергетический обмен, морфологию и деформируемость эритроцитов, высвобождение регуляторов сосудистого тонуса – NO и ATФ. Сигнальную функцию выполняют также и продукты окислительной денатурации Hb – необратимые гемихромы. Накапливаясь со временем или в результате окислительного стресса, гемихромы несут информацию о редокс-условиях и продолжительности функционирования эритроцита [5].
Методологии количественного определения гемоглобина. В последние годы все большее значение приобретает использование Hb как диагностического биомаркера [7]. Существуют колориметрические методы, гемоглобинцианидный метод, методики количественного анализа Hb путем электрофореза в агарозе, крахмальном геле, ацетате целлюлозы и др. Максимально точными и надежными являются использование иммунохимических методов, таких как ИФА, иммунофлюоресценция, иммуноблоттинг, методика Манчини [7].
Одним из важных показателей является концентрация Hb. Снижение концентрации наблюдается при анемиях. Повышение уровня Hb встречается при гемоглобинуриях [2].
Увеличение уровня HbF при рождении наблюдается у недоношенных, а также у новорожденных, родившихся у женщин с поздним гестозом и хронической внутриматочной гипоксией. Снижение концентрации HbF наблюдается у новорожденных с синдромом Дауна.
Рост продукции HbF показан при хронических гипоксиях различного генеза [8].
Метгемоглобин и карбоксигемоглобин при COVID-19. После вспышки новой коронавирусной инфекции, уделено место метгемоглобину (MetHb) и карбоксигемоглобину (COHb), поскольку у тяжелобольных пациентов часто наблюдаются повышенные концентрации данных соединений гемоглобина в крови. Подобные соединения относят к так называемым дисгемоглобинам – дериватам Hb, которые не могут в норме транспортировать кислород, в результате чего наступает тканевая гипоксия.
У пациентов после COVID-19 наблюдается пониженная концентрация Hb. В 2020 г. после проведенных исследований ученые выдвинули предположение, что инфекция взаимодействует в организме с железосодержащим белком и впоследствии разрушает его. Этот вывод был сделан на основе того, что в организмах пациентов с анемией был выявлен в большом количестве гем [8].
Синдром матового стекла, обнаруживаемый в легких на КТ – это скопление [8], атакованного вирусом и утратившего способность к переноске кислорода [8]. Ученые обнаружили, что у пациентов наблюдается низкий уровень ферритина – белка, который является «хранилищем» железа в организме. На фоне недостаточного количества ферритина развивается анемия.
Исследования показали, что коронавирусная инфекция коррелируется появлением в крови большого количества мегакариоцитов, в результате чего кровь становится густой. Эритроцитам труднее перемещаться по густой крови, в результате чего возникает гипоксия.
Ученые полагают, что причиной гибели пациентов может быть атака вируса на красный костный мозг, внутренний эндотелий и эритроциты [8].
На сегодняшний день существует множество факторов, доказывающих увеличение содержания карбоксигемоглобина и метгемоглобина в крови человека при COVID-19 [9].
Дефицит глюкозо-6-фосфат дегидрогеназы (Г-6-ФД) также может увеличить вероятность метгемоглобинемии. Недостаточность Г-6-ФД имеет серьезные патологические последствия в эритроцитах. Для лиц с дефицитом Г-6-ФД инфекция SARS-CoV-2 представляет собой дополнительный фактор риска [8]. Г-6-ФД катализирует реакцию образования восстановленного NADPH, который, в свою очередь, участвует в поддержании антиоксидантной системы защиты эритроцитов от свободных радикалов.
MetHb может образовываться как побочный продукт физиологической реакции в виде адаптивной повышенной передачи сигналов оксида азота (NO) вследствие острой анемии. Анемия может быть связана с инфекцией или системной воспалительной реакцией, называемой «анемией воспаления», как часть физиологической реакции на заболевание [9]. Согласно исследованию Bellmann-Weiler et al. [9] из 259 госпитализированных пациентов с COVID-19 24,7 % были анемичны при поступлении, причем большинство страдало воспалительной анемией (68,8 %). Во время госпитализации процент пациентов с анемией увеличился (около 68,8 % на 7-й день). Значительно более высокая смертность во время госпитализации была также обнаружена у пациентов с анемией при поступлении. Анемия связана с повышенной концентрацией NO, приводящей к вазодилатации. Она предотвращала тканевую гипоксию, но в то же время вызывала NO-основанное окисление Hb в MetHb. MetHb активирует путь NF-kB в эндотелиальных клетках, связанный с продукцией хемокинов (IL-8) и цитокинов (IL-6). Активация путей NF-kB и MAPK с последующим высвобождением хемокинов IL-8 и хемокинового моноцитарного хемоаттрактантного белка-1 (MCP-1) также наблюдалась в эндотелиальных клетках, подвергнутых воздействию MetHb [8]. Это подчеркивает, что повышение уровня MetHb в крови оказывает влияние на выработку цитокинов/хемокинов – факт, который может иметь особое значение для COVID-19, поскольку при тяжелом течении заболевания наблюдается «цитокиновый шторм». И следует иметь в виду, что гипоксия также вызывает выработку IL-8 и IL-6 [9].
Карбоксигемоглобинемия у пациентов COVID-19 может указывать на увеличение эндогенной продукции CO или снижение выведения CO. Эндогенная продукция СО обусловлена активацией гемоксигеназной ферментной системы, катализирующей распад гема и высвобождение СО в ходе реакции. Затем CO может реагировать с Hb, что приводит к образованию COHb. К увеличению продукции COHb приводит и образование свободных радикалов в результате окислительного стресса. Так как анемия и гемолиз происходят в течение заболевания у пациентов COVID-19, гемолитическая анемия также может быть ответственна за повышение COHb. Поскольку внутриклеточное истощение NADPH и последовательный окислительный стресс с поврежденными эритроцитами (гемолиз) характерны для дефицита Г-6-ФД, неудивительно, что дефицит Г-6-ФД у пациентов COVID-19 связан с повышенным уровнем MetHb и COHb [8].
При нарушении дыхания происходит снижение элиминации СО. Пациенты с COVID-19 характеризуются нарушением дыхания. Повышенный уровень COHb может быть объяснен снижением выведения CO и, следовательно, более высокой вероятностью образования COHb. Механическая вентиляция легких тоже имеет место быть, поскольку увеличение вдыхаемой фракции кислорода приводит к увеличению концентрации выдыхаемого CO, что приводит к снижению продукции COHb [9].
Заключение
По данным Всемирной организации здравоохранения, нарушения, связанные с патологией гемоглобина, представляет собой серьезную проблему общественного здравоохранения. Необходимо разрабатывать программы по скрининговым лабораторным дифференциально-диагностическим тестам, специальные биохимические, иммунологические и морфологические методы определения гемоглобина крови.
Что такое гемоглобин и почему его показатель важен для здоровья
Существует три вида клеток крови: тромбоциты (кровяные пластинки), лейкоциты (белые кровяные клетки) и эритроциты (красные кровяные клетки).
Железосодержащий белок красных кровяных клеток называется гемоглобином. Его функция – удерживать кислород, чтобы доставлять его в ткани организма.
Норма гемоглобина составляет:
Количество гемоглобина в крови зависит от следующих факторов:
Недостаточное содержание гемоглобина в крови провоцирует частую усталость, недомогание, сонливость, наблюдается упадок сил, плохое настроение. Также больные жалуются на постоянную головную боль и головокружение. Помимо этого, отмечается бледность кожных покровов, плохой аппетит, шум в ушах, похолодание рук и ног, болевые ощущения в мышцах, также частое развитие простудных и вирусных инфекций.
Пониженное содержание гемоглобина в крови называют анемией. Ее разделяют на три степени: легкую (показатель гемоглобина 90–110 г/л), среднюю (70–90 г/л) и тяжелую (менее 70 г/л). Критически низкое значение гемоглобина, требующее немедленной госпитализации, — 40 г/л. Низкий показатель может свидетельствовать о проблемах с усвояемостью пищи, наличии аутоиммунных заболеваний, внутренних кровотечениях, опухолях, инфекциях.
Повышенные показатели гемоглобина могут свидетельствовать о сгущении крови из-за обезвоживания, о легочной недостаточности, врожденных пороках сердца или длительной адаптации организма к определенным условиям (встречается у летчиков и альпинистов). Вредные привычки, в особенности курение, это еще одна причина повышенного уровня гемоглобина.
Как мы видим, отклонение от нормы, будь то увеличение или уменьшение его уровня в крови, — признак множества заболеваний, хотя у некоторых пациентов это индивидуальная особенность. Поэтому только врач может определить, требует ли коррекции каждый конкретный случай.
Анализ на концентрацию гемоглобина входит в общий анализ крови.
Клинико-диагностическая лаборатория Национального медицинского исследовательского центра терапии и профилактической медицины Минздрава России предоставляет широкий перечень лабораторных услуг. Контактный телефон +7 (495) 790-71-72.
Что нужно для синтеза гемоглобина
Крупнейшее событие в ходе эволюции нашей планеты – открытие процесса фотосинтеза – повлекло за собой неизбежное изменение состава земной атмосферы в плане увеличения доли молекулярного кислорода. Появление такого эффективного биологического окислителя, как О2, дало гетеротрофным организмам возможность более эффективного извлечения энергии органических связей путем дыхания. Последовавшее затем возникновение крупных многоклеточных привело к проблеме транспорта кислорода в ткани биологических систем. Но, поскольку кислород очень плохо растворим в воде (всего 4,9 мл газа в 100 мл Н2О), очевидным решением этой проблемы стало появление гуморальных посредников, доставляющих дыхательные газы по адресу. Таким образом, в ходе эволюционного прогресса у большинства многоклеточных сформировалась система белковых дыхательных пигментов, главным из которых является гемоглобин (Hb) [1–3].
Гемоглобин (Hb) (от греч. haemo – кровь и лат. globus – шар), красный железосодержащий хромопротеин, обнаруженный у всех эукариотических организмов, от одноклеточных (дрожжи и др.) до беспозвоночных и высших позвоночных животных. Он способен обратимо связывать молекулярный кислород в количестве 20 мг О2, на 100 мл крови [4]. В биологических системах Hb выполняет две важнейшие функции: а) транспорт дыхательных газов; б) поддержание кислотно-основного равновесия (стоит заметить, что гемоглобиновый буфер является самым мощным в организме (примерно 3/4 от общей буферной емкости крови) [5].
Гемоглобин называют модельным белком, свойства, функции и структура которого наиболее полно изучены по сравнению с другими протеинами человека. Отмечая ключевую роль этого хромопротеина в системе дыхания, непревзойденный гемоглобинолог Макс Перутц назвал Hb «молекулярным легким» [6].
Гемоглобин – внутриклеточный компонент. На его долю приходится 90 % всего белка красных кровяных телец. Примечательно, что в собственном метаболизме эритроцита кислород не используется [7]. Молекулярная масса большинства изотипов этого пигмента колеблется в пределах 64,5–68 кД. Размер – 6,8 нм. pI – 6,8. Первичная структура характеризуется высоким содержанием гистидина [4, 8].
Все типы гемоглобина являются тетрамерами, построенными из пары α-субъединиц, и специфической для каждого типа иной пары. Каждый из четырех протомеров построен из двух неравных частей: небелковая структура – гем (4 % массы молекулы Hb, обеспечивает окраску и ковалентную связь с кислородом) и белковая глобула – глобин (96 % массы, чаще представлен либо 141 (α-цепь), либо 146 (β-, γ-, δ-цепи) аминокислотными остатками) [4, 8].
Комплекс, составленный из одной глобиновой субъединицы и одного гема, называется Сведберговой единицей. Таким образом, молекула Hb построена из четырех Сведберговых единиц, слабо связанных между собой нековалентными связями (гидрофобными, электростатическими, водородными) [8].
Синтез гема происходит в митохондриях. Глобин, как и любой белок, синтезируется на рибосомах. Их объединение в мультимер осуществляется в фазу созревания полихроматофильного нормобласта [9].
Лигандом молекулы гемоглобина, присоединяющим кислород, является ион Fe2+. Это взаимодействие обратимо и зависит от парциального давления O2. В артериальной крови практически весь Hb (95–98 %) связан с кислородом. В венозной крови содержание оксигемоглобина составляет 67–75 %, остальная часть приходится на долю свободного (редуцированного) Hb [1, 4, 5].
Норма общего Hb в крови у мужчин составляет 135–170 г/л, у женщин – 120–150 г/л [10].
В крови у новорожденного содержится 140–190 г/л этого белка, но к концу первого месяца его уровень снижается до нормального для взрослого. Динамика средней концентрации Hb крови в период от рождения до 12 лет представлена в таблице [9].
Средние уровни Hb в крови в раннем постнатальном периоде
В плане градации Hb выделяют:
? нормальные формы: восстановленный (редуцированный) Hb, оксигенированный Hb, карбгемоглобин и метгемоглобин.
? производные: карбоксигемоглобин, сульфгемоглобин, метгемоглобин, циангемоглобин и др.
? типы (изотипы) – принципиально различные подвиды Hb, кодирующиеся отдельными генами, различающиеся строением протомеров глобина. Очевидно, гемоглобины разных типов отличаются первичной, вторичной, третичной и четвертичной структурами [10].
К основным типам гемоглобина человека относятся следующие:
? HbА1 – является преобладающим в крови взрослого (98 % от общего Hb). Тетрамер, его молекула построена из двух α- и двух β-субъединиц (141 и 146 аминокислотных остатков соответственно). Его синтез начинается уже на 6–8 неделях гестации и продолжается до конца жизни [8, 11].
? HbА2 (минорный, 2 α- и 2δ-протомера). Его концентрация в крови взрослого 1,5–3,5 % от общего Hb. Уровень этого изотипа возрастает при гипохромных и мегалобластных анемиях, серповидноклеточной анемии, β-талассемии. Снижение его концентрации в крови отмечается при δ-талассемии, гемоглобинопатии Н, эритролейкозе [8, 9, 11].
? Примитивный (эмбриональный) Hb (HbР). Обладает более высокой (чем HbA1) тропностью к О2. Является самым ранним гемоглобином эмбриона. Синтезируется в раннем эмбриогенезе (с 4 по 12 нед) в желточном мешке [8, 11].
? Плодовый (фетальный) гемоглобин (HbF, тетрамер, 2 α- и 2 γ-цепи). Его продукция начинается с 12-й недели внутриутробного развития, и к 6 месяцам полностью замещает HbP в крови. К моменту рождения концентрация HbF составляет 55–85 % от общего. В крови взрослого человека его доля составляет 1,5 % от общего Hb [8, 11].
a-, b-, g- и d-гены гемоглобина расположены на коротких плечах 11-й и 16-й хромосом [11, 12].
Известно около 200 патологических типов Hb, причиной возникновения которых являются мутации. Данные протеины регистрируются в крови человека при состояниях, называемых гемоглобинопатиями (M Hyde Parc, Bristol, Sydney и др.) [13–15].
По причине стремительного прогресса биохимических методик индикации, в последние годы роль отдельных типов гемоглобина, как диагностических и прогностических маркеров, приобретает все большее прикладное значение.
Особо следует сказать о методологии количественного определения гемоглобинов. В большинстве стран в качестве общепринятых применяются колориметрические методы, рекомендованные комитетом по стандартизации Европейского и Международного общества по гематологии (1964), среди которых доминирующим является унифицированный гемоглобинцианидный метод. Оптические способы обнаружения гемоглобинов практичны, доступны и просты, но имеют существенный недостаток: они имеют низкую селективность, не позволяющую регистрировать отдельные типы гемоглобина [9, 10].
Существуют также методики лабораторного количественного анализа гемоглобинов путем электрофореза в агарозе, крахмальном геле, ацетате целлюлозы и др. Но они является полуселективными, так как определяют только фракции гемоглобинов со сходной электрофоретической подвижностью, а не индивидуальные типы этого белка [10].
В последние десятилетия в медицинской практике наблюдается тенденция перехода от регистрации фракций веществ (общий белок, общий гемоглобин и др.) к определению отдельных форм вещества. Такой подход повышает качество диагностики и прогностической оценки. Очевидно, медицина XXI века нуждается в принципиально новых технологиях тестирования гемоглобинового профиля по каждому из основных его изотипов [16].
Наиболее адекватно отвечают вышеуказанным требованиям уже давно известные иммунохимические методы определения белков (ИФА, иммунофлюоресценция, иммуноблоттинг, методика Манчини и др.). Они до сих пор остаются максимально специфичными, точными, чувствительными и надежными [10, 16].
Попытки моделирования иммунохимических методов количественного анализа некоторых фракций гемоглобинового профиля предпринимались еще с начала прошлого столетия. В данных работах исследователи исходили из убеждения, что разработка и внедрение в клиническую диагностику иммунохимических диагностических тест-систем на значимые типы гемоглобина целесообразно и актуально, так как значительно оптимизирует и облегчит лабораторную оценку статуса красной крови. В дальнейшем научный интерес в этом направлении был снижен вследствие внедрения в международную клиническую практику оптических циангемоглобиновых методов индикации. Но в последние десятилетия, в связи с усовершенствованием иммунохимических методик и ростом научного интереса к отдельным компонентам гемоглобинового спектра с одной стороны, ростом потребности в специфических диагностических тестах на конкретные типы этого протеина, с другой стороны, отмечается активизация работы немногочисленных научных групп по разработке и внедрению в медицинскую практику новых, современных иммунохимических тест-систем на различные генотипы гемоглобина человека [17–19].
Определение количества Hb в крови имеет большое клиническое значение. Снижение его концентрации отмечается при анемиях различной этиологии. Повышение Hb крови может быть как физиологическим, так и патологическим. Умеренные повышения встречаются при гемолитических анемиях, анемии Кули, гемоглобинозе С и др. Значительные увеличения встречаются при всех гемоглобинуриях [4, 8, 20].
Существует множество нозологических форм, при которых имеет важное значение не только изменение количества общего гемоглобина крови, но и отдельных его типов, изменение соотношения которых в клинической практике используют для диагностики различных патологических состояний [8, 21–23].
Например, при снижении скорости синтеза α-цепей возникает α-талассемия. При возникновении мутаций в β-гене нарушается синтез β-полипептидной цепи, возникает β-талассемия, что приводит к образованию повышенных количеств HbF. Талассемии сопровождаются анемиями, которые могут принимать очень тяжелые формы. Увеличение количества HbF наблюдается также при гомозиготной форме β-талассемии, наследственном персистировании фетального гемоглобина, σ-, β-талассемии, серповидно-клеточной анемии [1, 24].
Увеличение пропорции HbF при рождении наблюдается у недоношенных, у новорожденных, подвергавшихся хронической внутриматочной гипоксии, а также у новорожденных, родившихся у женщих с поздними гестозами (в частности – с нефропатией), гипертонической болезнью, эндокринными нарушениями, интоксикациями, сердечно-сосудистой патологией, гематологическими заболеваниями. Уменьшенные уровни HbF обнаружены у новорожденных с синдромом Дауна [25–27]. Повышение уровня плодового гемоглобина отмечается при преждевременной отслойке плаценты, угрозе прерывания беременности [18, 21]. Значительное снижение уровня этого белка регистрируется у больных с различными типами эритробластозов [2, 16]. Показано снижение концентрации HbF в крови пациентов с лимфогранулематозом, сфероцитарной гемолитической анемией, тромбоцитопенической пурпурой [20, 28].
Литературные данные последних лет, основанные именно на иммунохимических методах определения плодового и примитивного гемоглобинов, свидетельствуют, что значение селективной индикации этих протеинов как диагностических маркеров представляет значительно больший прикладной интерес, чем считалось ранее. Показан рост продукции HbF при хронических гипоксиях различного генеза [26, 29]. Сходный компенсаторно-адаптивный рост концентрации этого белка отмечается у людей, проживающих в условиях высокогорья [25]. Значительное повышение продукции плодового гемоглобина отмечено при тяжелых формах героиновой наркомании [30].
Следует отметить, что до применения иммунохимических методов индикации сведения о прикладном значении примитивного гемоглобина как клинико-диагностического маркера были крайне скудны. На наш взгляд, это объяснялось тем, что (как считалось прежде) продукция HbP полностью ингибирована как у детей, так и у взрослых, что не вызывало интереса к данному белку как диагностическому маркеру [4, 9]. Однако, как показали исследования последних лет, основанные на внедрении иммунохимических методик, статистически значимое повышение концентраций примитивного и плодового гемоглобинов в крови регистрируется при некоторых онкологических заболеваниях красной крови (эритремия, сублейкемический миелоз, острый и хронический лимфолейкоз), что свидетельствует о высоком диагностическом значении этих протеинов как канцероэмбриональных антигенов [17, 31]. Достоверный рост уровня HbF и появление в крови HbP наблюдается при тяжелых гипоксических состояниях новорожденных, сопровождающихся задержкой внутриутробного развития или гемолитической болезнью [29, 32].