что будет если белок нагреть
Что будет если белок нагреть

Денатурацию пищевого белка мы видим во время готовки яичницы или жарки мяса. И это не уменьшает их пищевую ценность, а наоборот позволяет легче и эффективнее усваиваться. На примере яиц, если мы не будем их варить или жарить, а съедим сырыми, то они подвергнутся тому же самому разрушению молекулярных связей уже в нашем желудке за счет пищеварительных ферментов.
А вот с витаминами и минералами все немного сложнее, так как они при температурном воздействии легко разрушаются.
Но протеин мы пьем не ради витаминов, а ради содержащихся в нем аминокислот, с которыми ничего плохого не происходит и качество их усвоения и ценность не теряется.
Идея, что с протеином что-то может быть не так под влиянием температуры, возникла в попытке сделать с помощью протеина и кипятка протеиновый чай. Получалось что-то невнятное.
Происходило это из-за того, что сывороточный белок (самый популярный вид исходного сырья для высокобелковых смесей) под влиянием температуры сворачивается. Этот процесс называется коагуляцией.
Воздействие высокой температуры приводит к образованию нерастворимого коллоидного фосфата кальция, который выпадает в осадок. И получается пенка на молоке вместо протеинового чая.
Но вся эта технология прекрасно используется в сыроварении и нисколько не мешает нам наслаждаться этим вкусным продуктом. Поэтому протеиновый горячий чай пить можно, но не нужно.
А выпекать блины и кексы с протеином нужно!
Лабораторная работа №2 Физико-химические свойства белков
Лабораторная работа №2
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Работа 1. Растворимость альбуминов и глобулинов
Многие белки хорошо растворяются в воде, что обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп ( – OH, – NH2, – COOH и др.). Различные белки растворяются по-разному, белки опорных тканей (кератин, проколлаген, коллаген, эластин и др.) нерастворимы в воде. Растворимость белка в воде зависит от характера белка, реакции среды и присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами (альбумины, глобулины, проламины, глютелины). Щелочные белки (протамины, гистамины) лучше растворяются в щелочной среде. Различия в растворимости отмечаются как среди кисло-, так и среди щелочнореагирующих белков. Альбумины растворяются в дистиллированной воде, а глобулины растворяются в воде только в присутствии электролитов.
Исследуемый материал: яичный белок.
Реактивы: 5% раствор NaCl, дистиллированная вода.
Оборудование: пробирки, капельницы.
Ход работы. В первую пробирку вносят 2 капли неразведенного яичного белка, прибавляют 20 капель воды. Содержимое перемешивают. При этом альбумин растворяется, а глобулин выпадает в виде небольшого осадка.
В другую пробирку вносят 2 капли яичного белка и 20 капель 5% раствора хлорида натрия. В слабом солевом растворе растворяются как альбумины, так и глобулины.
В две другие пробирки помещают небольшое количество кератина (волосы). В одну пробирку вносят 20 капель воды, в другую – 20 капель раствора хлорида натрия. Кератин не растворяется ни в воде, ни в солевом растворе.
Оформление работы. Результаты работы оформляются в виде таблицы, где растворимость обозначают знаком «плюс» (+), а отсутствие растворимости – знаком «минус» (–)
Реакции осаждения белков
Для осаждения белка нужно лишить его факторов, удерживающих белок в растворе, используя различные агенты, снижающие заряд или разрушающие гидратную оболочку белковой частицы. Реакции осаждения могут быть обратимыми и необратимыми.
1. Обратимые реакции осаждения не приводят к глубоким изменениям структуры белка, поэтому получаемые осадки могут быть вновь растворены в первоначальном растворителе. Белки при этом сохраняют свои начальные нативные, включая биологические, свойства.
2. Необратимые реакции вызывают глубокие изменения структуры белка, поэтому получаемые осадки не могут быть растворены в первоначальных растворителях. Наступает денатурация белка. Денатурацией называют такое изменение белка, при котором он утрачивает свои естественные биологические и физико-химические свойства, становится менее гидрофильным и теряет способность растворяться в воде.
Практическое значение реакций осаждения белков состоит в том, что они дают возможность: 1) изучить свойства белков; 2) освободить жидкость от присутствия белка; 3) установить наличие белка в моче при патологических состояниях; 4) разделить отдельные белковые фракции на альбумины и глобулины.
Цель работ: Изучить характер реакций осаждения белков в растворах. Объяснить механизм действия осаждающих агентов на основании знания физико-химических свойств белка.
Работа 1. Осаждение белков при нагревании
Почти все белки денатурируют при нагревании (50–55 °С и выше). Механизм тепловой денатурации связан с перестройкой структуры белковой молекулы, в результате которой белок теряет свои нативные свойства, уменьшается его растворимость (уменьшение гидрофильных свойств ведет к нарушению гидратной оболочки). Присутствие солей и концентрация водородных ионов играют важную роль в выпадении в осадок денатурированного при нагревании белка. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке белка, то есть при такой величине рН, при которой коллоидные частицы белка являются наименее устойчивыми. Поэтому для полного осаждения белка при нагревании следует создавать реакцию среды, соответствующую его изоэлектрической точке. Белки, обладающие кислыми свойствами, осаждают в слабокислой среде, белки, обладающие щелочными свойствами, – в слабощелочной. В сильнокислых и сильнощелочных растворах денатурированный при нагревании белок не выпадает в осадок, так как частицы белка перезаряжаются (или происходит усиление имеющегося заряда) и несут в первом случае положительный, во втором – отрицательный заряд. Это повышает их устойчивость в растворе в результате электростатических сил отталкивания. Поэтому в сильнокислых и сильнощелочных растворах белки обычно не выпадают в осадок при нагревании. Однако в сильно-кислых растворах белки могут коагулировать при добавлении достаточного количества какой-либо нейтральной соли. Степень влияния ионов нейтральных солей на осаждаемость белков зависит от их способности адсорбироваться на частицах белка. Адсорбированные ионы солей (если они противоположны по знаку заряду коллоидной частицы) нейтрализуют заряд частицы. Наступает момент, когда силы притяжения между молекулами превышают силы отталкивания – и белок выпадает в осадок.
Исследуемый материал: раствор яичного белка.
Реактивы: 1% раствор CH3COOH, 10% раствор NaOH, насыщенный раствор NaCl.
Оборудование: пробирки, капельницы, спиртовка.
Ход работы. В 5 пробирок наливают по 5 капель раствора яичного белка (без NaCl). В первой пробирке нейтральный раствор нагревают до кипения. Жидкость мутнеет, поскольку разрушаются водные оболочки вокруг молекул белка и происходит укрупнение его частиц. Мицеллы белка несут заряд и удерживаются во взвешенном состоянии. Во 2-й пробирке раствор белка нагревают до кипения и прибавляют 1 каплю 1-процентного раствора уксусной кислоты (для слабого подкисления). Через некоторое время выпадает хлопьевидный осадок белка. Частицы белка теряют заряд и приближаются к изоэлектрическому состоянию. В 3-ю пробирку добавляют 5 капель 1% раствора уксусной кислоты (для получения сильнокислой реакции среды). При кипячении жидкости осадка не образуется, поскольку белковые мицеллы перезаряжаются и несут положительный заряд, что повышает их устойчивость. В 4-ю пробирку добавляют 2 капли 10% раствора NaOH, создавая щелочную среду. При кипячении жидкости осадка не образуется, поскольку в щелочной среде отрицательный заряд на частицах белка увеличивается. В 5-ю пробирку наливают 5 капель 1% раствора уксусной кислоты и 2 капли насыщенного раствора NaCl и нагревают.
Выпадает белый хлопьевидный осадок белка, так как частицы белка теряют заряд вследствие взаимодействия белка с разноименно заряженными ионами хлористого натрия.
Оформление работы. Записать в таблицу результаты осаждения белков при кипячении в различных средах и в каждом случае указать причину появления или отсутствия осадка белка.
Как жар убивает клетки
При превышении определённой температуры клетка приходит в негодность и умирает. Одно из простейших объяснений такой непереносимости жары состоит в том, что необходимые для жизни белки – те, что извлекают энергию из еды или солнечного света, обороняются от вторжений, уничтожают отходы и т.п. – часто обладают удивительно точной формой. Начинаясь как длинные нити, они затем скручиваются в виде спиралей, «заколок для волос» и других форм, диктуемых последовательностью их составных частей. И эти формы играют огромную роль в их деятельности. Но когда температура начинает расти, связи, удерживающие белковые структуры, нарушаются: сначала самые слабые, а затем и сильные. Логично, что распространяющаяся потеря белковой структуры должна быть летальной, но до последнего времени детали того, как именно это убивает перегретые клетки, были неясны.
Теперь же биофизики из Швейцарской высшей технической школы Цюриха изучили поведение каждого белка в клетках четырёх различных организмов при повышении температуры. Это исследование и богатый набор собранных данных, опубликованный в журнале Science, показали, что при температуре, достаточной для смерти клетки – человеческой, или же клетки кишечной палочки Escherichia coli – разрушаются лишь несколько ключевых белков. Более того, обилие белков в клетках оказалось неожиданным образом связанным с их стабильностью. Исследования позволили учёным бегло ознакомиться с фундаментальными правилами, по которым выстроена работа белков и их упорядочивание, и последствия которых, как стало понятно, простираются гораздо дальше простой смерти от жары.
Паола Пикотти, биофизик, руководивший работой, объяснила, что эксперименты отталкивались от старых и нерешённых вопросов: почему некоторые клетки выживают при высоких температурах, а другие – умирают? Бактерия Thermus thermophilus счастливо живёт в горячих источниках и в домашних нагревателях [при оптимальной температуре в 65 °C – прим. перев.], тогда как клетки E. coli чахнут при температурах выше 40 °C. Убедительные доказательства говорят о том, что дело тут в разной стабильности белков этих организмов. Но следить за белком, находящимся в живой клетке, что было бы идеальным методом изучения, очень неудобно. Изолирование белка в пробирке не даёт всех ответов, поскольку внутри организма белки сбиваются вместе и влияют на химию друг друга, или же поддерживают друг друга в необходимой форме. Чтобы понять, что именно и почему разваливается, необходимо наблюдать за белками в то время, когда они всё ещё влияют друг на друга.
Как тепло уничтожает белки

1) Первичная структура белков – это длинные цепочки аминокислот, объединённые в заданные генами последовательности.
2) Вторичная структура – это аминокислота, которая также свёртывается в конфигурации, удерживаемые слабыми межмолекулярными связями.
3) Третичная структура – слабые связи, стабилизирующие расположение прямых и скрученных участков трёхмерной структуры белка. Их расположение позволяет белку соединяться с нужными молекулами.
Чтобы решить поставленную задачу, команда разработала автоматизированную процедуру наблюдения. Они разрезали клетки и нагревали их содержимое поэтапно, выпуская на каждом этапе ферменты, разделявшие белки. Эти ферменты особенно хорошо разрезают развернувшиеся белки, поэтому исследователи на основе остатков разрезанных белков могли судить о том, какие белки развалились при заданной температуре. Таким образом им удалось построить денатурационные кривые для каждого из тысяч изученных белков. Дуги кривых идут от нетронутой структуры белка при комфортабельной для него температуре до полностью развёрнутого состояния при высокой температуре. Для поиска различий между кривыми разных видов живых существ, были проведены эксперименты над клетками людей, E. coli, T. thermophilus и дрожжей. «Исследование было прекрасным», – сказал Алан Драммонд [Allan Drummond], биолог из Чикагского университета, имея в виду как масштаб, так и точность процесса.
Во время наблюдений было ясно видно, что белки всех живых существ не разворачиваются все сразу при повышении температуры. «Мы увидели, что лишь небольшое подмножество белков разрушилось на самых ранних стадиях, – сказала Пикотти, – и это были ключевые белки». На диаграмме с переплетениями межбелковых связей самые хрупкие белки из этого небольшого подмножества часто обладали большим количеством связей, что означает, что они влияют на множество процессов, происходящих в клетках. «Без этих белков клетки не могут работать, – сказала Пикотти. – Когда они пропадают, вся сеть разрушается». И вместе с ней, очевидно, останавливается и жизнь клетки.
Этот парадокс – самые важные белки оказываются самыми хрупкими – может быть отражением того, как эволюция создала их для выполнения соответствующих задач. Если у белка есть множество ролей, его нестабильность и склонность к разворачиванию и повторному сворачиванию может стать преимуществом, поскольку она может позволить ему принимать разные формы, подходящие к разным задачам. «Многие из этих ключевых белков обладают большой гибкостью, что и делает их менее стабильными», но при этом наделяет их способностью связываться с различными целевыми молекулами в клетке, пояснила Пикотти. «Скорее всего, именно так они справляются со своими функциями. Это некий компромисс».
Тщательнее изучив E. coli, для которой собранные данные получились наиболее качественными, исследователи обнаружили и связь между обилием белка – количеством его копий в клетке – и его стабильностью. Чем больше копий белка делает клетка, тем больше температура требуется для его уничтожения. При этом оказывается, что большое количество копий не коррелирует с критичностью белка для выживания. Некоторые ключевые белки встречаются очень редко. Эта связь между обилием и надёжностью подтверждает идею, выдвинутую Драммонд ещё лет десять назад – у клеточной системы, изготавливающей белки, есть тенденция к тому, чтобы периодически допускать ошибки. Ошибка обычно дестабилизирует белок. Если этот белок оказывается распространённым, и такой белок в клетке появляется сотню или тысячу раз в день, тогда неправильно свернувшиеся копии, произведённые в больших количествах, могут засорить клетку. Таким образом организму выгодно было бы эволюционировать так, чтобы наиболее распространённые белки были бы и наиболее стабильными, что подтверждают полученные командой Пикотти данные.
Чтобы понять, какие качества белка делают его стабильным, исследователи сравнили данные E. coli и T. Thermophilus. Белки E. coli начали разваливаться при 40 °C, и практически полностью деградировали при 70 °C. Но при этой температуре белки T. thermophilus только начинали испытывать дискомфорт – некоторые из них держали форму и при 90 °C. Команда обнаружила, что у T. thermophilus белки обычно были короче, и некоторые типы форм и компонентов белка чаще встречались в самых стабильных из них.
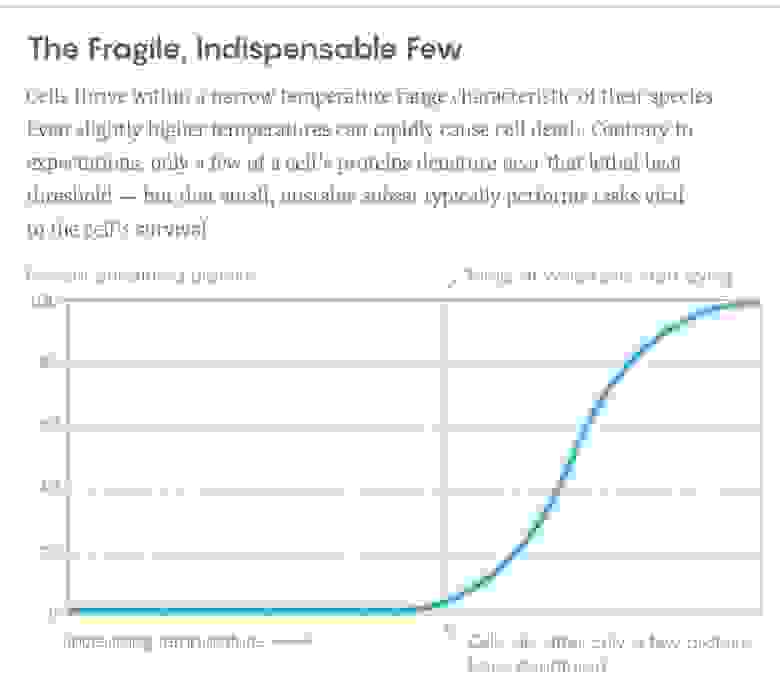
Пример кривой из эксперимента. По вертикали – процент развернувшихся белков, по горизонтали – температура. Вертикальная черта – температура, при которой клетки начинают умирать. Для этого нужно развернуться всего нескольким ключевым белкам.
Открытия могут помочь исследователям разработать белки, чья стабильность подстроена под их задачи. Во многих промышленных процессах, где используются бактерии, повышение температуры повышает и отдачу – но довольно скоро бактерии начинают умирать от жары. Было бы интересно узнать, сможем ли мы стабилизировать бактерии, сделав ключевые белки более устойчивыми к температуре – сказала Пикотти.
Обилие информации по поводу того, насколько легко разворачиваются определённые белки, сильно порадовало некоторых биологов. От стабильности белка напрямую зависит вероятность его агрегации: появления комков неразвернувшихся белков, прилипающих друг к другу. Агрегаты белков могут обернуться кошмаром для клеток и мешать выполнению главных задач. К примеру, их обвиняют в появлении некоторых серьёзных неврологических проблем, таких, как болезнь Альцгеймера, при которой бляшки развернувшихся белков засоряют мозг.

Паола Пикотти
Но это не значит, что агрегация происходит только у организмов, страдающих определёнными заболеваниями. Наоборот, исследователи поняли, что возможно, она происходит постоянно, и что у здоровых клеток есть методы, при помощи которых они справляются с нею. «Я думаю, что всё чаще это явление признаётся очень распространённым», – сказал Микель Вендрусколо [Michele Vendruscolo], биохимик из Кембриджского университета. «Большинство белков неправильно сворачиваются и агрегируют внутри клеток. Самое важное, что установила команда Пикотти, это тот отрезок времени, в котором какой-либо выбранный белок находится в развёрнутом состоянии. Это время определяет степень возможной агрегации белка». Некоторые белки почти никогда не разворачиваются и не агрегируют, другие ведут себя так в определённых условиях, а иные делают так постоянно. По словам биохимика, детальное описание белков в новой работе сильно облегчит изучение и понимание этих различий между белками. Некоторые из денатурационных кривых говорят о том, что их белки агрегируют после того, как развернулись. «У них получилось отследить оба этапа – как развёртывание, так и последующую агрегацию, – сказал Вендрусколо. – В этом вся прелесть этого исследования».
И хотя многие учёные интересуются агрегатами из-за наносимого ими ущерба, некоторые смотрят на это явление с другой точки зрения. Драммонд говорит, что становится ясным, что некоторые агрегаты – это не просто кусочки мусора, болтающиеся в клетке. Они содержат активные белки, продолжающие выполнять свои функции.
Представьте, что вы издалека видите дым, поднимающийся из какого-либо здания, говорит Драммонд. Вокруг здания вы видите некие фигуры, и вы представляете себе, что это тела, извлечённые из руин. Но если вы подойдёте ближе, вы можете обнаружить, что это живые люди, спасшиеся из горящего здания, ждущие, пока происшествие закончится. Так получается с исследованием агрегатов, говорит Драммонд: исследователи обнаруживают, что белки в агрегатах оказываются не жертвами, а выжившими. «Сейчас вообще появляется новая область науки, растущая взрывными темпами», – говорит он.
Комкование белков может оказаться не признаком повреждений, а способом для белка сохранять свои функции в сложной ситуации. Оно может, к примеру, защищать их от окружающей среды. А когда условия улучшаются, белки могут покидать агрегаты и сворачиваться заново. «Их форма меняется в зависимости от температуры таким образом, что на первый взгляд это кажется неправильным сворачиванием, – говорит Драммонд. – Но в этом есть какой-то иной смысл». В статье в журнале Cell от 2015 года он с коллегами определил 177 белков дрожжей, сохранивших свои функции уже после попадания в агрегаты. В работе, вышедшей в марте, эта команда описала, что если изменить один из белков так, чтобы он не смог агрегировать, то это приводит к серьёзным проблемам в функционировании клетки.
В общем и целом, работа утверждает, что белки – удивительно динамичные структуры. Сначала они могут показаться жёсткими машинами, работающими над зафиксированными задачами, для которых подходит одна определённая форма. Но на самом деле белки могут принимать несколько различных форм во время своей нормальной работы. И в нужное время их форма может меняться так сильно, что может показаться, будто они портятся, хотя на самом деле они наоборот укрепляются. На молекулярном уровне жизнь может представлять собой постоянные соединения и разъединения связей.
О свертываемости протеина при кипячении, правда или миф?
Ответ на мифы о свертываемости протеина при кипячении.
О свертываемости белка (статья Михаила Гаманюка для журнала Геркулесъ)
Не так давно мы получили звонок от одного из продавцов спортивного питания, который попал в затруднительную ситуацию. В магазин пришел покупатель, приобрел банку сывороточного протеина, потом вернулся домой и, начитавшись опусов в Интернете, решил проверить, качественный ли это белок. Хочу сразу заверить, что срок годности продукта был нормальный, производитель — вполне почтенный, завозчик в Россию — официальный дилер с солидным стажем работы тоже внушал доверие. Однако почему-то захотелось проверить. Каким образом? Очень просто.
Интернете покупатель вычитал, что если хороший белок поместить в кипяток, то он непременно свернется. Наш с вами белок, о ужас, сворачиваться не захотел. Понятно, что покупатель тут же двинул назад в магазин сдавать злополучную банку. Хозяин, понятное дело, расстроился. Не столько из-за того, что пришлось возвращать деньги, сколько из-за возможных слухов о том, что магазин торгует подделкой и прочее.
Заливая кипятком белок, я понимаю, что вы хотите добиться его денатурации (нарушения структуры молекулы белка, приводящего к потере характерных для нее свойств растворимости, электрофоретической подвижности, биологической активности и т.д.). Если так, то молочная сыворотка — это уже продукт СВОРАЧИВАНИЯ и фильтрации молока! То есть это белковое соединение, в котором полипептидные цепи плотно свернуты в компактные шарообразные структуры — глобулы (третичные структуры белка). Опять же поясню: денатурация белка в таких растворах протекает без значимого повышения вязкости (нарушения растворимости). То есть того, чего, собственно, все и ждут! Чтобы вы понимали процесс, сыворотка-сырец уже при изготовлении подверглась температурной обработке для борьбы с микроорганизмами. Скажем, для борьбы с возбудителями туберкулеза, бруцеллеза, чумы, сибирской язвы кишечной палочки и т. д. молоко, нагревают до температуры 75 °C с выдержкой в 30 минут. Это норма режима пастеризации молока, где за основу принимают тепловую обработку туберкулезной палочки. Такие белки в любом случае назвать полноценными по структуре нельзя. Именно по причине значительной обработки белка и его компонентов спортивное питание — это лишь дополнение к обычной еде, а не ее замена. Для тех, кто имеет профильное образование, в заключение хочу вернуться к вопросу коагуляции белка сыворотки под воздействием высокой температуры. Я перелопатил энное количество литературы и выяснил, что даже для совершенно конкретного белка молочной сыворотки не существует четко определенного «характерного времени сворачивания». Так что для «эталонной» коагуляции этой белковой фракции требуется ряд условий, которые зачастую у всех разные. В домашних условиях выяснить качество и количество белка в растворе нереально, это как собирать реактор дома. Если вас очень беспокоит этот вопрос, вам нужна нингидриновая проба (тест на аминокислоты), Брэд- форд (тест на белок) и Форез (тест на спектр белков). Кипячение ничего не доказывает, так как биохимия белка в разных условиях различна. Я готов спорить, если ответы будут действительно аргументированы и подкреплены знаниями, а не из разряда «сам дурак».
Молочная сыворотка — это уже продукт сворачивания и фильтрации молока! Это белковое соединение, в котором полипептидные цепи плотно свернуты в компактные шарообразные структуры — глобулы.
Исследовательская работа. Химические опыты с белком
ОТДЕЛ ПО УПРАВЛЕНИЮ ОБРАЗОВАНИЕМ АДМИНИСТРАЦИИ СВОБОДНЕНСКОГО РАЙОНА АМУРСКОЙ ОБЛАСТИ
Муниципальное общеобразовательное учреждение
«Новгородская средняя общеобразовательная школа им. В.Н. Лесина»
Гончарук Алина, Калина Евгения,
Мащенок Татьяна Ивановна, учитель биологии
с. Новгородка 2019 г
2.1. Методика проведения опытов………………………………………………….. 6
Список использованной литературы……………………………………………. 12
«Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причём с прекращением этого обмена веществ, прекращается и сама жизнь, что приводит к разложению белка» (Ф. Энгельс). Что вам известно о белках?
Современная книга о происхождении жизни могла бы начинаться фразой: «В начале был белок». Другое название белка – протеины происходит от греческого слова «протос», то есть первый, важнейший и подчеркивает их исключительную роль в процессах жизнедеятельности. Белки всюду, где есть жизнь!
Белок – неотъемлемая составляющая нашего организма, нарушение которой может вызвать его разрушение. Необходимость постоянного получения белковой пищи человеком вызвано наличием у белка определенных функций, которые необходимы живому организму для его развития, размножения и осуществления жизнедеятельности.
Волосы, ногти, когти, шерсть, перья, копыта, наружный слой кожи – все они целиком состоят из белка. В мышцах действуют незримые белковые «пружины». Внутренняя поверхность глаза покрыта слоем высокочувствительного белка. Белки крови некоторых антарктических рыб имеют свойство антифриза – предохраняют кровь от замерзания. Белки заведуют питанием организма, ростом, движением, чувствительностью, работой мозга, охраняют от возбудителей болезней – бактерий, вирус ов, лечат от насморка и гриппа.
Биохимический синтез белка в промышленных целях важен для человечеств, это позволяет создавать искусственные препараты, продукты питания и средств индивидуальной защиты.
Всё это определяет актуальность проблемы исследовательской работы.
Цель исследования: Рассмотреть свойства белков и их значение в жизни человека
1) Изучить свойства и функции белков
2) Провести опыты на выявление свойств белка
3) Определить значение белков для живых организмов, опасность влияния отдельных факторов среды
Гипотеза : Знание свойств белков поможет избежать многих нежелательных процессов.
Объект исследования : белок
Предмет исследования – свойства белков
Методы исследования: наблюдение за свойствами белка в ходе проведения опытов. Анализ химических опытов.
Обзор литературы. Азбука живой материи. Белки
Более четырех миллиардов лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными блоками живых организмов. Свое название белки получили от яичного белка, который с незапамятных времен использовался человеком как составная часть пищи. Согласно описаниям Плиния Старшего, уже в Древнем Риме яичный белок применялся и как лечебное средство. Однако подлинная история белковых веществ начинается тогда, когда появляются первые сведения о свойствах белков как химических соединений (свертываемость при нагревании, разложение кислотами и крепкими щелочами и т. п.)
Впервые термин белковый (albumineise) применительно ко всем жидкостям животного организма использовал французский физиолог Ф. Кене в 1747 г.
Белковых молекул в живой клетке во много раз больше, чем всех других (кроме воды). Ученые выяснили, что у большинства организмов белки составляют более половины их сухой массы. И разнообразие видов белков очень велико – в одной клетке такого маленького организма, как бактерия Escbericbia coli насчитывается около трех тысяч различных белков.
Впервые белок был выделен в виде клейковины в 1728 году итальянцем Якопо Бартоломео Беккари (1682 – 1766 годы жизни) из пшеничной муки. Это событие принято считать рождением химии белка. С тех пор почти за три столетия из природных источников получены тысячи различных белков и исследованы их свойства.
Химические опыты с белком
Для проведения эксперимента потребуется:
яичный белок, волосы, шерсть, ткань, бумага, стеклянная палочка, сухое горючее, чашка, спички. Взять стеклянную палочку; нанести на нее яичный белок; нагреть в пламени сухого горючего до почернения. Проделать повторно с остальными компонентами: бумагой, шерстью, тканью, волосом.
Опыт 2 . Денатурация при нагревании. Налить в пробирку 10 мл раствора белка (молоко, яйцо) и нагреть до кипения.
Объясните причину образования осадка белка.
Опыт 3. Действие этилового спирта на белки.
К раствору белка добавьте этиловый спирт.
Объясните причину образования осадка белка.
Опыт №4. Действие фенола и уксусной кислоты на белок
К раствору белка добавьте 6-7 капель раствора фенола.
Объясните причину образования осадка белка
Опыт №5. Химизм приготовления мяса
Налейте в пробирку холодной воды, опустите в нее немного сырого рубленого мяса и нагрейте. В другой пробирке воду вскипятите заранее и положите сырое мясо уже в кипяток. Что наблюдаете? Выясните причину изменений в бульоне и мяса
2.2. Результаты опытов
При проведении данного опыта можно увидеть различие тканей животного, растительного и искусственного происхождения.
Вывод : синтетика при поджигании плавится, растительные волокна пахнут горелой бумагой, а шерсть – паленым белком.
Большинство полимеров не принимает устойчивой формы в пространстве. Отдельные маленькие молекулы, входящие в состав белка, обладают способностью «слипаться», так как между ними действуют силы притяжения. В результате у любой белковой цепи есть характерная только для нее пространственная структура. Именно она определяет свойства белков. Без такой структуры они не могли бы выполнять те функции, которые осуществляют в живой клетке.
Опыт 2. Денатурация при нагревании
Налили в пробирку 10 мл раствора белка (молоко, яйцо) и нагрели до кипения. Наблюдаем свертывание белка яйца, образование осадка
Вывод: опыт показал разрушение (денатурацию) белка под воздействием температуры.
7
Белки служат питательными веществами. В семенах многих растений (пшеницы, кукурузы, риса и других) содержатся пищевые белки. К ним относятся также альбумин – основной компонент яичного белка и казеин – главный белок молока. При переваривании в организме человека белковой пищи происходит гидролиз пептидных связей. Белки «разбираются» на отдельные аминокислоты, из которых организм в дальнейшем «строит» новые пептиды (соединения аминокислот в длинную цепочку) или использует для получения энергии. Отсюда и название: греческое слово «пептос» означает «переваренный». Гидролизом пептидной связи управляют тоже белки – ферменты.
Почему врачи рекомендуют “сбивать” температуру у больного, если она превышает 38 °С?
Ферменты (белки) регулируют большинство биохимических процессов внутри нас: клеточное дыхание, расщепления жиров и углеводов и т.д. При повышении температуры: они просто перестают работать. И это приводит к серьезным осложнениям. Из курса физики 10-го класса мы знаем, что температура – величина, характеризующая интенсивность движения атомов. Температура прямо пропорциональна среднеквадратичной скорости атомов и среднекинетической энергии (Е = m 2 /2 = 3/2kT). Поэтому повышение температуры (увеличение внутренней энергии движения) вызывает увеличение амплитуды колебаний атомов звеньев структуры. Следовательно, увеличивается расстояние между атомами, связываемыми водородной связью. При больших амплитудах колебаний водородная связь разрушается, при этом увеличивается нагрузка на соседние связи спиральной структуры, и в конечном итоге структура белка быстро распадается.
Мы решили смоделировать «переваривание» жиров молока при помощи лекарственных препаратов «мезим», «фестал», выполняющих роль ферментов.
В процессе опыта были установлены оптимальные условия для ферментативной активности: температурный оптимум,36,7 с.
При комнатной температуре переваривание происходило медленно. При нагревании наблюдали осадок.
Опыт 3. Действие этилового спирта на белки.
К раствору белка добавили этиловый спирт.
Наблюдаем свертывание белка, образования осадка белка.
Почему регулярное употребление алкоголя неизбежно ведёт к поражению нервной системы, печени, сердца?
При употреблении спиртных напитков содержащийся в них этанол легко проходит через биологические мембраны. Одновременно он повреждает их структуру, увеличивая проницаемость для многих токсичных веществ. Самые тяжёлые последствия систематического употребления алкоголя связаны с его токсичным действием на генетический аппарат человека и развивающийся плод. Доказано, что регулярное употребление алкоголя постепенно приводит к ферментно-витаминной недостаточности, а это неизбежно ведёт к поражению нервной системы, печени, сердца.
Опыт №4. Действие фенола и уксусной кислоты на белок
К раствору белка добавили 6-7 капель раствора фенола. В опыте дополнительно использовали просроченный препарат аспирина.
Наблюдали образование осадка белка.
Почему нельзя применять медицинские препараты с истёкшим сроком годности?
Для получения различных лекарственных препаратов, например, аспирина (ацетилсалицилловой кислоты), используется фенол . При долгом хранении аспирин разлагается до салицилловой кислоты, которая содежит фенольную группу. Фенол обладает общетоксичным, раздражающем эффектом, на кожу, слизистую, действует прижигающее, вызывает дерматиты.
Опыт №5. Химизм приготовления мяса
Налили в кастрюлю холодной воды, опустили в нее немного сырого рубленого мяса и нагрели. В другой кастрюле воду вскипятили заранее и положили сырое мясо уже в кипяток. В первой кастрюле наблюдали обильные хлопья на
поверхности, во второй бульон был прозрачным.
Почему при приготовлении отварного мяса его рекомендуют опускать в кипяток?
Чтобы приготовить вкусный бульон, надо нарезанное мясо положить в холодную воду. А чтобы приготовить отварное мясо, большие куски нужно опускать в кипяток. В этом химический смысл?
По мере нагревания воды, куда помещены рубленые куски мяса, образуются (и в большом количестве) серые хлопья. Это свернувшийся белок, пена, которую снимают шумовкой, чтобы не портила вид и вкус бульона. При дальнейшем нагревании растворимые в воде вещества постепенно переходят из мяса в раствор. Эти вещества называют экстрактивными, потому что они извлекаются из мяса при его экстракции кипящей водой (проще говоря, при варке бульона). Они-то, в первую очередь, и придают бульону характерный вкус. А мясо, лишившись этих веществ, становится менее вкусным.
Большой кусок сырого мяса при соприкосновении с кипятком моментально станет серым, зато хлопьев образуется очень мало. Тот белок, что находился на поверхности, под действием высокой температуры сразу свернулся и закупорил многочисленные поры, которые пронизывают мясо. Экстрактивные вещества, и белки в том числе, уже не могут перейти в раствор. Значит, они остаются внутри мяса, придавая ему хороший вкус и аромат. А бульон, разумеется, получается несколько хуже.
1. Белки служат основным строительным материалом клеток, с ними связаны многие жизненные функции, такие, как перенос кислорода, иммунные процессы, сокращение мышц.
В ходе проведенных опытов мы убедились в разрушении белка под воздействием высокой температуры, кислот, этилового спирта, фенолов
Анализ химических опытов показывает опасность высокой температуры, употребления алкоголя и просроченных лекарств.
Исследуя проблему «Белок. Значение белка для человека» мы выяснили, что белки играют важнейшую роль в жизнедеятельности всех организмов. При пищеварении белковые молекулы перевариваются до аминокислот, которые хорошо растворяются в водной среде, проникают в кровь и поступают во все ткани и клетки организма. Наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть — на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал. Высокая температура, многие химические вещества негативно действуют на белок.
Основными источниками белков для человека являются: мясо, яйца, рыба, фасоль, горох и бобы. В отличие от углеводов и жиров в организме не происходит накапливания и запасания белков.
Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом, и повсюду, где мы встречаем какое-либо белковое тело, которое не находится в процессе разложения, мы без исключения встречаем и явление жизни. Жизнь – есть способ существования белковых тел.
Список использованных источников и литературы
Алексеева, С.В., Алексашина, И.Ю. Универсальный справочник школьника. 5-11 класс. Учебное пособие нового типа: Книга 2. /– СПб.: ИД «Весь», 2014. – 704 с.
Большая энциклопедия эрудита. М.: «Махаон», 2014. – 488с.
