что будет если азитромицин принять во время еды
Клинико-фармакологические особенности азитромицина как основа эффективности коротких курсов антибактериальной терапии
Азитромицин остается сегодня одним из предпочтительных антибиотиков для лечения инфекций верхних и нижних дыхательных путей. Он обладает высокой активностью в отношении наиболее вероятных бактериальных возбудителей респираторных инфекций, включая внутрикл
Azithromycin currently remains one of preferable antibiotics in treatment of upper and lower air passage infections. It has high activity in respect of the most probable bacterial agents of respiratory infections, including intracellular pathogens and hemophilic bacillus.
История группы макролидных антибиотиков началась в 1952 году, когда из культуры Streptomyces erythreus был выделен эритромицин. Этот антибиотик с успехом применялся в течение многих последующих лет [1]. Химическую основу макролидов составляет макроциклическое лактонное кольцо, связанное с одним или несколькими углеводными остатками. В зависимости от числа атомов углерода в структуре молекулы, макролидные антибиотики подразделяются на 14-членные (эритромицин, кларитромицин, рокситромицин, диритромицин), 15-членные (азалиды) — азитромицин и 16-членные (спирамицин, джозамицин, мидекамицин, рокитамицин, мидекамицина ацетат). В настоящее время к классу макролидов относится большое количество препаратов (рис. 1).
Часть макролидов является природными, а часть — полусинтетическими.
По отчетам Европейского общества антимикробной химиотерапии (European society of antimicrobial chemotherapy, ESAC), макролиды занимают второе место по объему потребления среди антибиотиков, применяющихся в амбулаторной практике, уступая только пенициллинам [4]. В Австрии проведен анализ многолетней динамики использования антибактериальных препаратов разных классов с 1998 по 2007 г., результаты которого свидетельствуют о неуклонном росте потребления современных макролидов. При этом особенно активно используется именно азитромицин. Так за рассмотренный период использование эритромицина сократилось на 75%. В то же время увеличение показателя потребления (количество упаковок препарата на 1000 человек) у азитромицина составило 24,7%. Для кларитромицина значение данного показателя снизилось на 9,9% [5]. В основе такого высокого уровня потребления азитромицина и его продолжающегося роста лежат фармакологические свойства молекулы, спектр действия, особенности фармакокинетики, наличие лекарственных форм для энтерального и парентерального введения.
Азитромицин был синтезирован в 1981 году путем включения атома азота в 14-членное лактонное кольцо эритромицина между 9-м и 10-м атомами углерода. Он был отнесен к группе полусинтетических 15-членных макролидных антибиотиков — азалидов и остается пока в ней единственным. В 1988 г. по завершении многочисленных доклинических и клинических испытаний оригинальный азитромицин был выведен на мировой фармацевтический рынок. В этом же году он был зарегистрирован в СССР и странах Восточной Европы под торговым названием Сумамед®, которое в настоящее время очень хорошо известно врачам различных специальностей: педиатрам, терапевтам, пульмонологам, оториноларингологам, гинекологам, урологам и др. Механизм антибактериального действия азитромицина аналогичен таковому других макролидов. В его основе лежит ингибирование РНК-зависимого синтеза удлинения белковой молекулы, чувствительной к действию антибиотика бактерии [6]. Антибиотик обратимо связывается с 50S-субъединицей бактериальной рибосомы микроорганизма, блокируя процессы транспептидации и/или транслокации, в результате преждевременно отщепляется растущая тРНК-полипептидная цепочка и прекращается сборка белковой молекулы. Азитромицин характеризуется наличием значимого постантибиотического и суб-МПК эффектов в отношении S. pneumoniae, S. pyogenes, H. influenzae и Legionella pneumophila [6]. Под постантибиотическим эффектом понимают персистирующее ингибирование жизнедеятельности бактерий после их кратковременного контакта с антибактериальным препаратом, а суб-МПК эффект заключается в подавлении роста микроорганизмов при воздействии антибиотика в концентрации, ниже минимальной подавляющей концентрации (МПК).
Азитромицин активен в отношении большинства потенциальных возбудителей инфекций дыхательных путей. Важно, что в отличие от других макролидов он активен против H. influenzae, включая штаммы, продуцирующие β-лактамазы. Также препарат имеет наивысшую среди макролидов активность в отношении Mycoplasma pneumoniae (табл.).
Уникальным среди антибиотиков азитромицин сделали фармакокинетические параметры, особенно наличие тканевой (тканевонаправленной) фармакокинетики. Препарат частично метаболизируется в печени путем деметилирования (известно 10 его метаболитов, не обладающих фармакологической активностью), а 50% с желчью экскретируется в кишечник в неизменeнном виде и выделяется с каловыми массами. Небольшая часть дозы (6–11%) выделяется с мочой. В отличие от 14-членных макролидов, а также препаратов — фторхинолонов, азитромицин не оказывает значимого ингибирующего влияния на микросомальную систему цитохрома Р-450. Это предопределяет низкую вероятность лекарственных взаимодействий [8]. Так, в отличие от эритромицина и кларитромицина азитромицин не взаимодействует с теофиллином, карбамазепином, варфарином, рифабутином и другими лекарствами, метаболизм которых осуществляется на ферментах-цитохромах Р450. В то же время при одновременном приеме антацидов всасывание азитромицина может нарушаться, что, впрочем, характерно для очень большого числа различных лекарственных средств.
М. В. Пчелинцев, кандидат медицинских наук
ГБОУ ВПО СПбГМУ им. И. П. Павлова МЗ РФ, Санкт-Петербург
Хронический и острый бронхит: чем опасна болезнь и как её лечить
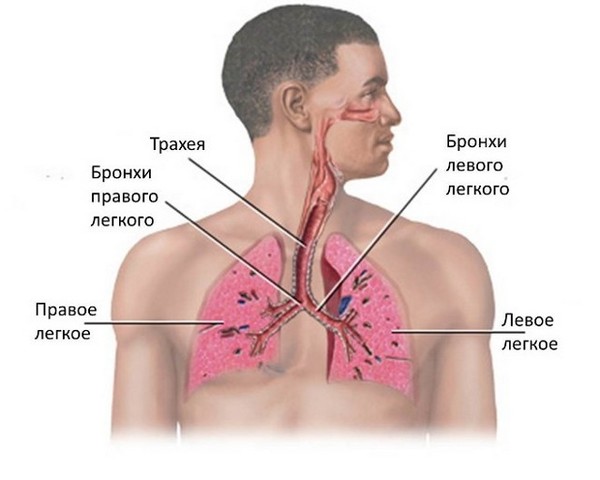
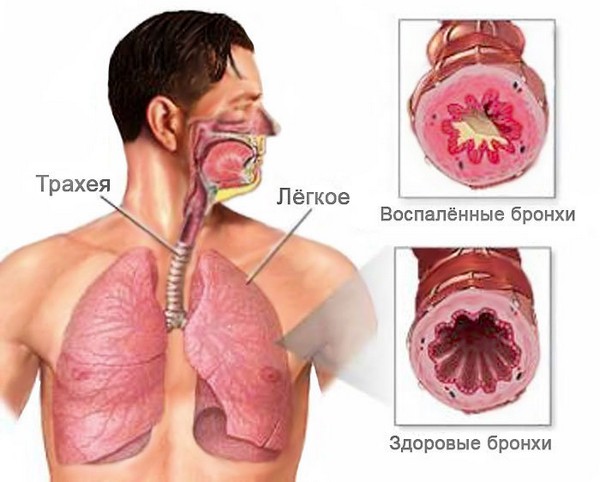
Бронхит – это патологическое состояние, при котором развивается воспаление бронхов. В свою очередь, бронхи – это пути, которые проводят воздух от трахеи к тканям легких, согревают воздушный поток, увлажняют и очищают его. Находятся они в нижней части трахеи и представляют собой две крупных ветви.
Болезнь вызывает воспаление слизистой оболочки или всей толщи бронхиальных стенок. Начинается чрезмерное выделение слизи, затрудняется дыхание. Организм пытается самостоятельно вывести лишнюю слизь, поэтому появляется сильный мучительный кашель. Патология может переходить из кратковременной острой в продолжительную хроническую форму, поэтому требует комплексного незамедлительного лечения.
Острый бронхит
Развивается в подавляющем большинстве случаев и представляет собой распространенное осложнение острой респираторной инфекции. Зачастую диагностируется у детей, так как они более восприимчивы к подобным инфекциям.
При остром поражении бронхов происходит размножение условно-патогенной микрофлоры. Слизистая меняет свою структуру, развивается поражение верхних слоев и стенок бронхов. Формируется отек слизистой, эпителиальные клетки отторгаются организмом, появляются инфильтраты на подслизистом слое. Процессы сопровождаются тяжелым продолжительным кашлем, который может сохраняться даже после излечения пациента.
Острая форма лечится в течение 3-4 недель. На протяжении этого времени восстанавливается структура и функции бронхов. При правильной и своевременной терапии прогноз благоприятный.
Хронический бронхит
При хроническом бронхите кашель с выделением мокроты наблюдается на протяжении не менее двух лет в течение трех месяцев ежегодно. При этом важно исключить наличие других причин кашля.
Такая форма чаще возникает у взрослых, так как формируется только при длительном раздражении бронхов. Причиной раздражения может быть не только многократно перенесенное острое заболевание, но и сигаретный дым, газы, пыль, химические испарения и прочие отрицательные факторы.
Продолжительное воздействие на слизистую бронхов неблагоприятных факторов вызывает изменения в слизистой, постепенное повышение выделения мокроты. Существенно снижается способность бронхов проводить воздух, а вентиляция легких нарушается.
Формы хронического бронхита
В зависимости от характера воспалительных процессов выделяют:
С учетом наличия нарушения проходимости (обструкции) дыхательных путей бронхит может быть:
По причинам развития болезни выделяют:
Причины заболевания
При острой и хронической формах причины развития патологического состояния бронхов несколько отличаются.
Острый бронхит в 90% случаев формируется в результате попадания в организм вирусной инфекции: гриппа, аденовируса, респираторно-синцитиального, коревого или коклюшного вируса, а также прочих возбудителей. Реже болезнь становится результатом бактериального поражения стафилококком, стрептококком, пневмококком и др.
Среди прочих факторов, которые способствуют развитию острой формы болезни:
При хронической форме основной причиной развития признано курение. У курильщиков болезнь диагностируют в 2-5 раз чаще, чем у некурящих людей. Табачный дым наносит вред как при активном, так и при пассивном курении.
Среди прочих предпосылок развития хронической формы – повторно перенесенные и частые острые бронхиты, ОРВИ, пневмонии, болезни носоглотки. Инфекционная составляющая в таких условиях усугубляет уже имеющееся поражение бронхов.
Симптомы бронхита
Признаки патологии отличаются в зависимости от острой или хронической формы течения болезни:
Осложнения
Острый бронхит может провоцировать осложнение в виде бронхопневмонии – инфекционно-воспалительного процесса, который поражает легкие, вызывает лихорадку, сухой кашель, общую слабость.
Бесконтрольное прогрессирование хронического заболевания приводит к регулярным острым пневмониям и со временем переходит в обструктивную болезнь легких. При этом сужается просвет и отекает слизистая дыхательных путей, частично разрушаются легочные ткани.
Хронический бронхит также может стать причиной развития легочной гипертензии, сердечно-легочной недостаточности, эмфиземы легких, бронхоэктатичской болезни, пневмонии и ряда других опасных заболеваний.
Когда стоит обратиться к врачу
Крайне важно не пускать болезнь на самотек. К врачу нужно обращаться при появлении первых симптомов возможного бронхиального поражения: кашля, повышенной температуры, недомогания. Врач проведет диагностику, укажет, как и чем лечить бронхит и кашель, а дальнейшая терапия пройдет в домашних условиях под контролем доктора. В большинстве случаев патология не требует госпитализации.
Бесконтрольное течение острой болезни в большинстве случаев приводит к усугублению симптоматики, повторному развитию заболевания, переходу в хроническую болезнь и формированию осложнений.
Чтобы определить болезнь и изучить степень поражения бронхов, необходима комплексная диагностика пациента и изучение клинической картины. Этим занимается терапевт или педиатр, который назначает необходимые для диагностики обследования. При необходимости он направляет пациента на консультации к пульмонологу и другим смежным специалистам.
Если по результатам опроса и осмотра у врача появились подозрения на бронхит или другие схожие болезни, назначаются дополнительные обследования:
Среди возможных дополнительных исследований: эхокардиография, электрокардиография, бронхография и др.
Лечение
Терапия бронхита носит комплексный характер, так как преследует цель избавить организм от инфекции, восстановить проходимость бронхов, устранить усугубляющие болезнь факторы.
В первые дни острой фазы необходимо придерживаться постельного режима, много пить, соблюдать молочно-растительную диету. Крайне важно отказаться от курения и поддерживать влажность воздуха в помещении, где находится больной, на уровне 40-60%.
Медикаментозная терапия острой стадии cводится к приему препаратов, которые облегчают симптомы и предотвращают развитие осложнений. Для этого используют:
Важную роль играет физиотерапия. Улучшить состояние пациента помогает лечебная гимнастика, физиотерапия, вибрационный массаж.
Хроническая форма заболевания требует продолжительного лечения как при обострении, так и во время ремиссии. Схема терапии предусматривает прием перечисленных препаратов по назначению врача, а также интенсивную программу легочной реабилитации, которая помогает снизить проявления болезни.
Максимально важно устранить из жизни пациента причину, которая спровоцировала развитие хронического бронхита, вести здоровый образ жизни, укреплять иммунитет и правильно питаться.
Профилактика бронхита
Профилактика легочных заболеваний – это комплексный и систематический процесс, цель которого – укрепить защитные силы организма и минимизировать воздействие факторов риска. Для этого необходимо в первую очередь отказаться от курения, защищать легкие от пыли, вредных химических соединений, слишком горячего или сухого воздуха. В рамках профилактики важно своевременно лечить хронические инфекции, предотвращать аллергические реакции и обязательно обращаться к врачу при первых признаках заболевания, проходить ежегодную вакцинацию от гриппа и пневмонии.
Инфекция мочевых путей в пожилом возрасте (старше 65 лет) и ее коррекция в амбулаторной практике
Инфекция мочевыводящих путей (ИМП) — инфекционно-воспалительный процесс в мочевыводящих путях (мочеточники, мочевой пузырь, уретра) без вовлечения в патологический процесс паренхимы почек.
Инфекции мочевой системы широко распространены в пожилом возрасте. Этому способствует ряд факторов: изменение нормальных анатомо-физиологических особенностей органов малого таза (пролапс тазовых органов), несостоятельность эпителия мочевыводящих путей, уменьшение образования слизи, ослабление местного иммунитета, нарушения микроциркуляции, увеличение загрязнения в области уретры в результате недержания мочи, недержания кала, старческого слабоумия (несоблюдение правил личной гигиены).
Частота встречаемости ИМП у пожилых людей значительно выше, чем у молодых. По крайней мере, 20% женщин и 10% мужчин старше 65 лет имеют мочевую инфекцию. В сравнении с молодыми людьми, среди которых наличие мочевой инфекции в 30 раз чаще встречается у женщин, у пожилых людей соотношение встречаемости заболевания женщина/мужчина снижается до уровня 2:1.
Наиболее частым возбудителем мочевых инфекций является кишечная палочка, реже встречаются другие грамотрицательные микроорганизмы, а также стафилококки и энтерококки. В ряде случаев ИМП обусловлены хламидиями, уреаплазмой, а также грибковой флорой.
Примерно у 20% больных наблюдаются микробные ассоциации, частое сочетание — кишечная палочка и энтерококк. В течение болезни может наблюдаться смена возбудителя инфекционного процесса, в результате появляются полирезистентные формы микроорганизмов. Это особенно опасно при бесконтрольном и бессистемном применении антибактериальных препаратов. Следует отметить, что собственная мочевая флора, присутствующая и в норме в мочевыводящих путях, при поступлении в стационар очень быстро (за двое-трое суток) замещается на внутрибольничные резистентные штаммы. Поэтому инфекции, развивающиеся в стационаре, оказываются куда более тяжелыми, чем развивающиеся в домашних условиях.
Помимо «обычной» бактериальной флоры, ИМП нередко вызываются протопластами и L-формами бактерий.
Уропатогенными свойствами обладают микробы с наличием на клеточной мембране р-фимбрий, способствующих лучшей адгезии микроорганизма на эпителии мочевыводящего тракта с последующим восхождением по нему. Некоторые микробы обладают гемолизирующими свойствами, снижающими эффективность иммунной защиты, а также способностью расщеплять мочевину, вызывая ощелачивание мочи и риск формирования конкрементов.
Для возникновения ИМП необходимы предрасполагающие факторы со стороны макроорганизма и наличие микробного агента.
Клинические проявления ИМП варьируют от тяжелого воспалительного до бессимптомного течения. Наиболее часто пациенты жалуются на болезненность и чувство жжения в уретре, учащенное, болезненное мочеиспускание (в начале акта мочеиспускания), иррадиацию боли в промежность, выделения из уретры (слизисто-гнойные или кровянистые). При лабораторном исследовании наблюдаются: изменения в общем анализе крови (ускорение СОЭ, воспалительный бактериальный сдвиг в лейкоцитарной формуле), в общем анализе мочи (слизь, умеренное количество белка, лейкоциты), в биохимическом анализе крови отмечается повышение титра С-реактивного протеина, имеется наклонность к гиперкоагуляции крови. У части больных обнаруживаются нарушения функциональных показателей клубочкового и канальцевого аппарата. При цистоскопии находят изменения на слизистой мочевого пузыря. Кардинальным признаком инфекции мочевой системы считается бактериурия свыше 105 микробных тел в 1 мл мочи, собранной из средней части струи при свободном утреннем мочеиспускании, или любая степень бактериурии в моче, полученной при надлобковой пункции.
При острых ИМП и обострениях хронических главным принципом лечения является незамедлительность антимикробной терапии во избежание повреждающего действия микробного воспаления на почки. Поэтому стартовый препарат выбирается, как правило, эмпирически, на основе знаний этиологической характеристики вероятных возбудителей и их потенциальной чувствительности к данному препарату, а также исходя из опыта предшествовавшего лечения, клинической симптоматики, возраста больного, доступности лекарственных средств, с учетом возможных побочных действий. При отсутствии клинического эффекта через 3 дня эмпирической терапии проводится ее коррекция со сменой антибиотика, учитывая данные посева мочи. При легком течении ИМП обычно используются пероральные формы антимикробных препаратов. При тяжелом течении рекомендуется «ступенчатая» терапия, которая предусматривает использование в течение первых 3–5 дней парентеральных препаратов с последующей их сменой по мере купирования воспалительного процесса на пероральные препараты. Среднетяжелые и тяжелые формы ИМП рекомендуется лечить в условиях стационара.
Пенициллины
Для эмпирической терапии ИМП в настоящее время рекомендуется применение «защищенных» пенициллинов на основе амоксициллина с клавулановой кислотой (Амоксициллин, Аугментин, Амоксиклав), поскольку к ним сохраняется высокая чувствительность Escherichia сoli мочи (96–97%). У больных с незначительным снижением скорости клубочковой фильтрации (СКФ) дозы «защищенных» пенициллинов могут не подвергаться корректировке. При снижении СКФ менее 50 мл/мин (по формуле Кокрофта) дозы этих препаратов должны быть уменьшены на 25–75%. Препараты вводятся в 2–3 приема, пероральные формы могут применяться во время еды с целью предупреждения побочных действий в виде расстройств желудочно-кишечного тракта (тошнота, рвота, диарея), которые встречаются в 0,2–1,5% случаев. Как и при любой антибактериальной терапии, возможны аллергические реакции, чаще в виде кожной сыпи.
Режим дозирования:
Амоксициллин — внутрь, по 500 мг 3 раза в сутки; максимальная суточная доза — 6 г. При снижении СКФ до 10–30 мл/мин (у пациентов с хронической болезнью почек) препарат вводят в суточной дозе 1 г, затем — по 0,5 г каждые 12 ч; при СКФ менее 10 мл/мин — 1 г, затем по 0,5 г каждые 24 ч. У больных в состоянии анурии суточная доза не должна превышать 2 г. Больным, находящимся на гемодиализе, назначают дополнительно 2 г препарата: 0,5 г во время сеанса гемодиализа и 0,5 г после его окончания.
Аугментин — внутрь, по 500 мг 3 раза в сутки. При нарушении функции почек проводят коррекцию режима дозирования в зависимости от СКФ.?При СКФ больше 30 мл/мин коррекция дозы не требуется, при СКФ 10–30 мл/мин — 25 мг/кг 2 раза в сутки, при СКФ менее 10 мл/мин — 20 мг/кг 1 раз в сутки.
При проведении гемодиализа Аугментин применяют из расчета 25 мг/кг 1 раз/сут и дополнительно 12,5 мг/кг в конце диализа, затем 25 мг/кг/сут, поскольку суточная концентрация амоксициллина и клавулановой кислоты снижается.
Нельзя назначать Аугментин более 14 дней без оценки целесообразности продолжения терапии.
Амоксиклав — внутрь, по 375 или 625 мг (в зависимости от тяжести инфекции) 3 раза в сутки.
Максимальная суточная доза — 6 г. При почечной недостаточности необходимо уменьшение дозы или увеличение интервала между приемами (при СКФ 10–30 мл/мин интервал между приемами — 12 ч, менее 10 мл/мин — 24 ч).
Цефалоспорины
Основным механизмом действия цефалоспоринов, как и пенициллинов, является нарушение синтеза клеточной стенки бактерий за счет угнетения активности фермента транспептидазы. По данным АРМИДа, цефалоспорины III–IV поколения обладают высокой активностью в отношении E. coli. Резистентность последней не превышала 3,9%, причем не было выявлено резистентных штаммов к цефтазидиму и цефтибутену (III поколение), а к цефепиму (IV поколение) она составляла всего 0,9%. Цефтазидим, цефтибутен и цефепим были наиболее активными цефалоспоринами в отношении Klebsiella pneumoniae и Proteus spp. Наиболее активными в отношении Enterobacter spp. обладает цефепим. Резистентность к нему бактерий в 2–3 раза ниже, чем к другам цефалоспоринам. В отношении Pseudomonas aeruginosa наиболее активными цефалоспоринами были цефтазидим и цефепим.
Из пероральных препаратов наиболее высокая активность отмечалась у цефтибутена, превосходящая некоторые парентеральные цефалоспорины в отношении ряда грамотрицательных возбудителей.
Однако следует учитывать, что цефалоспорины, в отличие от амоксициллина/клавуланата, не действуют на энтерококки, которые являются возбудителями внебольничных форм ИМП.
Цефтазидим — внутрь, по 1–2 г каждые 8 ч или по 2 г каждые 12 ч; в тяжелых случаях — 6 г/сут. При нетяжелых инфекциях и ИМП — 0,5–1 г 2 раза в сутки. На фоне дисфункции почек (в зависимости от тяжести поражения) — 1 г через 12 или 24 ч либо 0,5 г каждые 24–48 ч.
Цефтибутен — внутрь, разовая доза для взрослых составляет 200–400 мг каждые 8 часов. Взрослым пациентам с почечной недостаточностью требуется коррекция дозы: при CКФ 49–30 мл/мин 200 мг в сутки или 400 мг через 48 ч; 29–5 мл/мин — 100 мг/сут или 400 мг через 96 ч. Пациентам, находящимся на гемодиализе (2–3 процедуры в неделю), назначают 400 мг или 9 мг/кг в конце каждого диализа.
Цефепим — внутрь, при нормальной функции почек — 0,5–1 г (при тяжелых инфекциях до 2 г) 2–3 раза в день. Курс лечения 7–10 дней и более. При нарушении функции почек дозу корректируют в зависимости от клиренса креатинина. Пациентам, находящимся на диализе, после каждого сеанса необходимо вводить повторную дозу, равную исходной.
При лечении пожилых пациентов цефалоспоринами необходимо контролировать функцию почек, вычисляя скорость клубочковой фильтрации, для предупреждения осложнений со стороны ЦНС (энцефалопатия, полинейропатия).
Макролиды
Для клинической практики максимальный интерес представляет активность макролидов в отношении грамположительных кокков и внутриклеточных возбудителей (кампилобактерий, микоплазм, легионелл, хламидий). Группа макролидов считается наименее токсичными антибиотиками.
Механизм антибактериального действия макролидов связан с нарушением синтеза белка рибосомами микробной клетки, в результате чего формируется выраженный бактериостатический эффект. В высоких концентрациях макролиды способны оказывать и бактерицидное действие в отношении бета-гамолитического стрептококка группы А, пневмококка, возбудителей коклюша и дифтерии. Макролиды обладают умеренной противовоспалительной и иммуномодулирующей активностью.
Рокситромицин, кларитромицин, азитромицин, джозамицин оказывают выраженный бактериостатический (при больших концентрациях и бактерицидный) эффект на Streptococcus spp., Staphylococcus spp., Bacillus anthracis, Corynebacterium diphtheriae, Haemophilus influenza, Shigella spp. Bordetella pertussis, Legionella spp., Chlamydia trachomatis, Mycoplasma spp., Ureaplasma urealyticum, Treponema pallidum, Borrelia burgdorferi.
Рокситромицин — внутрь, 300 мг/сут в 1–2 приема. Длительность курса зависит от показаний к применению, тяжести инфекционного процесса и активности возбудителя (от 5–12 дней). При нарушении функции печени и почек может потребоваться снижение дозы. При тяжелой печеночной недостаточности — 150 мг 1 раз в сутки.
Кларитромицин — внутрь. Режим дозирования и продолжительность курса лечения определяются индивидуально с учетом показаний, тяжести течения инфекции, чувствительности возбудителя. По 250–500 мг 2 раза в сутки; курс лечения — 6–14 дней. У больных с почечной недостаточностью (при СКФ менее 30 мл/мин или концентрации сывороточного креатинина более 3,3 мг/100 мл) дозу следует снижать в 2 раза. Максимальная длительность лечения у пациентов этой группы — не более 14 дней.
Азитромицин — внутрь (за 1 ч до или через 2 ч после еды), принимают 1 раз в сутки 1 г однократно.
Сульфаниламиды
Сульфаниламидные препараты — группа химиотерапевтических средств широкого противомикробного спектра действия. Сульфаниламидные препараты — производные амида сульфаниловой кислоты. В основе механизма антибактериального действия сульфаниламидных препаратов лежит блокада синтеза фолиевой кислоты в бактериях с последующим нарушением образования нуклеотидов, подавлением жизнедеятельности и размножения микроорганизмов.
Бисептол (Ко-тримоксазол) — комбинированный противомикробный препарат широкого спектра действия, в состав которого входят: сульфаниламид — сульфаметоксазол и производное диаминопиримидина — триметоприм.
Блокируя разные этапы биосинтеза фолиевой кислоты в микробной клетке, оба компонента препарата — триметоприм и сульфаметоксазол — не просто потенцируют бактериостатические эффекты друг друга, а приводят к появлению бактерицидного действия Бисептола.
Бисептол активен в отношении многих грамположительных и грамотрицательных микроорганизмов, являющихся основными этиологическими агентами при инфекциях мочевой системы: Staphylococcus spp., Streptococcus spp., Listeria monocytogenes, Neisseria gonorrhoeae, E. coli, Shigella spp., Salmonella spp., Yersinia spp., Klebsiella spp., а также против простейших Toxoplasma gondii, Pneumocystis carinii.
Применение рекомендуемых доз и продолжительность курса терапии Ко-тримоксазола (Бисептола) редко сопровождается серьезными осложнениями. Все же, в связи с биотрансформацией сульфаметоксазола в печени и последующей элиминацией через почки, возможно образование в ренальных канальцах кристаллов его ацетилированных метаболитов, которые нарушают функционирование тубулярных отделов нефрона и, в тяжелых случаях, могут привести к развитию интерстициального нефрита. Обильное щелочное питье предупреждает данные осложнения. При терапии Бисептолом должно обязательно контролироваться количество потребляемой жидкости. У пациентов с нарушениями функции почек, при которых клиренс эндогенного креатинина снижается до 30 мл/мин и ниже, должна использоваться половина возрастной нормы.
При тяжелом течении инфекций — по 480 мг 3 раза в сутки, при хронических инфекциях поддерживающая доза — 480 мг 2 раза в сутки. Минимальная длительность лечения — 4 дня; после исчезновения симптомов терапию продолжают в течение 2 дней. При хронических инфекциях курс лечения более длительный. Для профилактики рецидивов хронических ИМП — 480 мг 1 раз в сутки на ночь. Продолжительность лечения — 3–12 мес. При почечной недостаточности доза зависит от величины СКФ: при СКФ свыше 25 мл/мин — стандартная доза; при 15–25 мл/мин — стандартная доза в течение 3 дней, затем половину стандартной дозы. При СКФ менее 15 мл/мин назначают половину стандартной дозы только на фоне гемодиализа.
Нитрофураны
В течение многих лет препаратами выбора при микробно-воспалительных заболеваниях почек в амбулаторных условиях являются нитрофурановые препараты. Они эффективны в отношении грамположительных и грамотрицательных микробов. По данным АРМИДа, нитрофурантоин обладает высокой активностью в отношении E. coli (резистентность — 2,1%). Медленное развитие резистентности к нитрофуранам микробной флоры, малая токсичность сделали их незаменимыми для инфекции мочевой системы. Вследствие низких концентраций в паренхиме почек, нитрофурантоин используется только при остром цистите или вторичном пиелонефрите на фоне аномалий развития мочевой системы для предупреждения реинфицирования. Нитрофураны являются ингибиторами биосинтеза нуклеиновых кислот, акцепторами кислорода.
Нитрофурантоин (Фурадонин) ингибирует синтез ДНК и РНК, протеинов, препятствует нормальному образованию цитомембран, тормозит анаэробный метаболизм.
Фуразидин (Фурагин) обладает бактериостатическим действием, блокирует ферментные системы микроорганизмов.
В Институте органического синтеза АН Латвии на основе калиевой соли фуразидина в сочетании с магния карбонатом в соотношении 1:1 была разработана оптимизированная лекарственная форма Фурагина для перорального применения под торговым названием «Фурамаг». Магния карбонат препятствует превращению калиевой соли фуразидина в кислой среде желудка в фуразидин и обеспечивают в тонкой кишке более полное всасывание препарата в виде хорошо растворимой калиевой соли. Резистентность микроорганизмов к Фурамагу развивается крайне медленно, а бактериостатический эффект в 2 раза выше, чем у растворимого Фурагина. Фурамаг, в отличие от других антимикробных средств, не угнетает, а наоборот, стимулирует иммунную систему организма за счет активации системы комплемента и фагоцитарной активности лейкоцитов. Фурамаг обладает широким спектром действия, активен по отношению к грамотрицательной и грамположительной флоре, воздействует на стафилококки, Enterobacter aerogenes, Citrobacter spp., Proteus mirabilis, а наибольшую активность проявляет против E. coli. В отличие от других нитрофуранов, Фурамаг малотоксичен, даже аллергические реакции в виде кожной сыпи отмечаются крайне редко. Препарат рекомендуется принимать после еды, запивая большим количеством жидкости. При длительном использовании Фурамага желательно назначать витамины группы В. Назначается препарат в следующих дозах: для лиц пожилого возраста (старше 65 лет) по 0,05 г 3 раза в день курсом от 7 до 14 дней.
Учитывая изменение нормальных анатомо-физиологических особенностей органов малого таза, несостоятельность эпителия мочевыводящих путей, уменьшение образования слизи, ослабление местного иммунитета, увеличение загрязнения в области уретры, антибактериальную терапию у пожилых людей необходимо назначать, консультируясь с врачом-гинекологом или урологом.
При выборе оптимального антибактериального средства у больных пожилого возраста в первую очередь следует учитывать следующие факторы:
Длительность антимикробной терапии
Длительность антимикробной терапии инфекций мочевой системы должна быть оптимальной, до полного подавления активности возбудителя. Многочисленными исследованиями доказано, что длительность антимикробной терапии у лиц старше 65 лет с ИМП не должна быть меньше 7 дней. Оптимальная продолжительность начального курса лечения ИМП, если не исключен пиелонефрит, составляет 10–14 дней. Наличие аномалий развития органов мочевой системы, пузырно-мочеточниковый рефлюкс, уретроцеле и др. определяют более длительные сроки непрерывной антибактериальной терапии (до 4 недель и более). Короткий курс лечения показан пациентам, имеющим локальную симптоматику ИМП.
Эффективность антибактериальной терапии
Признаками эффективности антибактериальной терапии у пожилых пациентов с ИМП в активной фазе являются следующие:
При отсутствии клинического улучшения в течение 48 часов от начала лечения рекомендуется:
Антибактериальную терапию необходимо проводить в комбинации с препаратами, усиливающими местный иммунитет (Полиоксидоний, Виферон). Отличительной особенностью этих препаратов служит способность их воздействовать на иммунную систему в зависимости от ее состояния у конкретного пациента, т.?е. повышение исходно сниженных или понижение исходно повышенных показателей, что делает возможным назначение препарата без предварительного иммунологического исследования. Применение Полиоксидония в комплексной терапии позволяет повысить эффективность и сократить продолжительность лечения, значительно уменьшить использование антибиотиков, глюкокортикостероидов, удлинить срок ремиссии. Использовать Виферон и Полиоксидоний рекомендуется в виде суппозиторий.
Во время лечения необходимо проводить следующие исследования:
Фитотерапия при инфекциях мочевых путей
Пролит
Пролит — это комплекс из лекарственных трав, обладающих высокой биологической активностью по отношению к мочевыводящей системе человека.
Лекарственные травы, входящие в состав Пролита:
Пролит рекомендован в качестве БАД к пище — как источник органических кислот, дубильных веществ, калия. Способствует улучшению функционального состояния мочевыводящей системы и положительно влияет на состояние обмена веществ у людей, страдающих мочекаменной болезнью.
Препарат Пролит имеет две формы выпуска. Пролит пилюли № 100 удобен для подбора меньшей дозировки препарата, рекомендован на начальных этапах терапии МКБ, для профилактики, при назначении пожилым пациентам. Пролит Супер капсулы № 60 — это улучшенная формула препарата, в составе которой использованы более концентрированные экстракты лекарственных трав.
Бруснивер
Применяют при лечении острых и хронических заболеваний мочеполовой области и кишечника.
Бруснивер комбинированное средство растительного происхождения, обладающее антимикробной активностью.
В состав растительного сбора входят: брусники листья, зверобоя трава, череды трехраздельной трава, шиповника плоды.
Способ применения и дозы:
Внутрь или местно, в виде свежеприготовленного отвара или настоя. Отвар: один брикет (8 г) заливают 500 мл кипящей воды, настаивают в течение 1 ч и кипятят под крышкой на слабом огне в течение 15 мин, охлаждают при комнатной температуре в течение 45 мин. Настой: один брикет заливают в термосе 500 мл кипящей воды и настаивают не менее 2 ч. Полученное этими способами водное извлечение процеживают и применяют в теплом неразбавленном (внутрь, микроклизмы) или разбавленном в 2 раза (орошения, спринцевания, ванночки, примочки) виде. Внутрь назначают в дозах 1/4–1/3 стакана 3–4 раза в сутки. Наружно применяют в теплом виде. При этом для орошений, спринцеваний, ванночек отвар или настой разбавляют в 2–4 раза, для микроклизм используют по 25–50 мл неразбавленного теплого отвара (настоя).
ЦистоТранзит
ЦистоТранзит концентрат напитка — для очищения и улучшения функционального состояния почек и мочевыводящих путей.
ЦистоТранзит содержит биологически активные вещества, которые:
Растительные компоненты БАД «ЦистоТранзит», очищая почки, улучшают их состояние, что способствует более эффективной работе почек.
В состав Цистотранзита входят: трава хвоща полевого, трава золотарника канадского, трава горца птичьего, цветки ромашки, плоды клюквы.
Богатые кремнием соединения хвоща в организме образуют защитные коллоиды, препятствующие кристаллизации минеральных компонентов и затрудняющие образование мочевых камней.
Трава золотарника канадского (золотая розга) способствует растворению камней в почках и мочевом пузыре.
Благодаря растворимым соединениям кремниевой кислоты трава горца птичьего (спорыша) препятствует образованию мочевых камней. Спорыш способствует отхождению конкрементов из почек и мочевого пузыря.
Действие ромашки обусловлено комплексом веществ, содержащихся в цветочных корзинках. Полифенольное соединение ромашки, а также кумарины оказывают умеренное спазмолитическое действие.
Клюква сохраняет питательные и витаминные свойства благодаря содержанию в ягодах бензойной кислоты, обладающей противомикробными свойствами. Пектиновые вещества клюквы легко образуют нерастворимые соединения — хелаты — с тяжелыми и радиоактивными металлами, способствуя их детоксикации и выведению из организма.
Способ применения и дозы:
1 чайную ложку (5 мл) концентрата напитка растворить в 1 стакане (250 мл) воды, принимать взрослым 4 стакана в день. Допускается дневную дозу концентрата напитка — 4 чайные ложки (20 мл) — растворить в 1 литре воды и принимать в течение дня. Продолжительность приема — 20 дней. Рекомендуется повторять прием 4 раза в год (каждый сезон).
В. В. Смирнов, доктор медицинских наук, профессор
И. С. Мавричева, кандидат медицинских наук
А. Е. Гаврилова
_575.gif)
_575.gif)