что больше атом или ядро атома
Основы строения атома. Просто о сложном
Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Естественно, уважаемый читатель понимает, что в данной статье мы стараемся изложить все на максимально простом и интересном уровне, поэтому не «грузим» научными терминами. Тем, кто хочет изучить вопрос на более профессиональном уровне, советуем читать специализированную литературу. Тем не менее, сведения данной статьи могут сослужить хорошую службу в учебе и просто сделать Вас более эрудированными.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
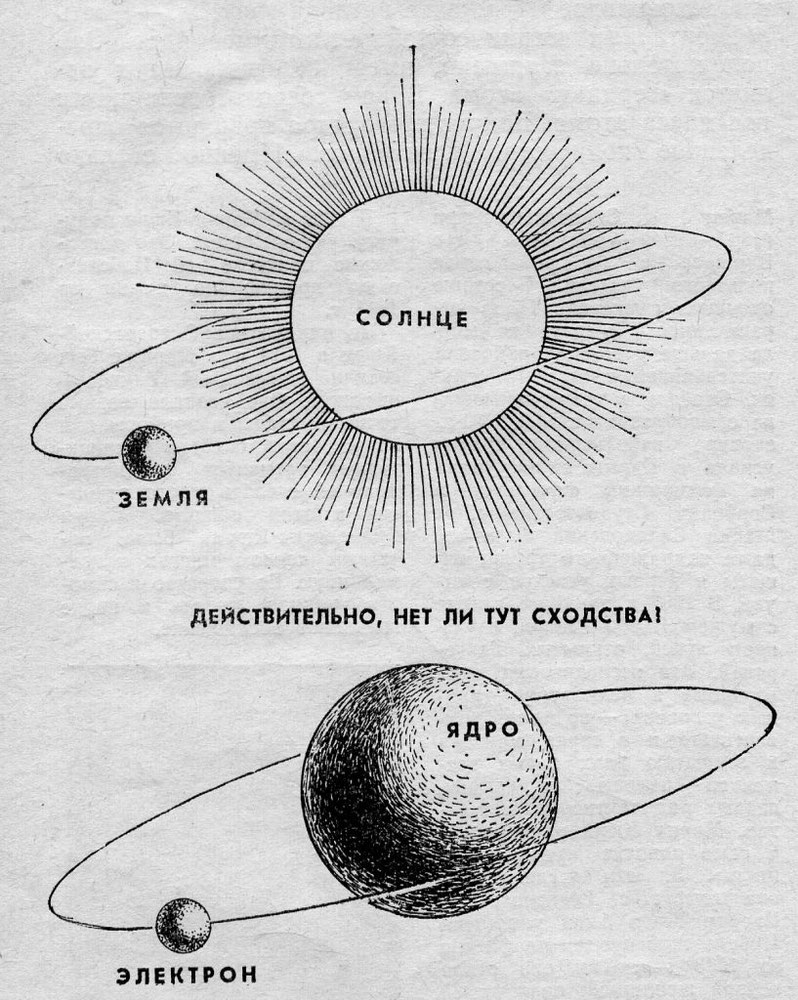
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
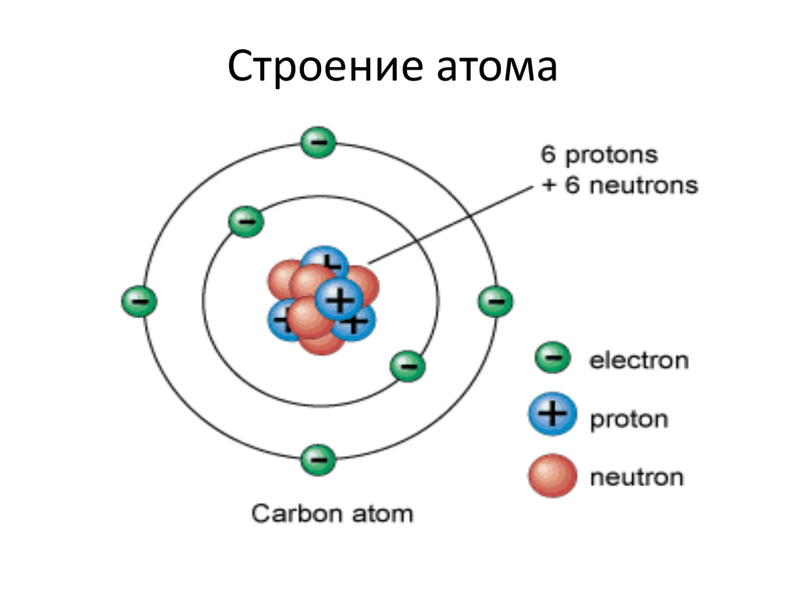
Ниже приведем элементарную схему строения атома углерода.
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие «моль». 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?

Откуда взялись атомы?
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.

Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Именно благодаря сильному взаимодействию, которое проявляется в масштабах атомных ядер и отвечает за притяжение между нуклонами, атом и является таким «крепким орешком».
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.

Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Строение атома
История открытия. Демокрит. Начала атомистики
Уже в древности философы задумывались, из чего же состоит природа вокруг них. Демокрит первым из античных ученых предположил, что все в мире состоит из крошечных неделимых частиц. Эту частицу он назвал атом, что в переводе с греческого означает «неделимый».
К сожалению, возможности ученых в те времена были весьма ограничены. Каких-либо приборов, позволяющих исследовать строение вещества, у них не было. Но значение Демокрита в зарождении атомистики невозможно сбросить со счетов истории.
Атомно-молекулярное учение. Строение атома
Практически до середины XVIII века, пока М.В. Ломоносов не принес в химию количественные эксперименты, учение об атомах оставалось лишь прерогативой философских размышлений. Михаил Васильевич считал, что лишь знание физических законов поможет правильно истолковать результаты химических опытов.
В своих исследованиях ученый выделил в веществе крупные частицы — «корпускулы», и мелкие — «элементы», или как мы называем их сейчас — атомы.
Ломоносов считал, что каждая молекула по своему составу идентична всему веществу, а также, что различные по химическому строению элементы имеют и разные по составу молекулы. Ученый предполагал, что вещества имеют особенности не только из-за отличий в составе молекул, но и благодаря различному расположению атомов в молекуле.
Следующий шаг в изучении атомов сделал английский естествоиспытатель Джон Дальтон. Проводя различные эксперименты с растворением газов в жидкостях, ученый открыл главное физическое качество атомов: эти мельчайшие частицы имеют вес. Но поскольку атом до сих пор никто не видел, Дальтон назвал вес частицы относительным. Он установил, что самым легким элементом является водород и предложил его вес принять за единицу.
Открытие Дальтона стало прорывом в химии. Ведь теперь к любому химическому соединению можно было подойти с измерительным прибором. Это исследование позволило приблизиться к современной записи химических формул и уравнений. И именно Дальтон придумал первые обозначения для известных химических элементов.
До конца XIX века, несмотря на все старания ученых, химическое строение атома по-прежнему оставалось лишь гипотезой.Ученым не хватало оборудования, чтобы постичь тайну мельчайшей частицы.
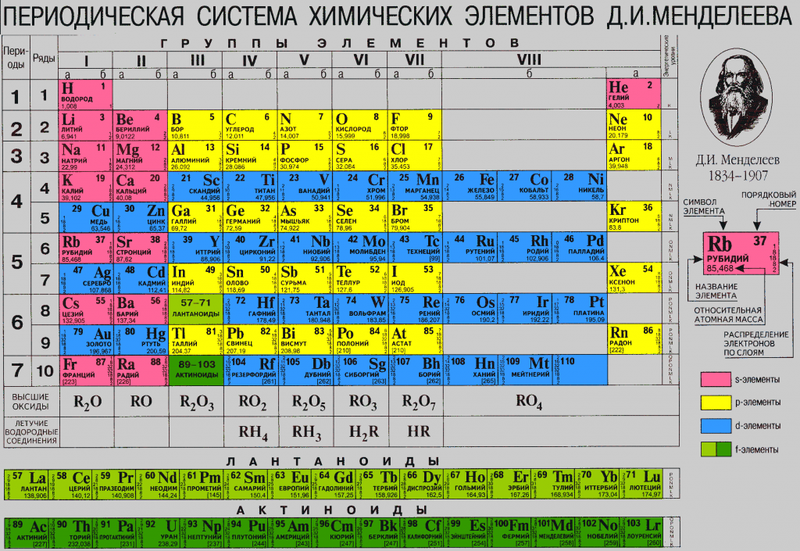
Открытие Дальтона дало толчок дальнейшим опытам, в ходе которых ученые вычислили относительную атомную массу разнообразных химических элементов, что позволило их классифицировать, а Д.И.Менделееву – сформулировать периодический закон и представить научному миру Периодическую систему химических элементов.
Протоны и нейтроны
Обнаружение катодных лучей немецким ученым-физиком Юлиусом Плюккером в 1859 году и создание прототипа электронной трубки Ульямом Круксом в 1879 году положили новый виток исследованиям в атомистике.
Однако потребовалось еще несколько десятков лет, чтобы строение атомов химических элементов приоткрыло свои тайны. на заре XX века в одном журнале появились две публикации, которые пытались объяснить структуру атома. Одна из публикаций принадлежала английскому ученому Д.Д. Томсону, автором другой был японский физик Хантаро Нагаока.
При создании своей атомной структуры Нагаока использовал разработанную Максвеллом в 1856 году теорию устойчивости колец Сатурна. Японский ученый был убежден, что опираясь на «сатурнианскую» модель ядра в будущих исследованиях, можно прояснить все основные свойства материи.
Исследователь ошибся, однако два постулата его теории впоследствии подтвердились:
Томсон выдвинул гипотезу о том, что атом напоминает шарообразную, электронейтральную сферу диаметром около 10 –10 м, где положительный заряд равномерно распределен по всей структуре атома, а электроны хаотично расположены в этом поле. Поэтому, можно сказать, что атом напоминает микроскопическую булочку с изюмом.
Опыты продолжались в разных странах. В лаборатории Резерфорда проходили испытания, которые смогли доказать, что в центре атома расположено крупное ядро с диаметром около —10 —15 м, в котором содержится более 99,95 % его массы, а заряд его положительный.
В 1932 году и Джеймс Чедвик обнаружил нейтрон — третий недостающий элемент атома.
Атомное взаимодействие обеспечивает тесную связь протонам и нейтронам в ядре атома. Протоны и нейтроны имеют общее название — нуклоны. Ученые считают, что их характеристики достаточно подобны, чтобы отнести эти частицы к одному семейству, как биологи относят в один вид собак и волков.
Казалось бы, вот оно – тайна ядра разгадана. Но нет, в современной физике считается, что нуклоны состоят из еще более мелких частиц, которые называют кварками, и кварковая модель является ведущей в современной науке.
Эксперименты по исследованию атома и его ядра не прекращаются, и в 2010 году международная группа физиков при исследовании протонов в мюонном водороде установила, что размер радиуса протона меньше на 4%, чем считалось до этого.
Так в фундаментальную физику ворвалась загадка протонного радиуса, почему измерение одной и той же величины в обычном и в мюонном водороде дает разные результаты — и, несмотря на усилия сотен специалистов, она до сих пор не решена.
Изотопы
Работая в лаборатории Резерфорда, Фредерик Содди экспериментально установил, что встречаются атомы одного химического элемента с различной атомной массой. А поскольку к этому времени уже было известно, что количество протонов для ядра постоянно, соответственно, отличались они количеством нейтронов.
Содди предложил термин изотоп (от греческих слов изос — «равный» и топос — «место») для обозначения веществ, идентичных по химическим свойствам, но отличающихся атомной массой и определенными физическими свойствами.
При графической записи изотоп выглядит как знак химического элемента, которому он соответствует. А что бы обозначить разницу, в массовом числе используют индекс слева вверху: ( 12 C, 222 Rn)
Протий, дейтерий, и тритий — исторические собственные названия изотопов водорода.
Электронное строение атома
Исследование таинственного микромира продолжается. Изучение движения электронов и внутриатомных взаимодействий выделилось в отдельную область физики — квантовую механику. Главный постулат квантовой механики — все волны обладают свойствами частиц, а микрочастицы имеют волновую природу.
В макромире физическое тело всегда находится в какой-то конкретной точке пространства. Даже если вы сфотографируете летящую муху и на фотографии она будет в виде черной полосы, вы все равно будете уверены, что в конкретный момент времени она была в определенном месте.
В мире атома все иначе. Легкий подвижный электрон находится одновременно во всех точках околоядерного пространства. Если провести аналогию с макромиром, больше всего это напомнит неплотный клубок мягкой пушистой шерсти.
И именно эта зона пространства, где существует вероятность встретить электрон, называется электронным облаком. Плотность электронного облака неравномерна.
В электронном облаке выделяют зону, где вероятность встречи с электроном более 90% — эта область обозначена как атомная или электронная орбиталь.
Все электроны в атоме обладают определенной энергией. Чтобы описать состояние электрона, ученые используют квантовые числа. Всего их четыре. Целое число n, которое определяет энергию электронов на конкретном энергетическом уровне, называют главным квантовым числом.
На одной электронной оболочке находятся атомные орбитали с единым значением главного квантового числа n.
У невозбужденного атома электроны расположены на орбиталях 4-х видов: s, p, d и f.
Но почему нельзя было обозначить буквами по алфавиту a, b, c? Все не так просто, для обозначения атомных орбиталей ученые решили использовать начальные буквы от прилагательных, описывающих спектральные линии в атомных спектрах:
Чтобы графически представить расположение электронов на уровнях и подуровнях атомной оболочки, ученые ввели электронные формулы. Это такие численно-буквенные комбинации, где подуровень обозначен строчной латинской литерой, а цифровой индекс вверху справа обозначает количество электронов на подуровне.
Несмотря на свои способности быть одновременно в любой точке пространства, электроны при заполнении орбиталей соблюдают определенный порядок:
У этого правила есть еще одно мнемоническое название — правило троллейбуса. Расположение электронов напоминает рассадку в общественном транспорте. Если есть свободные места и человек входит один, он сядет на свободное сиденье, и только если нет свободных сидений, подсядет к кому-то на свободное место.
Итак, подведем выводы, на которые ученым понадобилось более сотни лет опытов, исследований, научных дискуссий и даже трагедий.
Чтобы проверить насколько хорошо усвоен материал, предлагаем вашему вниманию тест на тему «Строение атома» для 8-11 классов:
Ядра атомов: в самом сердце материи

Рис. 1
Ядро атома получается крохотным, его радиус в 10 000–100 000 раз меньше всего атома. Каждое ядро содержит определённое количество протонов (обозначим его Z) и определённое количество нейтронов (обозначим его N), скреплённых вместе в виде шарика, по размеру не сильно превышающего сумму их размеров. Отметим, что протоны и нейтроны вместе часто называют «нуклонами», а Z+N часто называют A – общее количество нуклонов в ядре. Также Z, «атомное число» – количество электронов в атоме.
Типичное мультяшное изображение атома (рис. 1) чрезвычайно преувеличивает размер ядра, но более-менее правильно представляет ядро как небрежно соединённое скопление протонов и нейтронов.
Содержимое ядра
Откуда нам известно, что находится в ядре? Эти крохотные объекты просто охарактеризовать (и это было просто исторически) благодаря трём фактам природы.
1. Протон и нейтрон отличаются по массе всего лишь на тысячную часть, так что если нам не нужна чрезвычайная точность, можно сказать, что у всех нуклонов масса одинакова, и назвать её массой нуклона, mнуклон:
(≈ означает «примерно равно»)
2. Количество энергии, необходимой для удержания вместе протонов и нейтронов в ядре, относительно мало – порядка тысячной доли части энергии массы (E = mc 2 ) протонов и нейтронов, так что масса ядра почти равна сумме масс его нуклонов:
3. Масса электрона равняется 1/1835 массы протона – так что почти вся масса атома содержится в его ядре:
Тут подразумевается наличие четвёртого важного факта: все атомы определённого изотопа определённого элемента одинаковы, как и все их электроны, протоны и нейтроны.
Поскольку в самом распространённом изотопе водорода содержится один электрон и один протон:
масса атома Mатом определённого изотопа просто равна Z+N, помноженному на массу атома водорода
и погрешность этих уравнений примерно равна 0,1%.
Поскольку нейтроны электрически нейтральны, электрический заряд Qядро ядра просто равен количеству протонов, помноженному на электрический заряд протона («e»):
В отличие от предыдущих уравнений, это уравнение выполняется точно.
Эти уравнения проиллюстрированы на рис. 2

Рис. 2
Используя открытия последних десятилетий XIX века и первых десятилетий XX, физики знали, как измерить в эксперименте оба обозначенных красным значения: заряд ядра в e, и массу любого атома в атомах водорода. Так что эти значения были известны уже в 1910-х. Однако правильно интерпретировать их смогли только в 1932 году, когда Джеймс Чедвик определил, что нейтрон (идею которого предложил Эрнест Резерфорд в 1920-м) является отдельной частицей. Но как только стало понятно, что нейтроны существуют, и что их масса практически равна массе протона, сразу же стало ясно, как интерпретировать числа Z и N — количество протонов и нейтронов. А также сразу родилась новая загадка – почему у протонов и нейтронов почти одинаковая масса.
Честно говоря, физикам того времени с научной точки зрения страшно повезло, что всё это было так легко установить. Закономерности масс и зарядов настолько просты, что даже самые долгие загадки были раскрыты сразу после открытия нейтрона. Если бы хотя бы один из перечисленных мною фактов природы оказался неверным, тогда на то, чтобы понять, что происходит внутри атомов и их ядер, ушло бы гораздо больше времени.

Рис. 3
Откуда нам известно, что ядро атома маленькое?
Одно дело – убедить себя, что определённое ядро определённого изотопа содержит Z протонов и N нейтронов; другое – убедить себя, что ядра атомов крохотные, и что протоны с нейтронами, будучи сжатыми вместе, не размазываются в кашу и не разбалтываются в месиво, а сохраняют свою структуру, как подсказывает нам мультяшное изображение. Как это можно подтвердить?
Я уже упоминал, что атомы практически пусты. Это легко проверить. Представьте себе алюминиевую фольгу; сквозь неё ничего не видно. Поскольку она непрозрачная, вы можете решить, что атомы алюминия:
1. Настолько крупные, что между ними нет просветов,
2. Настолько плотные и твёрдые, что свет сквозь них не проходит.
Насчёт первого пункта вы будете правы; в твёрдом веществе между двумя атомами почти нет свободного пространства. Это можно наблюдать на изображениях атомов, полученных при помощи особых микроскопов; атомы похожи на маленькие сферы (краями которых служат края электронных облаков), и они довольно плотно упакованы. Но со вторым пунктом вы ошибётесь.

Рис. 4
Если бы атомы были непроницаемыми, тогда сквозь алюминиевую фольгу ничто не смогло бы пройти – ни фотоны видимого света, ни рентгеновские фотоны, ни электроны, ни протоны, ни атомные ядра. Всё, что вы направили бы в сторону фольги, либо застревало бы в ней, либо отскакивало бы – точно так же, как любой кинутый объект должен отскочить или застрять в гипсокартонной стенке (рис. 3). Но на самом деле электроны высокой энергии легко могут пройти через кусочек алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра, и так далее. Электроны и другие частицы – почти все, если точнее – могут пройти через материал, не потеряв ни энергии, ни импульса в столкновениях с чем-либо, содержащимся внутри атомов. Лишь малая часть их ударится об атомное ядро или электрон, и в этом случае они могут потерять большую часть своей начальной энергии движения. Но большая часть электронов, протонов, нейтронов, рентгеновских лучей и всякого такого просто спокойно пройдут насквозь (рис. 4). Это не похоже на швыряние гальки в стену; это похоже на швыряние гальки в сетчатый забор (рис. 5).

Рис. 5
Чем толще фольга – к примеру, если складывать всё больше и больше листов фольги вместе – тем вероятнее частицы, запущенные в неё, столкнуться с чем-либо, потеряют энергию, отскочат, изменят направление движения или даже остановятся. То же было бы верно, если бы вы наслаивали одну за другой проволочные сетки (рис. 6). И, как вы понимаете, из того, насколько далеко средняя галька может проникнуть сквозь слои сетки и насколько велики разрывы в сетке, учёные могут подсчитать на основании пройденной электронами или атомными ядрами дистанции, насколько атом пустой.

Рис. 6
Посредством таких экспериментов физики начала XX века установили, что внутри атома ничто – ни атомное ядро, ни электроны – не может быть большим, чем одна тысячная миллионных миллионных долей метра, то есть в 100 000 раз меньше самого атома. То, что такого размера достигает ядро, а электроны по меньшей мере в 1000 раз меньше, мы устанавливаем в других экспериментах – например, в рассеянии высокоэнергетических электронов друг с друга, или с позитронов.
Чтобы быть ещё более точным, следует упомянуть, что некоторые частицы потеряют часть энергии в процессе ионизации, в котором электрические силы, действующие между летящей частицей и электроном, могут вырвать электрон из атома. Это дальнодействующий эффект, и столкновением на самом деле не является. Итоговая потеря энергии значительна для летящих электронов, но не для летящего ядра.
Вы можете задуматься над тем, похоже ли то, как частицы проходят сквозь фольгу, на то, как пуля проходить сквозь бумагу – расталкивая части бумаги в стороны. Возможно, первые несколько частиц просто расталкивают атомы в стороны, оставляя большие отверстия, через которые проходят последующие? Мы знаем, что это не так, поскольку мы можем провести эксперимент, в котором частицы проходят внутрь и наружу контейнера, сделанного из металла или стекла, внутри которого вакуум. Если бы частица, проходя через стенки контейнера, создавала отверстия по размеру превышающие атомы, тогда внутрь устремились бы молекулы воздуха, и вакуум бы исчез. Но в таких экспериментах вакуум остаётся!
Также довольно легко определить, что ядро – это не особенно структурированная кучка, внутри которой нуклоны сохраняют свою структуру. Об этом уже можно догадаться по тому факту, что масса ядра очень близка к сумме масс содержащихся в нём протонов и нейтронов. Это выполняется и для атомов, и для молекул – их массы почти равны сумме масс их содержимого, кроме небольшой коррекции на связывающую энергию – и это отражено в том факте, что молекулы довольно легко разбить на атомы (к примеру, нагрев их так, чтобы они сильнее сталкивались друг с другом), и выбить электроны из атомов (опять-таки, при помощи нагрева). Сходным образом относительно легко разбить ядра на части, и этот процесс будет называться расщеплением, или собрать ядро из более мелких ядер и нуклонов, и этот процесс будет называться синтезом. К примеру, относительно медленно двигающиеся протоны или небольшие ядра, сталкивающиеся с более крупным ядром, могут разбить его на части; нет необходимости, чтобы сталкивающиеся частицы двигались со скоростью света.

Рис. 7
Но чтобы понять, что это не является неизбежным, упомяну, что этими свойствами не обладают сами протоны и нейтроны. Масса протона не равняется примерной сумме масс содержащихся в нём объектов; протон нельзя разбить на части; а для того, чтобы протон продемонстрировал что-нибудь интересное, необходимы энергии, сравнимые с энергией массы самого протона. Молекулы, атомы и ядра относительно просты; протоны и нейтроны чрезвычайно сложны.