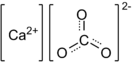
cas номер карбонат кальция
Кальций углекислый
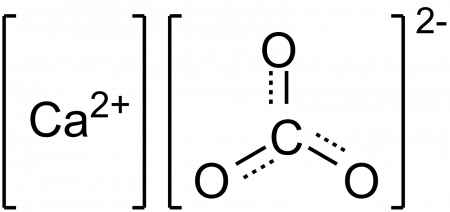
Химическая формула: CaCO3
Международное название: CALCIUM CARBONATE
Квалификация: Имп. ГОСТ 4530-76
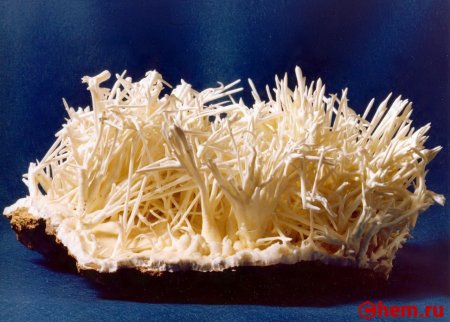
Внешний вид: порошок белого цвета
Фасовка: мешки, 25 кг
Условия хранения: в сухом, хорошо проветриваемом помещении
Синонимы: Кальций карбонат, Кальциевая соль угольной кислоты, Кальцит
Мы предлагаем Кальций углекислый или кальций карбонат по выгодным ценам с доставкой по всей России.
| Спецификация | |
|---|---|
| Молекулярный вес | 100.09 |
| Плотность | 2,71-2,93 г/см3. |
| Температура плавления | 825°C |
| Растворимость в воде | нерастворимо |
| Нерастворимый в кислоте остаток, менее 0,2 % | |
| Содержание хлоридов, менее | 0,033 % |
| Содержание cульфатов, менее | 0,25 % |
| Содержание As, менее | 0,0001 % |
| Содержание бария (Ba), менее | 0,0001 % |
| Содержание железа (Fe), менее | 0,01 % |
| Содержание F, менее | 0,005 % |
| Содержание Hg, менее | 0,00005 % |
| Содержание Pb, менее | 0,0003 % |
| Содержание тяжелых металлов, менее | 0,002 % |
Для согласования условий оплаты, звоните нашим менеджерам по телефонам в Москве:
(495) 787-01-37, 36, 38
(495) 787-43-51
и Санкт- Петербурге
(812) 309-38-06 (многоканальный)
Кальций углекислый или кальций карбонат — белый кристаллический порошок, растворим в кислотах, очень мало растворим в воде. Вода, насыщенная CO2, растворяет значительно лучше (0,156% при 0 °С) вследствие образования бикарбоната. Кальций углекислый, кальций карбонат — соль угольной кислоты. В природе встречается в виде минералов кальцита, арагонита и ватерита. Карбонат кальция является главной составной частью известняка, мела и мрамора.
Получение
Кальций углекислый можно получить действием углекислого аммония на азотнокислый кальций:
Ca(NO3)2 + (NH4)2CO3 = CaCO3в + 2NH4NO3
Для получения CaCO3 квалификации «для люминофоров» (не содержащего примеси тяжелых металлов) к растворам Ca(NO3)2·4H2O (ч. д. а.) и (NH4)2CO3 (ч.) приливают по несколько капель раствора (NH4)2S и смеси оставляют на 1-2 суток до полного осаждения сульфидов.
Применение
Кальций углекислый (карбонат кальция) применяется
• в лакокрасочной промышленности, в производстве красок и отделочных материалов;
• в стекольной промышленности при изготовлении стекла.
• в строительстве,
• в сельском хозяйстве, как известковое удобрение и для комплексного агрохимического окультуривания полей,
• в качестве наполнителя для резиновых смесей, бумаги, линолеума,
• в производстве зубного порошка, косметических средств
• в пищевой промышленности, часто как вещество, препятствующее слеживанию продукции и др.
Кальций углекислый зарегистрирован как пищевая добавка Е170.
Всегда в наличии по выгодным ценам
Для получения подробной информации о ценах на химреактивы
и согласования условий оплаты звоните по телефонам:
в Москве:
+7 (495) 787-01-37
+7 (495) 787-43-51
в Санкт- Петербурге:
+7 (812) 309-38-06
Карбонат кальция
| Карбонат кальция | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификация | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Название ИЮПАК | Карбонат кальция белый Meudon C.I. 77220 CI Пигмент Белый 18 Осажденный карбонат извести Карбонат кальция ( Са С O 3 ) состоит из ионов карбоната (СО 3 2- ) ионов и кальция (Са 2+ ). Это белое вещество имеет молярную массу 100,1 г / моль. CO 2 (газ) + H 2 O ⇋ H 2 CO 3 (растворимый) CaCO 3 (нерастворимый) + H 2 CO 3 (растворим) ⇋ Ca (HCO 3) 2 (растворимый) Таким образом, присутствие диоксида углерода в воде вызывает растворение карбонатов; но количество растворенного карбоната зависит от растворения углекислого газа и, следовательно, от его равновесия с атмосферой. И наоборот, высвобождение диоксида углерода (вызванное изменениями температуры или давления или присутствием микроводорослей) обращает реакцию вспять и осаждает карбонаты. РезюмеХимия естественного состоянияБиохимия секреции раковины моллюсками и формирования скелета у животных еще полностью не изучена. Но, вероятно, первостепенную роль играет содержание растворенных газов. А на Марсе?Другая номенклатураКарбонат кальция
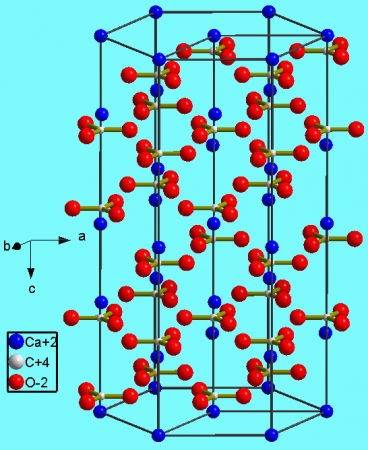
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц. Нерастворим в воде и этаноле. Зарегистрирован как белый пищевой краситель (E170). СодержаниеПрименениеИспользуется как белый пищевой краситель E170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве. Массовое производство/использованиеОчищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя. Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна. Применяется при производстве предметов гигиены (например, зубной пасты), в медицине. В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей. Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок. В строительствеСтроительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков. Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви. Карбонат кальция широко применяется для раскисления кислых почв. Нахождение в природеКарбонат кальция находится в минералах в виде полиморфов: Тригональная кристаллическая структура кальцита является наиболее распространенной. Минералы карбоната кальция находятся в следующих горных породах: ГеологияЗалежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах. В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит). Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями. Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах. Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов. Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках. Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями. ПолучениеПодавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора. В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция: Химические свойстваПри нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO: Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2: Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры. При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ: Карбонат КальцияХимическое названиеХимические свойстваКальция Карбонат, что это такое? Это неорганическое хим. соединение, соль, образованная Ca и угольной кислотой. Химическая формула Карбоната Кальция: CaCO3. В природе вещество можно обнаружить в кальците, ватерите, арагоните, мраморе, известняке, обычном меле, яичной скорлупе. Это достаточно распространенный минерал, в соответствии с химической формулой имеет три полиморфные модификации. По внешнему виду – белые кристаллы без запаха или мелкий порошок. Вещество не растворяется в воде, спирте, растворимо в разбавленной азотной и соляной кислоте (при этом выделяется углекислый газ). Согласно Википедии, молярная масса вещества = 100,1 грамм на моль. Углекислый кальций изготавливают из минералов, в основном мрамора. В лабораторных условиях соединение можно получить с помощью реакции кальцинации оксида Ca, в итоге образуется гидроксид Ca, через который проводят СО2 и осаждается карбонат. Для химических свойств характерна реакция разложения Карбоната Кальция, при которой под действием высокой температуры, вещ-во расщепляется на негашеную известь и углекислый газ. Также для химического соединения характерна реакция с водой и СО2, с образованием гидрокарбоната Ca. Фармакологическое действиеПротивоязвенное, восполняющее дефицит кальция, антацидное. Фармакодинамика и фармакокинетикаПри попадании средства в пищеварительный тракт происходит нейтрализация соляной кислоты, снижается кислотность желудочного сока в целом. Эффект от применения Карбоната Кальция наступает достаточно быстро, однако при прекращении действия может возникнуть обратное действие, секреция желудочного сока усиливается. Вещество нормализует уровень электролитов, угнетает активность остеокластов, замедляет процессы разрушения костной ткани. Показания к применениюУглекислый кальций назначают: ПротивопоказанияПобочные действияКарбонат Кальция может спровоцировать развитие аллергических реакций, диспепсии (газообразование, боли, диарея, запор), вторичного усиления желудочной секреции, гиперкальциемии, алкалоза. Карбонат Кальция, инструкция по применению (Способ и дозировка)Индивидуальный режим дозирования. В качестве антацида углекислый кальций назначают в дозировке от 500 мг до 1 грамма. При профилактике остеопороза применяют до 1,2 грамм в сутки. Для детей дозировку корректируют. Назначают 300-600 мг вещества в день. ПередозировкаПри передозировке может возникнуть гиперкациемия (прием более 2 грамм в сутки). Симптомы: общая слабость, головные боли, анорексия, отсутствие аппетита, рвота, запоры, чувство жажды, вялость, полиурия, болезненные ощущения в суставах и мышцах, сбои сердечного ритма, заболевания почек. Показано промыть желудок, дать пострадавшему энтеросорбенты, проводить симптоматическое лечение. ВзаимодействиеСочетанный прием средства с тетрациклиновыми антибиотиками может привести к снижению их эффективности и плазменной концентрации. При сочетании препарата с тиазидными диуретиками выше риск развития метаболического алкалоза и гиперкальциемии. Карбонат Кальция замедляет процессы абсорбции других лекарств. При сочетании средства с левотироксином, оно снижает эффект от приема анаболика. Особые указанияПри продолжительном лечении средством рекомендуют контролировать плазменную концентрацию кальция. При приеме больших доз препарата и больших количеств молочной продукции может развиться гиперкальциемия и молочно-щелочной синдром. Нельзя применять лекарство в таблетированной форме для лечения рахита, кариеса и остеопороза в качестве антацида. ДетямДля детей нужно скорректировать дозировку. При беременности и лактацииВещество часто назначают беременным женщинам и кормящим мамам. Препараты, в которых содержится (Аналоги)Торговые названия средства: Кальция карбонат, Витакальцин, Аддитива кальций, Скоралайт, УПСАВИТ Кальций. В комбинации с магния карбонатом: Тамс, Ренни, Рамни, Эндрюс антацид. В сочетании с колекальциферолом средство входит в состав следующих лекарств: Идеос, Ревиталь Кальций Д3, Кальций-Д3 Никомед, Натекаль Д3, Компливит кальций Д3. С магния гидроксидом: Гастрик, Витрум Маг. Комплексные средства: Альфадол-Са, Витрум Бьюти Люкс, Витрум Остеомаг, Гевискон, Кальцемин и так далее. ОтзывыВещество часто назначают для лечения дефицита кальция детям и взрослым пациентам, это хорошее средство от изжоги. Лекарство хорошо переносится, его добавляют в состав различных препаратов, разной ценовой категории. Пациенты отмечают высокую эффективность и отсутствие побочных реакции при использовании любых препаратов на его основе. Цена Карбоната Кальция, где купитьКупить Кальция Карбонат пищевой на развес можно по цене 250 рублей за кг. Стоимость таблеток Ренни составляет порядка 150 рублей за 12 таблеток. Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе. Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах. Карбонат кальция
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||