буккальный эпителий для чего берут у людей
Что такое набор для теста ДНК?
Любой тест ДНК начинается с взятия биоматериала, из которого будет извлечена для исследования молекула дезоксирибонуклеиновой кислоты. В настоящее время стандартным биологическим материалом для ДНК-анализа является буккальный эпителий с внутренней стороны щеки. Его берут из ротовой полости аппликатором с ватным наконечником. Процедура совершенно безболезненна и занимает всего несколько секунд. Сдать такой биоматериал можно не только в лаборатории или специально оборудованном пункте сбора, но и даже в домашних условиях.
Чтобы взять образец своего буккального эпителия для анализа не выходя из дома, вам понадобится набор для сбора ДНК. Получить его можно, оформив заявку на прохождение генетического теста в любой из компаний, занимающихся расшифровкой генома.
Обычно набор для ДНК-теста включает в себя:
Как правильно взять образец ДНК в домашних условиях?
Самое главное, что нужно для анализа ДНК, это чистый, не содержащий сторонних загрязнений биоматериал. Поэтому перед сбором буккального эпителия необходимо в течение двух часов воздержаться от приема пищи, не пить никаких напитков (кроме чистой воды), не чистить зубы зубной пастой и не курить. Непосредственно перед забором биоматериала тщательно вымойте руки с мылом и три раза прополощите рот теплой водой. Далее:
Чего нельзя делать при заборе буккального эпителия для ДНК-теста
Чтобы получить качественный биоматериал, необходимо соблюдать следующие требования:
Помните о том, что от качества биологического материала напрямую зависят результаты исследований. Будьте внимательны и точно следуйте инструкции.
Заполните заявку на анализ ДНК на нашем сайте, и мы вышлем вам набор для сбора биоматериала в кратчайшие сроки.
ВС РФ: взятие буккального эпителия для генетических исследований уже само по себе требует наличия медлицензии по генетике
 |
| dusanpetkovic / Depositphotos.com |
Штраф в 40 000 рублей заплатил медцентр, который, – сам не имея лицензии на осуществление первичной специализированной медико-санитарной помощи в амбулаторных условиях по генетике – отбирал у пациентов образцы буккального эпителия и направлял их в генетическую лабораторию (третье лицо, у которого имеется соответствующая лицензия). Наказание было наложено судом по ч. 2 ст. 14.1 КоАП (Осуществление предпринимательской деятельности без лицензии) (Определение Верховного Суда РФ от 11 декабря 2019 г. № 308-ЭС19-22433 «Об отказе в передаче жалобы в Судебную коллегию Верховного Суда Российской Федерации»).
Медицинский центр был с этим категорически не согласен:
Однако, вышестоящие инстанции тоже нашли в деятельности центра состав правонарушения:
Верховный Суд РФ полностью согласился с этим, заодно не согласившись с медцентром в вопросе исчисления срока давности привлечения к ответственности.
Дело в том, что Росздравнадзор составил протокол по ч. 2 ст.14.1 КоАП РФ в начале ноября, без проведения проверки, на основе жалобы от пациентки. Однако пациентка жаловалась на забор буккального эпителия еще летом. А это значит, что на момент наложения штрафа трехмесячный срок давности привлечения истек, – по мнению оштрафованного медцентра.
На это ВС РФ отметил, что – исходя из установленных обстоятельств, – на момент составления протокола, то есть в начале ноября, медцентр продолжал собирать буккальный эпителий, то есть осуществлять подлежащую лицензированию деятельность. А значит, и срок давности нужно исчислять от дня составления протокола, а не от дня забора спорных образцов эпителия.
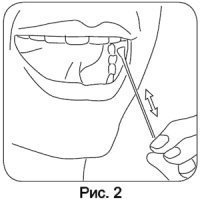
Инструкция по взятию буккального эпителия для самостоятельного отбора образцов
1. Прополоскать рот водой.
2. Для сбора клеток буккального эпителия взять ватную палочку. На протяжении всей процедуры держать палочку только за пластиковый стержень! При контакте ватной части палочки с чем-либо, кроме полости рта, ее следует выбросить (например, при падении палочки, при касании ватной части пальцами) и взять другую палочку. Если палочка имеет две ватные части, одну отрезать и выбросить.
3. Широко открыть рот, ввести палочку в ротовую полость, и аккуратно потереть ватной частью палочки с внутренней стороны щеки, по деснам, под языком 10-20 раз, при этом медленно поворачивая её.
4. Повторить то же самое на другой щеке.
5. Аккуратно, держась за пластиковый стержень, подсушить ватную палочку на воздухе в течение 1-2 мин и затем поместить её в бумажный конверт.
6. Повторить то же самое со второй палочкой и поместить её в ТОТ ЖЕ конверт. От каждого лица предоставить не менее 2-х палочек.
7. При заклеивании конверта не использовать слюну!
8. При взятии образцов от нескольких лиц помещать ватные палочки в отдельные конверты для каждого лица.
Республика Беларусь, г. Минск, 220114, Филимонова 53, 5 этаж
© 2001 — 2020 «Эмбрио», ОДО Беливпул. Все права защищены. Использование материалов и фотографий с сайта возможно только с разрешения правообладателя.
Услуги искусственного оплодотворения, лечения мужского и женского бесплодия, эндоскопической хирургии, гинекологии и планирования репродукции семьи.
Идея, дизайн и разработка сайта ActiveMedia
Буккальный эпителий для чего берут у людей









Процедура забора биологического материала (буккального эпителия)
Если забор образцов буккального эпителия происходит самостоятельно, то необходимо выполнить следующее:
Купить гигиенические ватные палочки обычные.
Приготовить бумажные конверты для каждого, 1 конверт для каждого участвующего в заборе человека, подписать конверты заранее – ребёнок, отец. Не нужно бояться, что конверт пропитается собранным биологическим материалом, ДНК останется на ватной палочке в любом случае.
Перед взятием образца, человек, участвующий в заборе образца, должен обязательно прополоскать свою ротовую полость кипячёной, чистой водой.
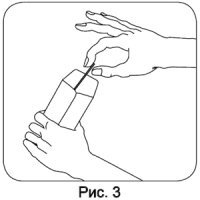
Держа палочку в руке, поместите конец палочки с буккальным эпителием в приготовленный, подписанный бумажный конверт и разрежьте палочку так ножницами, чтобы основная часть палочки с биологическим материалом оставалась в конверте. Это необходимо, чтобы эксперт не занимался исследованием стороны палочки без материала. Отрезанную половину палочки выбросьте.
Необходимо взять по два образца с каждого человека и передать экспертам палочки с образцами буккального эпителия. Хранить и перевозить образцы в бумажных конвертах можно при комнатной температуре.
Образцы от разных людей не должны быть в одном конверте, это необходимо для исключения взаимного переноса биологического материала на соседние палочки другого человека.
Взятие и отправка образцов
 |  |  |
При предоставлении биологического материала, полученного самостоятельно, в Заявлении на проведение генетического исследования будет указано, что «биологический материал предоставлен клиентом» во избежание подмены образцов со стороны заказчика, предоставленных на исследование.
Буккальный эпителий для чего берут у людей
М.А. Абаджиди, Т.В. Махрова, И.В. Маянская, М.И. Заславская, Ю.Ю. Строгова, А.Н. Маянский
Нижегородская государственная медицинская академия;
Научно-исследовательский институт детской гастроэнтерологии, Нижний Новгород
Буккальные эпителиоциты как инструмент клинико-лабораторных исследований
Последние годы ознаменовались значительным повышением интереса к «нетрадиционным функциям» мукозального эпителия (эпителия слизистых оболочек). Это связано с признанием его координирующей позиции в реакциях, стыкующих механизмы врожденного (неспецифического) и специфического иммунитета, в инициации и стабилизации воспалительных процессов, занимающих центральное место в патологии респираторного, интестинального и урогенитального тракта [1—8]. Оказалось, что мукозальные эпителиоциты обладают значительным эффекторным потенциалом в реакциях воспаления и иммунитета, реализуя его в ответ на стимулирующие воздействия экзогенной (микроорганизмы, аллергены, поллютанты) и эндогенной (цитокины и др.) природы [5, 6, 9—13]. Мукозальные эпителиоциты конститутивно экспрессируют, а при активации усиливают секрецию цитокинов (провоспалительных цитокинов, хемокинов, ростовых и гемопоэтических факторов), эйкозаноидов (аутокоидов), оксида азота, эндотелинов и других пептидных медиаторов, дифенсинов, ингибиторов провоспалительных агентов, цитокиновых рецепторов, молекул главного комплекса гистосовместимости и межклеточных взаимодействий [4, 5, 7, 10, 12, 14—17]. Благодаря этому мукозальные эпителиоциты обретают способность вступать в кооперацию с «профессиональными» индукторами и эффекторами воспаления и иммунитета, такими как нейтрофилы, эозинофилы, тучные клетки, дендритные клетки, макрофаги, Т– и В-лимфоциты. Это превращает их в активных участников каскадных и сетевых взаимодействий, определяющих развитие и регуляцию воспалительных и иммунных процессов. Не случайно о мукозальных эпителиоцитах все чаще говорят как о «воспалительных клетках»[5], а патологию, сопряженную с воспалением слизистых оболочек, называют «болезнями эпителиоцитов». Именно такая метафора использована в одном из недавних обзоров, посвященных участию эпителиальных клеток респираторного тракта в патогенезе бронхиальной астмы [4]. Это связано с тем, что, находясь под прицелом экзогенных и эндогенных стимулов, мукозальные эпителиоциты способны менять свой функциональный статус, включаясь в формирование порочных кругов, поддерживающих хроническую патологию в системе слизистых оболочек.
Принципиальным в этой связи явилось открытие флогогенных и иммуномодулирующих эффектов микроорганизмов, опосредованных через активацию мукозальных эпителиоцитов. Используя адгезивные контакты, инвазируя эпителиальные клетки или атакуя их субъединичными продуктами, мукозальные патогены и просто комменсалы (бактерии, вирусы и другие микроорганизмы) вызывают секрецию цитокинов и других медиаторов, инициирующих воспалительную реакцию, которая может обретать патологические формы острого и хронического процесса [ 1—3, 7, 9].
Являясь частью мукозальной системы, буккальный эпителий сохраняет элементы ее активной позиции во взаимоотношениях со стимулами, исходящими из внешней и внутренней среды. Это позволяет использовать его для изучения физиологии и реактивности слизистых оболочек, в том числе в качестве индикатора местных и общих нарушений гомеостаза.
Как и другие эпителиоциты, буккальные клетки способны продуцировать ряд цитокинов и хемокинов (ИЛ-6, ИЛ-8, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), ИЛ-18 и гамма-интерферон), простагландины (ПГ) — Е2 и лейкотриены (ЛТ) — В4, экспрессировать антигенпредставляющие (HLA-1, HLA-2), коадгезивные (CD54) и костимулирующие (CD40) молекулы [18—25]. Их образование зависит от функционального состояния клеток, меняясь под влиянием различных воздействий. В опытах W. Mannhardt с соавт. [20] буккальные эпителиоциты демонстрировали усиление секреции ПГ Е2 и повышение уровня внутриклеточного кальция при сокультивировании с живыми (но не убитыми) штаммами E. coli; эффект усиливался форболмиристатацетатом. По мнению авторов, такие реакции могут иметь значение для реализации антимикробного потенциала в системе местного иммунитета. Допускают, что мобилизация ПГ Е2 и Са2+ способна индуцировать секрецию антимикробных пептидов (дифенсинов), которые вызывают гибель бактерий при инкубации с мукозальными эпителиоцитами in vitro. Наличие в буккальных эпителиоцитах катионных пептидов со свойствами дифенсинов документировано прямыми гистохимическими и функциональными анализами [14, 26]. S. Ellmerich с соавт. [19] наблюдали синтез ИЛ-8 (одного из самых мощных хемоаттрактантов для нейтрофилов) при адгезии на буккальных эпителиоцитах человека Streptococcus bovis; такой же эффект получен при воздействии антигенов, экстрагированных из клеточной стенки S. bovis.
Буккальные эпителиоциты чувствительны к действию интерферонов. Это наблюдается в реакциях с нормальными клетками (взятыми для опыта ex tempоrе), а также в экспериментах на линиях клеток, полученных из буккальных карцином или трансформированных SV-вирусом [18, 23]. По данным Y.K. Smith с соавт. [21], буккальные эпителиоциты конститутивно экспрессируют гены для ИЛ-8 и ГМ-КСФ; инкубация с альфа-интерфероном сопровождалась повышением уровня РНК-транскриптов для ИЛ-8 и ГМ-КСФ. В более поздней работе [22] эти авторы обнаружили, что инкубация буккальных эпителиоцитов с альфа– и бета-интерферонами сопровождается усилением экспрессии гена для ISG-15. Это белок с мол. массой 15 кДа, потенцирующий образование гамма-интерферона, пролиферацию и цитотоксичность естественных киллеров. Аналогичный эффект получен in vivo, при ополаскивании ротовой полости альфа-интерфероном. По мнению авторов, иммуномодулирующие эффекты орального применения интерферона частично связаны с гиперпродукцией ISG-15 буккальными клетками, предрасполагающей к повышению реактивности мукозальных лимфоцитов. В опытах с линиями трансформированных клеток и клеток буккальной карциномы I. Farmer с соавт. [23] отметили потенцирующее действие гамма-интерферона на экспрессию молекул MHC(HLA)-II, CD40 и CD54; эффект ИЛ-4 был ограничен гиперэкспрессией CD40. Об усилении экспрессии МНС-II (HLA-DR) на буккальных эпителиоцитах под влиянием альфа-интерферона сообщили J.K. Smith с соавт. [21]. Полагают, что эффект мог быть опосредован через гамма-интерферон, секретируемый мукозальными лимфоцитами и/или макрофагами, «загрязняющими» препараты буккальных клеток. Впрочем, гамма-интерферон способны секретировать и сами эпителиоциты. M. Rouabhia с соавт. [25] наблюдали это в опытах с буккальными клетками, зараженными C. albicans. Секреции гамма-интерферона (она наблюдалась в ранней фазе инфекции) способствовало появление активной формы ИЛ-18 (18 кДа), индуктора гамма-интерферона. Его мРНК и белок-предшественник (24 кДа) конститутивно экспрессируются оральными эпителиоцитами, но активная форма образуется лишь при адекватной стимуляции и ассоциирована с ИЛ-1b-конвертирующей протеазой. Стимуляция липополисахаридом была достаточной для активации ИЛ-18, но не вызывала продукции гамма-интерферона.
Подобно другим эпителиоцитам, функциональный статус буккальных клеток зависит от степени их зрелости. В составе многослойного пласта клетки буккального эпителия находятся на разных стадиях морфофункциональной дифференцировки – от малодифференцированных предшественников в базальном слое (они обеспечивают регенерацию эпителия) до высокоспециализированных клеток, которые по мере дифференцировки смещаются в поверхностные слои, подвергаясь десквамации [14]. Часть из них несут признаки более или менее выраженного ороговения (наличие кератина) [27]. Дифференцировочные и пролиферативные процессы, а также функциональные параметры зрелых клеток регулируются факторами местного и центрального происхождения. Отсюда не удивительно, что состояние клеток орального (в частности, буккального) эпителия отражает характер дестабилизационных процессов на местном [28, 29] и системном (дистантном) уровнях [14, 30].
Изменения дифференцировки эпителия, регистрируемые морфологически (размер клеток, характер ядер и гранул, признаки цитолиза) и электрокинетически (электроподвижность ядер), предложено учитывать при скрининговой оценки состояния здоровья, стрессирующих воздействий, вредных факторов внешней среды, соматической патологии, биологического возраста человека [30—32].
Буккальные эпителиоциты могут быть индикатором нарушений орального, в том числе саливарного гомеостаза. Их рецепторный аппарат подвергается воздействию протеолитических и гликозидазных ферментов секрета ротовой полости, влияющих на поверхностные структуры эпителиальных клеток. Содержание таких ферментов подвержено колебаниям, заметно повышаясь во время тяжелых (критических) заболеваний. Это ведет к изменениям эпителиоцитов, которые отражаются на качественных и количественных показателях микробиоценоза слизистой оболочки. Результатом может быть ослабление колонизационной резистентности к условно-патогенным микроорганизмам, создающее угрозу инфекционных осложнений. K.D. Weinmeister и A.R. Dal Nogare [33] обнаружили снижение сиаловой кислоты и галактозы (но не маннозы и фукозы) на буккальных (но не трахеальных) клетках у реанимационных больных. M.O. Quinn с соавт. [ 34] изучали экзогликозидазную активность (маннозидаза, фукозидаза, гексозаминидаза и сиалидаза) слюны и трахеального секрета у больных с критическими состояниями. По сравнению с контролем (здоровые люди) содержание всех ферментов было повышено. Сиалидаза слюны содействовала адгезии грамотрицательных бактерий на буккальных эпителиоцитах, что рассматривается как индикатор вероятных инфекционных осложнений в респираторном тракте. В работе D.E. Woods с соавт. [35] аналогичный вывод сделан при изучении протеолитической активности слюны. Исходя из представлений об участии фибронектина в колонизационной резистентности слизистых оболочек против грамотрицательных бактерий, исследовали количество фибронектина на поверхности буккальных эпителиоцитов у больных с острым респираторным дистресс-синдромом и коронарным шунтированием. Обнаружено снижение фибронектина на клетках буккального эпителия, которое было кратковременным (первые три дня послеоперационного периода) или перманентным (критические больные). Снижение уровня клеточносвязанного фибронектина коррелировало с повышением протеолитической активности секрета ротовой полости.
Изменение дифференцировки буккальных эпителиоцитов наблюдается при воспалительных заболеваниях ротовой полости, в частности при различных вариантах пародонтита [28]. G. Davis и R.G. Gibbons [36] отметили значительное снижение остатков сиаловой кислоты на поверхности буккальных клеток у больных гингивитом. Реактивность буккальных эпителиоцитов (клетки буккальной карциномы) предложено использовать для изучения агрессивности стоматологических материалов. В опытах G. Schmalz с соавт. [18] инкубация буккальных клеток с хлоридами никеля, кобальта и палладия, а также триэтиленгликолдиметакрилатом сопровождалась многократным усилением секреции ПГ Е2, ИД-6 и ИЛ-8; наиболее информативной была индукция ИЛ-6. Образование цитокинов стимулировали нетоксичные или низкотоксичные дозировки препаратов; повышение секреции ПГ Е2 коррелировало с цитотоксическим эффектом.
Функциональная характеристика эпителиоцитов включает и такой важный показатель, как способность к адгезивным взаимодействиям с микроорганизмами. От этого зависит не только характер микробной колонизации эпителия и состояние местного иммунитета [28], но и гомеостаз всего клеточного сообщества, ассоциированного со слизистыми оболочками [7]. В облигатной микрофлоре буккальных клеток доминируют стрептококки, прежде всего S. oralis и S. sangius [37]. Их количество является максимальным у детей до 10 лет [38] и рассматривается как один из индикаторов неспецифической резистентности слизистой оболочки полости рта [28] и «общего здоровья» [39]. Присутствие (а тем более преобладание) менее типичных и нетипичных для данного биотопа микроорганизмов отражает ослабление колонизационной резистентности, сигнализируя о дестабилизационных процессах, сфокусированных на уровне слизистых оболочек. Чаще всего об этом судили по адгезивным реакциям с C. albicans. Усиление адгезивных свойств буккальных клеток отмечено у лиц, инфицированных вирусом иммунодефицита человека [40], больных сахарным диабетом [14], на фоне системного введения кортикостероидов (опыты на крысах) [41] и химиорадиотерапии злокачественных опухолей [42]. Влияние гормонального фона на адгезивность буккального эпителия отмечено у женщин во время менструального цикла: наиболее активное прикрепление кандидозных клеток к эпителиоцитам наблюдалось в фолликулярную фазу цикла [43, 44]. Это (как и действие кортикостероидов) может быть связано с усилением кератинизации (ороговения) клеток под влиянием эстрогенных гормонов. По данным D.W.Williams с соавт. [27], именно кератинизированные буккальные клетки обладают максимальной способностью адгезировать C. albicans. Впрочем, усиление кератинизации — не единственное изменение буккального эпителия во время гормональных перестроек, и механизмы его функциональных модификаций могут быть сложнее [45].
Противоположное явление (ослабление адгезии C. albicans на буккальных клетках) наблюдалось на фоне длительного приема аскорбиновой кислоты [46], тотчас после рождения [47], после недельного курса лечения флюконазолом [48, 49]. В последнем случае эффект был ассоциирован с исчезновением из белкового спектра буккальных эпителиоцитов поверхностного компонента с мол. массой 35 кДа [49].
Колебания адгезивности буккальных клеток возможны и в отношении бактерий. Они могут быть результатом изменений рецепторов клеток в ходе эпителиальной дифференцировки, конкурентных взаимодействий между микрорганизмами [50, 51], влияния продуктов секрета ротовой полости [33, 35,36]. Повышение адгезивных характеристик буккальных клеток для широкого спектра бактерий [ 52, 53] и C. albicans [27] отмечено у курильщиков.
Приведенные данные позволяют сделать следующее заключение. Обладая чувствительностью к различным экзогенным и эндогенным воздействиям, буккальные эпителиоциты подвергаются функциональным изменениям при различных нарушениях локального и системного гомеостаза. Об этом можно судить по ряду морфофункциональных, физико-химических и биохимических показателей. Функциональная перестройка буккальных эпителиоцитов проявляется и в изменении их взаимоотношений с резидентной и факультативной микрофлорой. Это позволяет (подобно дисбактериозу кишечника и других экологических ниш) обозначить и проблему дисбактериоза буккального эпителия. С точки зрения микробиоценозов, ротовая полость разделена на несколько экологических ниш, и буккальные клетки являются одной из них, не менее дискретной, чем,например, эпителиоциты зева, дисбактериоз которого предложено вывести в самостоятельную клинико-микробиологическую категорию [54]. Клиническая информативность «буккального дисбактериоза» отмечена в ряде собственных исследований и в работах, проведенных по нашей инициативе [55—60]. Нами предложено два показателя — естественная колонизация буккальных эпителиоцитов и степень их адгезивности для C. albicans. Индекс естественной колонизации оказался полезным и универсальным индикатором в педиатрической практике, позволяющим судить об активности и прогнозе различных заболеваний, в том числе аллергической и инфекционной природы. Резистентность буккальных клеток к Candida albicans меняется более избирательно. Мы, в частности, отметили усиление адгезивных реакций у детей с бронхиальной астмой, но не при хронической интестинальной патологии [61]. Эти наблюдения свидетельствуют о реактивности эпителия слизистых оболочек в общей системе гомеостаза, что позволяет использовать наиболее доступные из его элементов (в частности, буккальные эпителиоциты) в клинико-лабораторной практике.



