бронходилатирующее действие что это значит
Бронхолитические препараты в терапии болезней органов дыхания
В структуре болезней органов дыхания хроническая обструктивная болезнь легких (ХОБЛ) и бронхиальная астма (БА) являются ведущими причинами заболеваемости и смертности. Патофизиологическую основу обеих нозологических форм составляет бронхиальная обструк
В структуре болезней органов дыхания хроническая обструктивная болезнь легких (ХОБЛ) и бронхиальная астма (БА) являются ведущими причинами заболеваемости и смертности.
Патофизиологическую основу обеих нозологических форм составляет бронхиальная обструкция, для купирования или коррекции которой требуется назначение бронхолитической терапии. Это положение закреплено в международных и национальных руководствах по диагностике и лечению БА и ХОБЛ [1–6].
Необходимо отметить, что БА и ХОБЛ представляют собой два самостоятельных заболевания, которые имеют различные этиологию, патогенез, прогноз, а также требуют разных подходов к лечению. Так, в частности, вентиляционные нарушения при БА характеризуются обратимой бронхиальной обструкцией и бронхиальной гиперреактивностью, что обусловливает целесообразность применения бронхолитиков, использующихся при этом заболевании. Напротив, бронхиальная обструкция при ХОБЛ неуклонно прогрессирует и обратима лишь частично. Последнее обстоятельство аргументирует целесообразность клинического применения бронхолитиков и при этом заболевании.
Естественно, что указанные различия между БА и ХОБЛ требуют дифференцированного подхода как к выбору конкретных бронхолитиков, так и к тактике их назначения. Так, если больным ХОБЛ бронхолитики назначаются преимущественно на постоянной основе, то пациентам с БА — чаще «по требованию» и/или в сочетании с базисной противовоспалительной терапией (глюкокортикостероидами или кромонами).
Современные бронхолитические препараты можно разделить на три группы, перечисленные ниже в том порядке, в котором они внедрялись в клиническую практику.
Антихолинергические препараты. На протяжении многих тысячелетий при необходимости лечения болезней органов дыхания применялись средства народной медицины. Упоминания об использовании растений семейства пасленовых были найдены еще в древнеегипетских папирусах. Гиппократ рекомендовал людям с болезнями легких применение курений и дымов порошков, приготовленных из высушенных корней и листьев белладонны (Atropa belladonna), дурмана (Datura stramonium), белены (Hyoscyamus niger). Недавними исследованиями было установлено, что эффект от курения антиастматических сигарет, содержащих листья Datura stramonium, сопоставим с таковым при применении современных бронхолитических средств [7].
К началу XIX в. уже было известно антихолинергическое действие алкалоидов белладонны, несколько позже ученые установили роль парасимпатической нервной системы в развитии бронхоспазма, а с середины 19-го столетия холиноблокаторы — атропин и синтезированный вскоре платифиллин — становятся «золотым стандартом» в лечении БА. Широкое использование холинолитиков по этому показанию продолжалось до 70-х гг. XX в. Лишь с появлением мощных селективных β2-агонистов, а также метилксантинов атропин утратил свое значение в лечении больных БА. Этому в немалой степени способствовало и наличие большого количества нежелательных явлений, сопутствующих введению препарата: сухость во рту, нарушения мукоцилиарного клиренса, мидриаз и др. [8].
В 70-х гг. XX в. были выделены и классифицированы мускариновые рецепторы в дыхательных путях человека (М1-, М2-, М3-рецепторы). Установление важной роли парасимпатической нервной системы в контроле бронхиальной проходимости при БА дало толчок к дальнейшим разработкам антихолинергических лекарственных средств, что привело к созданию принципиально нового препарата — ипратропия бромида [8, 9]. Однако при проведении клинических исследований у больных БА его эффективность оказалась невелика. Напротив, препарат продемонстрировал отчетливый клинический и в ряде случаев бронхолитический эффект у больных ХОБЛ. Таким образом, удалось доказать частичную обратимость бронхиальной обструкции при ХОБЛ и впоследствии установить две ее патофизиологические составляющие — обратимую и необратимую.
Обратимый («бронхолитический») компонент бронхиальной обструкции представлен воспалительным отеком слизистой дыхательных путей, аккумуляцией клеток воспаления, слизи и плазмы в просвете бронхов, спазмом гладкой мускулатуры, которые в основном контролируются парасимпатическим отделом вегетативной нервной системы, тонус которой при ХОБЛ закономерно повышен [10].
Необратимый («эмфизематозный») компонент бронхиальной обструкции обусловлен развитием и прогрессированием эмфиземы легких и так называемой болезни мелких бронхов (снижение эластической тяги легочной ткани вследствие неравномерной преимущественно центриацинарной эмфиземы, ранний экспираторный коллапс, деформация и сужение мелких бронхов). Предполагалось, что данные структурные изменения не могут служить точкой приложения бронхолитических и/или противовоспалительных лекарственных средств. Однако в дальнейшем удалось установить, что именно эти изменения в паренхиме легких обусловливают формирование гиперинфляции легких с развитием «воздушной ловушки», приводящей к нарушению опорожнения альвеол во время выдоха (наиболее наглядно этот патофизиологический феномен можно продемонстрировать при выполнении физических нагрузок). Именно этот механизм и объясняет развитие таких кардиальных симптомов ХОБЛ, как выраженная одышка и снижение толерантности к физической нагрузке, заметно ухудшающих качество жизни данной категории пациентов [11].
Наиболее известным и широко распространенным лекарственным средством из числа ингаляционных антихолинергических препаратов в настоящее время является ипратропия бромид. Препарат хорошо переносится, эффективен и безопасен при длительном применении, не вызывает развития тахифилаксии, лишен кардиотоксического действия. При этом важно отметить, что чувствительность М-холинорецепторов с возрастом не уменьшается. Вот почему в рекомендациях по ведению больных ХОБЛ подходы к назначению этого препарата определяют следующим образом: лечить «так долго, как долго симптомы заболевания будут продолжать причинять неудобства пациенту» [2].
Продолжительность действия ипратропия бромида — 4–6 ч, в результате чего возникает необходимость повторных ингаляций (4 раза в сутки), поэтому иногда проблематично контролировать возможные ухудшения бронхиальной проходимости в ночные или предутренние часы. Подобно атропину, ипратропия бромид не является селективным холиноблокатором и одинаково быстро блокирует все три типа мускариновых рецепторов, поэтому следует бдительно наблюдать за пациентом, так как блокада М2-рецепторов иногда может приводить к парадоксальной бронхоконстрикции [9].
Представителем новой генерации антихолинергических препаратов является тиотропия бромид, зарегистрированный в России в 2003 г. Особенности химической структуры препарата объясняют своеобразие его взаимодействия с мускариновыми рецепторами, а именно уникальную кинетическую селективность, т. е. различия в скорости блокирования, соответствующих подтипов мускариновых рецепторов, а также увеличение продолжительности действия [12, 13].
В ходе проведенных исследований, в частности, было показано, что длительная бронходилатация (
24 ч), регистрируемая после однократной ингаляции тиотропия бромида, сохраняется и при длительном его приеме (на протяжении 12 мес) [14, 15]. Уже через 30 мин после первой ингаляции увеличивались показатели объема форсированного выдоха за первую секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ), в дальнейшем не снижавшиеся в течение последующих 24 ч. Наибольший бронхолитический эффект отмечался ко второй неделе лечения тиотропия бромидом.
Продолжительная терапия тиотропия бромидом (в течение 12 мес) сопровождается оптимизацией показателей бронхиальной проходимости, регрессом респираторной симптоматики, улучшением качества жизни пациентов [16]. При этом отчетливо уменьшалась выраженность одышки. Известный пульмонолог P. Jones высоко оценил возможности симптоматического контроля с помощью ингаляций тиотропия бромида, отметив его саногенетический эффект: больные, длительно принимавшие препарат, более не испытывали одышки при физической нагрузке и передвигались в темпе, характерном для их возраста [17]. Регресс одышки объясняется уменьшением гиперинфляции легких и размера «воздушной ловушки». При этом в рамках длительного лечения больных ХОБЛ удалось продемонстрировать терапевтическое превосходство тиотропия бромида над ипратропия бромидом [18].
Важное преимущество ингаляционных антихолинергических препаратов — минимальная частота и выраженность нежелательных явлений. Самое распространенное из них — сухость во рту, как правило, не приводит к прекращению приема лекарственных средств [16, 18].
Метилксантины. В течение многих десятилетий метилксантины (теофиллин и др.) применяются при лечении больных БА, хотя механизм их действия длительное время оставался неясным. В 1859 г. появилось сообщение доктора Hyde Salter о том, что чашка крепкого кофе способна купировать приступ БА. В 1888 г. был выделен теофиллин из листьев чая. Длительное время подход к использованию теофиллина был чисто эмпирическим и только после уточнения механизма его действия в конце 1930-х гг. препарат получил широкое распространение. Бронхолитический эффект теофиллина осуществляется посредством ингибирования изоформ фосфодиэстеразы с последующим увеличением внутриклеточного содержания цАМФ и релаксацией гладких мышц дыхательных путей. Кроме того, установлены иммуномодулирующий и противовоспалительный эффекты теофиллина, что позволяет назначать данное средство в рамках монотерапии при невозможности применения ингаляционных противовоспалительных и/или бронхолитических препаратов. Кратковременный прием пролонгированных теофиллинов в течение 6–12 нед сопровождается улучшением показателей симптоматического контроля над заболеванием, увеличением ОФВ1 [19, 20].
Обсуждая возможности применения теофиллина у пациентов с бронхообструктивными заболеваниями, важно учитывать и его внелегочные эффекты: улучшение периферической вентиляции, уменьшение развития «воздушных ловушек», улучшение функции диафрагмы, особенно при гиперинфляции легкого, улучшение (восстановление) мукоцилиарного клиренса, дилатацию артерий малого круга кровообращения, снижение давления в легочной артерии и гемодинамическую «разгрузку» правых отделов сердца, повышение физической работоспособности.
В то же время известно, что метаболизм теофиллина подвержен значительным изменениям. Так, у курильщиков, лиц, страдающих хроническим алкоголизмом, больных, принимающих рифампицин или противосудорожные препараты, клиренс теофиллина ускорен, а значит, при использовании стандартного режима дозирования плазменная концентрация препарата может не достигать терапевтических показателей. Напротив, с возрастом, при наличии артериальной гипоксемии (РаО2
И. Л. Клячкина, кандидат медицинских наук, доцент
ГИУВ МО РФ, Москва
Тройная терапия двумя длительно действующими бронходилататорами и ингаляционным глюкокортикостероидом при ХОБЛ
Пациентам с тяжелым и очень тяжелым течением хронической обструктивной болезнилегких (ХОБЛ) и высоким риском обострений,не отвечающим на лечение двумя длительно действующими бронходилататорами или бронходилататором в комбинации сингаляционным глюкокортикостероидом (ИГКС), рекомендуется тройная терапия длительно действующим антихолинергическим препаратом (ДДАХ), длительно действующим b2-агонистом (ДДБА) и ИГКС. В рандомизированных клинических исследованиях тройная терапия вызывала достоверное снижение частоты средне-тяжелых и тяжелых обострений ХОБЛ, уменьшение степени бронхиальной обструкции и улучшение качества жизни по сравнению со всеми другими схемами терапии. Приведены результаты нескольких крупных контролируемых исследований (TRILOGY, TRINITY, TRIBUTE), в которых были установлены эффективность и безопасность фиксированного комбинированного препарата, содержащего экстра мелкодисперсный беклометазона дипропионат, формотерола фумарат и гликопиррония бромид у больных ХОБЛ тяжелого и очень тяжелого течения.
Хроническая обструктивная болезнь легких (ХОБЛ) остается одной из ведущих причин заболеваемости и смертности во всем мире [1], причем в ближайшие десятилетия ожидается дальнейший рост распространенности этого заболевания за счет продолжающегося воздействия факторов риска и постарения населения [2]. По данным программы Burden of Obstructive Lung Diseases (BOLD) и других крупных эпидемиологических исследований, расчетное число случаев ХОБЛ в мире в 2010 году составило 384 млн, а распространенность – 11,7% [3]. Ежегодно от ХОБЛ умирают около 3 млн человек [4], а по прогнозу ВОЗ к 2030 году этот показатель может увеличиться до 4,5 млн человек [5]. В странах Европейского Союза и США прямые затраты системы здравоохранения, связанные с ХОБЛ, достигают 39 млрд евро и 32 млрд долларов, соответственно [6,7]. Основной причиной экономического бремени ХОБЛ являются обострения заболевания, доля которых в структуре общих затрат достигает 40-75% [8,9].
Обострения ХОБЛ
Обострение ХОБЛ характеризуется острым ухудшением респираторных симптомов, которое выходит за рамки их обычных колебаний и приводит к изменению проводимой терапии [10,11]. Выделяют легкие (могут быть купированы самим пациентом с помощью короткодействующих бронходилататоров), средне-тяжелые (необходимо лечение короткодействующими бронходилататорами и антибиотиками и/или пероральными глюкокортикостероидами) и тяжелые (требуется госпитализация или обращение за неот ложной помощью) обострения. Следует отметить, что существующие критерии диагностики обострения ХОБЛ неспецифичны, поэтому некоторые авторы, помимо нарастания одышки (на 5 и более по визуальной аналоговой шкале от 0 до 10), предлагают учитывать дополнительные признаки, такие как снижение сатурации кислородом по крайней мере на 4% по сравнению с исходной, повышение числа нейтрофилов (≥9000 в мм3) или эозинофилов (≥2%) в крови и концентрации С-реактивного белка (≥3 мг/л) при отсутствии признаков пневмонии или отека легких на рентгенограммах грудной клетки [12]. Частота и тяжесть обострений увеличиваются по мере прогрессирования ХОБЛ. Например, в проспективном исследовании ECLIPSE (n=2138) по крайней мере два средне-тяжелых или тяжелых обострения в течение первого года наблюдения отмечались у 22%, 33% и 47% пациентов со 2, 3 и 4 стадиями ХОБЛ, соответственно [13]. Самым надежным предиктором обострений была их частота в анамнезе.
Результаты некоторых исследований свидетельствуют о том, что эозинофилия крови может ассоциироваться с увеличением риска обострений ХОБЛ и позволяет предсказать эффективность ингаляционных глюкокортикостероидов (ИГКС) в их профилактике. Например, в датском исследовании более чем у 7000 пациентов с ХОБЛ увеличение числа эозинофилов в крови сопровождалось почти двукратным повышением риска тяжелых обострений заболевания [14]. При анализе post hoc результатов клинических исследований было показано, что более высокое число эозинофилов в крови сочеталось с увеличением частоты обострений у больных ХОБЛ, получавших длительно действующие агонисты b2-адренорецепторов (ДДБА), а эффективность комбинированной терапии ДДБА/ИГКС была выше у пациентов с эозинофилией крови [15,16]. В то же время в когортном исследовании SPIROMICS ассоциация между эозинофилией крови и частотой или тяжестью обострений ХОБЛ отсутствовала, однако эозинофилия мокроты позволяла выделить пациентов с более тяжелым течением заболевания, частыми обострениями и более выраженной эмфиземой [17]. S. Cheng провел мета-анализ 5 исследований в целом у 12496 пациентов со средне-тяжелой и тяжелой ХОБЛ, у 60% из которых число эозинофилов в крови составляло ≥2% [18]. У пациентов с эозинофилией крови лечение ИГКС привело к снижению частоты обострений ХОБЛ на 17% (р=0,03), но ассоциировалось с двукратным увеличением риска пневмонии. В целом имеющиеся данные свидетельствуют о том, что эозинофилия крови является перспективным биомаркером у больных ХОБЛ, хотя ее роль как предиктора ответа на ИГКС необходимо подтвердить в проспективных клинических исследованиях [19].
Повторные обострения ХОБЛ приводят к ухудшению показателей функции дыхания и газообмена, более быстрому прогрессированию заболевания, снижению качества жизни больных и увеличению смертности, поэтому профилактика обострений является одной из основных целей лечения [20].
Стратегия медикаментозной терапии ХОБЛ
В настоящее время нет убедительных доказательств того, что какие-либо лекарственные средства позволяют замедлить прогрессирующее снижение объема форсированного выдоха за 1 с (ОФВ1) или снижают смертность больных ХОБЛ, однако медикаментозная терапия уменьшает симптомы заболевания, снижает частоту и тяжесть обострений, улучшает толерантность к физи чес кой нагрузке и качество жизни [10,11]. Препаратами выбора в лечении ХОБЛ остаются ингаляционные бронходилататоры, в том числе ДДБА и длительно действующие антихолинергические препараты (ДДАХ). ИГКС при ХОБЛ назначают только в дополнение к терапии длительно действующими бронхолитиками. Теофиллин и рофлумиласт, ингибирующий фосфоди эс те разу-4 и обладающий противовоспалительной активностью, применяют относительно редко (при неэффективности стандартной терапии). Эффект ДДБА продолжается в течение 12 ч (формотерол, салметерол) или 24 ч (индакатерол, олодатерол, вилантерол). ДДАХ также оказывают действие в течение около 12 ч (аклидиний) или 24 ч (гликопирроний, тиотропий, умеклидиний).
В настоящее время широко используются ком би ни рованные ингаляционные препараты, в состав которых входят ДДБА/ИГКС или ДДБА/ДДАХ (табл. 1). Разработаны также тройные комбинированные препараты, содержащие ДДБА/ДДАХ/ИГКС, в том числе беклометазона дипропионат/формотерол/гликопир роний и вилантерол/флутиказона фуроат/умеклидиний (в Российской Федерации они пока не зарегистрированы). В состав первого, как и фиксированной ком би нации беклометазона дипропионата и формотерола, входит экстра мелко дис персный беклометазона дипропионат (средний аэродинамический диаметр частиц 1,1 мкм). Основные преимущества ингаляции частиц лекарственного вещества малого размера – увеличение их отложения в легких (30-35% против 10-20% при применении стандартных ингаляторов) и уменьшение депозиции в ротоглотке. Доза экстрамелкодисперсного ИГКС в составе препарата (100 мкг) в 2,5 раза ниже стандартной дозы в неэкстрамелкодисперсных препаратах (250 мкг). Результаты ряда исследований у пациентов с бронхиальной астмой подтверждают, что применение экстрамелкодисперсных аэрозолей позволяет улучшить доставку препарата в малые дыхательные пути и повысить эффективность лечения, а также снизить суточную дозу ИГКС [21,22].
| Группы | Препараты |
|---|---|
| Короткодействующие | Сальбутамол |
| β2-агонисты | Фенотерол |
| Длительно действующие | Вилантерол |
| β2-агонисты (ДДБА) | Индакатерол |
| Салметерол | |
| Олодатерол | |
| Формотерол | |
| Короткодействующие антихолинергические препараты (КДАХ) | Ипратропий |
| Длительно действующие | Аклидиний |
| антихолинергические препараты | Гликопирроний |
| Умеклидиний | |
| Ингаляционные | Беклометазона дипропионат |
| глюкокортикостероиды (ИГКС) | Будесонид |
| Мометазон | |
| Флутиказона пропионат | |
| Флутиказона фуроат | |
| Циклесонид | |
| Фиксированные комбинации | Гликопирроний/индакатерол |
| ДДАХ/ДДБА | Тиотропий/олодатерол |
| Умеклидиний/вилантерол | |
| Аклидиния бромид/формотерол | |
| Фиксированные комбинации | Беклометазона |
| ИГКС/ДДБА | дипропионат/формотерол |
| Будесонид/формотерол | |
| Флутиказона пропионат/ | |
| салметерол | |
| Флутиказона пропионат/ вилантерол | |
| Фиксированные комбинации | Беклометазона дипропионат/ |
| ИГКС/ДДБА/ДДАХ | формотерол/гликопирроний |
| Вилантерол/флутиказона | |
| фуроат/умеклидиний | |
| Ингибиторы фосфодиэстеразы-4 | Рофлумиласт |
| Другие | Теофиллин |
Лечение стабильной ХОБЛ обычно начинают с монотерапии бронходилататором длительного действия (ДДАХ или ДДБА). В двух прямых сравнительных исследованиях ДДАХ превосходил ДДАБ по эффективности в профилактике обострений ХОБЛ [23,24], поэтому в рекомендациях GOLD 2019 года у пациентов с высоким риском обострений (группа С) предпочтение отдается препаратам первой группы [10]. При наличии выраженных симптомов и повторных обострений (по крайней мере 2 среднетяжелых обострения в течение 1 года или хотя бы 1 тяжелое обострение, потребовавшее госпитализации) (группа D) возможна стартовая комбинированная терапия ДДАХ/ДДБА [10]. У пациентов с ХОБЛ, сочетающейся с бронхиальной астмой, обоснована комбинированная терапия ДДБА/ИГКС. Доводом в пользу применения ИГКС в составе двойной терапии может также служить высокое число эозинофилов крови. При недостаточной эффективности ДДБА/ ДДАХ или ДДБА/ИГКС рекомендуется тройная терапия двумя длительно действующими бронходилататорами и ИГКС, которая может проводиться с использованием фиксированной комбинации ДДАХ/ ДДБА и отдельного ингалятора ИГКС или фиксированной комбинации ДДБА/ИГКС и отдельного ингалятора ДДАХ. Как указано выше, разработаны также фиксированные комбинация всех трех препаратов.
Эффективность и безопасность тройной комбинированной терапии у пациентов с ХОБЛ
В последние годы опубликованы результаты крупных контролируемых клинических исследований, которые подтвердили преимущества тройной комбинированной терапии экстрамелкодисперсным беклометазона дипропионатом/формотерола фумаратом/гликопиррония бро мидом (БДП/ФФ/ГБ) перед другими схемами лечения у пациентов с ХОБЛ тяжелого и очень тяжелого течения.
TRILOGY. Целью двойного слепого, рандомизированного контролируемого исследования TRILOGY было сравнение эффективности и безопасности фиксированной комбинации БДП/ФФ/ГБ и фиксированной комбинации БДП/ФФ у 1368 пациентов с ХОБЛ, у которых отмечались тяжелая бронхиальная обструкция (ОФВ1 после ингаляции бронходилататора 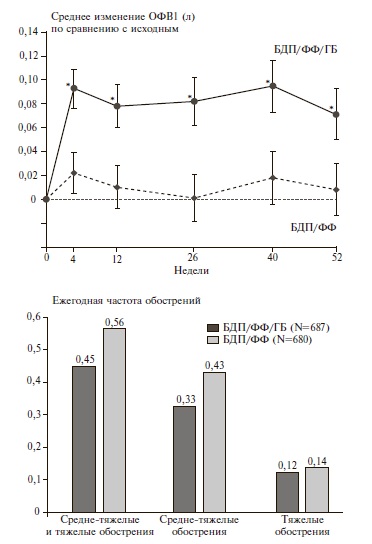
Переносимость двух схем терапии была сопоставимой, а частота пневмонии была низкой (3%) и не отличалась между двумя группами. Таким образом, у больных с ХОБЛ тяжелого или очень тяжелого течения и высоким риском обострений комбинированная терапия БДП/ФФ/ГБ достоверно превосходила терапию БДП/ФФ по бронходилатирующему действию, влиянию на качество жизни и эффективности в профилактике средне-тяжелых и тяжелых обострений и не отличалась по безопасности. Резуль таты исследования TRILOGY обосновывают присоединение ДДАХ к терапии ИГКС/ДДБА в случае недостаточной эффективности последней.
TRINITY. В двойном слепом, рандомизированном клиническом исследовании TRINITY были сопоставлены эффективность и безопасность фиксированной комбинации БДП/ФФ/ГБ, монотерапии длительно действующим ДДАХ тиотропием и комбинации БДП/ФФ с тиотропием у 2691 пациента с ХОБЛ [26]. В исследование включали пациентов с выраженными бронхиальной обструкцией (ОФВ1 после ингаляции бронходилататора 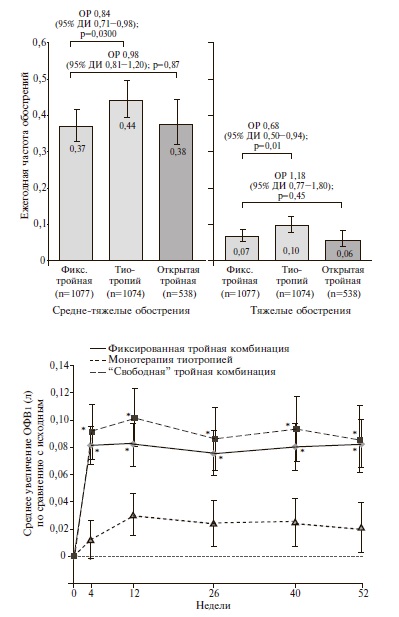
При лечении фиксированной комбинацией БДП/ ФФ/ГБ через 52 недели было выявлено достоверное увеличение ОФВ1 до ингаляции бронходилататора в среднем на 0,061 л по сравнению с монотерапией тиотропием (p 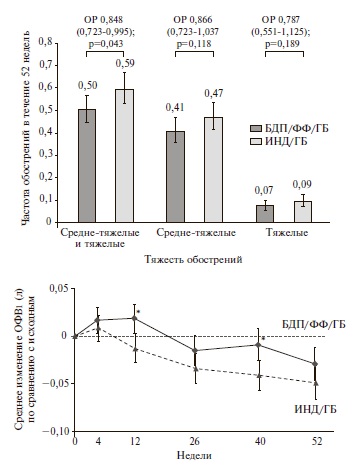
Частота нежелательных явлений (в основном легких или средне-тяжелых) была сопоставимой в трех группах. Как и в исследовании TRILOGY, пневмония на фоне тройной терапии развивалась редко (2%), а частота ее была сопоставимой с таковой в группах сравнения (1-2%).
Таким образом, результаты исследования TRINITY показали, что тройная комбинация двух бронходилататоров и ИГКС имеет достоверные преимущества перед монотерапией ДДАХ по эффективности в профилактике средне-тяжелых и тяжелых обострений ХОБЛ, бронходилатирующей активности и влиянию на качество жизни. Более значительного преимущества тройной терапии по эффективности в профилактике обострений можно ожидать у пациентов с числом эозинофилов в крови ≥2%. Кроме того, полученные данные свидетельствовали о том, что переход с монотерапии тиотропием на комбинацию трех препаратов не приводит к ухудшению безопасности лечения, в частности увеличению риска развития пневмонии.
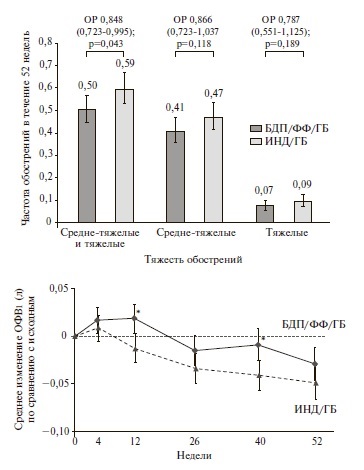
TRIBUTE. В двойном слепом, рандомизированном исследовании TRIBUTE были сопоставлены эффективность и безопасность терапии БДП/ФФ/ГБ и фиксированной двойной терапии индакатеролом (ИНД)/ГБ у 1532 пациентов с ХОБЛ тяжелого или очень тяжелого течения, перенесших по крайней мере одно среднетяжелое или тяжелое обострение в течение предыдущего года несмотря на ингаляционную терапию [27]. Комбинация ИНД/ГБ была выбрана в качестве препарата сравнения, так как в предыдущих исследованиях она по эффективности превосходила монотерапию ДДАХ или комбинированную терапию ИГКС/ДДБА [28,29]. Длительность исследования составила 52 недели. Скорректированная частота средне-тяжелых и тяжелых обострений в группах БДП/ФФ/ГБ и ИНД/ГБ равнялась 0,50 и 0,59 на пациента в год, соответственно. Снижение частоты обострений при тройной терапии составило 15% (отношение рисков 0,848, 95% ДИ 0,723–0,995; p=0,043). Тройная терапия привела к снижению частоты средне-тяжелых и тяжелых обострений на 13% и 21%, соответственно, хотя разница между группами не достигла статистической значимости (рис.3). Наиболее выраженное снижение частоты обострений (на 25%) было отмечено у пациентов с хроническим бронхитом, в то время как у пациентов с преобладающей эмфиземой или эмфиземой/бронхитом тройная терапия не имела существенных преимуществ перед ИНД/ГБ. Кроме того, лечение БДП/ФФ/ГБ вызывало достоверное снижение частоты обострений (на 19%) у пациентов с числом эозинофилов в крови ≥2%.
В обеих группах после недели 12 было отмечено снижение ОФВ1, однако негативная динамика этого показателя была менее выраженной на фоне тройной терапии. Кроме того, терапия БДП/ФФ/ГБ привела к достоверному улучшению среднего индекса SGRQ при всех визитах, хотя доля пациентов, у которых отмечалось клинически значимое улучшение качества жизни, достоверно не отличалась между двумя группами.
Частота нежелательных явлений, которые в основном были легкими или средне-тяжелыми, оказалась сопоставимой в двух группах. Частота пневмонии также была одинаковой (4%).
Таким образом, в исследовании TRIBUTE тройная терапия БДП/ФФ/ГБ вызывала достоверное снижение частоты средне-тяжелых и тяжелых обострений ХОБЛ по сравнению с двойной терапией ДДАХ/ДДБА и не сопровождалась увеличением риска нежелательных явлений, в том числе пневмонии. Полученные данные свидетельствуют о том, что присоединение ИГКС к терапии двумя ингаляционными бронходилататорами позволяет улучшить результаты лечения у пациентов с тяжелой или очень тяжелой ХОБЛ, особенно при наличии хронического бронхита или повышенного числа эозинофилов в крови (≥2%).
Мета-анализ. Y. Zheng и соавт. провели мета-анализ 21 рандомизированного контролируемого исследования длительностью от 8 до 52 недель, в которых сравнивали эффективность и безопасность тройной терапии и других схем терапии у больных с ХОБЛ [30]. Тройная терапия двумя бронходилататорами и ИГКС привела к достоверному снижению частоты средне-тяжелых и тяжелых обострений ХОБЛ по сравнению с монотерапией ДДАХ (отношение рисков 0,71, 95% ДИ 0,600,95), комбинированной терапией ДДАХ/ДДБА (относительный риск 0,78, 95% ДИ 0,70-0,88) и ИГКС/ ДДБА (относительный риск 0,77, 95% ДИ 0,66-0,91). Кроме того, тройная терапия по сравнению с другими схемами терапии вызывала достоверное уменьшение степени бронхиальной обструкции и улучшение качества жизни. Достоверной разницы смертности между группами сравнения выявлено не было. Профиль безопасности тройной терапии был благоприятным. Риск пневмонии при тройной терапии увеличился в клинических исследованиях, в которых ее сравнивали с комбинированной терапии ДДАХ и ДДБА (относительный риск 1,53, 95% ДИ 1,25-1,87), в то время как в других исследованиях риск развития пневмонии был сопоставимым в группах сравнения.
Место тройной терапии в рекомендациях GOLD2019 года
В рекомендациях GOLD 2019 года выделен специальный раздел, посвященный тройной терапии, в котором указано, что она позволяет улучшить функцию легких и исходы, регистрируемые пациентами, в частности снизить риск обострений, по сравнению с монотерапией ДДАХ или комбинированной терапией ДДБА/ДДАХ [10]. Возможные алгоритмы перехода на тройную терапию при неэффективности терапии двумя препаратами изображены на (рис. 4.)
Заключение
В рекомендациях GOLD 2019 года пациентам с тяжелым и очень тяжелым течением ХОБЛ и высоким риском обострений, не отвечающим на лечение двумя длительно действующими бронходилататорами или бронходилататором в комбинации с ИГКС, предлагается назначать тройную терапию ДДАХ, ДДБА и ИГКС. Результаты рандомизированных клинических исследований и их мета-анализа показали, что тройная терапия приводит к достоверному снижению частоты среднетяжелых и тяжелых обострений ХОБЛ, степени бронхиальной обструкции и улучшению качества жизни по сравнению со всеми другими схемами терапии. Более выраженного снижения частоты обострений при присоединении ИГКС к двум длительно действующим бронходилататорами, по-видимому, можно ожидать у пациентов с числом эозинофилов в крови ≥2%. Перспективным представляется применение фиксированных комбинированных препаратов, таких как экстрамелкодисперсный БДП/ФФ/ГБ, эффективность которого была доказана в нескольких крупных контролируемых исследованиях (TRILOGY, TRINITY, TRI BUTE). Включение ИГКС в схему терапии может ассоциироваться с увеличением риска развития пневмонии, хотя при применении БДП/ФФ/ГБ не было отмечено повышения частоты этого нежелательного явления, в том числе по сравнению с комбинированной терапией ДДАХ/ДДБА или монотерапией ДДАХ.