бравадин или раеном что лучше
Бравадин или раеном что лучше
Вариабельность сердечного ритма (ВРС) представляет доступный, информативный и эффективный метод, позволяющий оценить регуляцию симпатической и парасимпатической нервной системами сердечно-сосудистой системы [4]. Показатели ВРС коррелируют с частотой неблагоприятных сердечно-сосудистых событий [7], и метод используется как для оценки текущего состояния организма, для прогнозирования исходов, так и для подбора оптимальных терапии с учетом вегетативного тонуса организма и контроля проводимой терапии.
При ИБС происходят дисбаланс симпатической и парасимпатической нервной систем, что выражается в нарушении ВРС, а именно увеличивается низкочастотный компонент (low frequency, LF) и снижается высокочастотный (high frequency, HF). Поэтому при ИБС, особенно после инфаркта миокарда, оправдано применение препаратов, позитивно влияющих на ВРС [9]. Известно несколько классов сердечно-сосудистых лекарственных препаратов, модулирующих ВРС: бета-блокаторы (ББ), ингибиторы ангиотензин-превращающего фермента и блокаторы рецепторов к ангиотензину. Классическими из них являются ББ, которые не только снижают частоту сердечных сокращений (ЧСС), но и нормализуют баланс симпатическая/парасимпатическая система по влиянию на ритм сердца в сторону увеличения его высокочастотной составляющей; вклад низкочастотной и очень низкочастотной составляющих, напротив, снижается [4].
Ивабрадин (Ива) является уникальным препаратом, изолированно влияющим на ритм сердца [1]. Он может быть назначен при стабильной стенокардии напряжения (ССН), например, при противопоказании к ББ. За последние 10 лет стали появляться данные и о влиянии Ива на ВРС. В исследовании Belal et al. (2013) [3] в небольшом исследовании на 15 добровольцах было показано, что Ива способствует более раннему наступлению и более существенной по степени оптимизации регуляторных систем в систематических сеансах биологической обратной связи. Однако до сих пор практически не было прямых сравнений эффектов ББ и f-ингибиторов. В единственном доступном исследовании Joanides et al. (2006) [8] на 10 здоровых добровольцах сравнивали оценивали эффекты Ива и неселективного ББ пропраналола на различные гемодинамические показатели, в т.ч. на вегетативную регуляцию сердечно-сосудистой системы. При этом было показано, что как Ива, так и пропранолол, повышали высокочастотную составляющую ВРС и увеличивали соотношение HF/LF. Однако небольшое количество пациентов и использование добровольцев в качестве объектов исследования снижают ценность исследования и ограничивают использование результатов у больных с ИБС. До настоящего времени прямого сравнения ББ и f-ингибиторов у больных с ИБС сердца на вегетативный статус проведено не было.
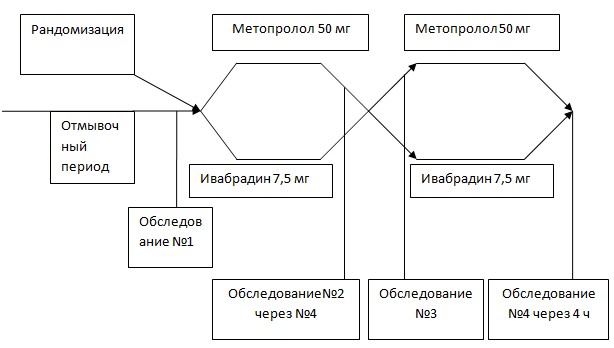
Цель. В слепом рандомизированном контролируемом исследовании с перекрёстным дизайном с острой фармакологической пробой сравнить влияние на вариабельность ритма сердцах у больных со стабильной стенокардией напряжения f-ингибитора ивабрадина с бета-блокатором метопролола тартратом.
Материалы и методы
Исследование было проведено у 33 больных со ССН.
Критерии включения: информированное согласие, диагноз «Стабильная стенокардия напряжения», стабильный приём ББ до исследования. Критерии исключения: артериальная гипотензия, прогрессирующая стенокардия, ЧСС менее 60 уд/мин и более 90 уд/мин на момент согласия исследования, хроническая сердечная недостаточность IIA стадии и выше, сахарный диабет, мерцательная аритмия, трепетание предсердий, АV-блокада II-III степени, декомпенсация сопутствующих заболеваний, повышение температуры, сепсис, миокардит.
Препараты исследования. Для сравнения были выбраны препараты единственный существующий на рынке f-ингибитор Ива 7,5 мг (Кораксан, Сервье, Франция) и один из самых распространенных ББ метопролола тартрат (Мет) 50 мг (Эгилок, «Гедеон Рихтер», Венгрия). Выбор препаратов обусловлен широким распространением обоих препаратов, сравнимой периодом полураспада (12 ч) и пиком концентрации в сыворотке крови (3-4 ч).
Результаты обследования
Базовые витальные параметры и параметры ВРС в группах при обследовании в группе 1 и группе 2
Стратегия выбора фармакотерапии стабильной ишемической болезни сердца
В статье обсуждаются вопросы дифференцированного выбора антиангинальной терапии у больных стабильными формами ишемической болезни сердца (ИБС). Особое внимание уделено возможностям ингибитора If-каналов ивабрадина у больных ИБС, стабильной стенокардией на
The article highlights the issues of differentiated choice of antianginal therapy in patients with stable forms of ischemic heart disease (IHD). Special attention was paid to possibilities of If-channels inhibitor of ivabradin in patients with IHD, stable stenocardia of tension.
Несмотря на успехи медицины, в настоящее время сохраняются высокие показатели заболеваемости и смертности от сердечно-сосудистой патологии, при этом основной среди заболеваний сердечно-сосудистой системы является ишемическая болезнь сердца (ИБС), на долю которой приходится более 60% умерших от кардиоваскулярной патологии. Показатели сердечно-сосудистой смертности в России в 2–4 раза выше, чем в западноевропейских странах, США, Канаде, Австралии [1, 2]. Данная ситуация обосновывает необходимость продолжения исследований, направленных на уточнение механизмов прогрессирования заболевания, что напрямую связано с возможностью совершенствования методов терапии ИБС.
Лечение ИБС нередко представляет большие трудности, которые обусловлены как разнообразием клинических форм, стадий болезни, вариантов ее течения, осложнений, так и многочисленностью используемых лекарственных препаратов, длительным их приемом. Необходимость многолетнего (иногда в течение всей жизни) приема значительного количества, зачастую дорогостоящих, медикаментов, ведет к возникновению ряда побочных эффектов, развитию толерантности (привыкания) к действию препаратов, уменьшению приверженности пациентов к лечению, а значит, к снижению эффективности проводимой терапии.
В связи с этим проводится постоянный поиск и разработка новых, наиболее эффективных способов и методов терапии данного заболевания.
Стратегия лечения больных стабильной ИБС
Основной стратегией лечения больных стабильной ИБС является предупреждение прогрессирования, улучшение прогноза и улучшение качества жизни за счет уменьшения частоты и интенсивности ангинозных приступов. Для решения этих задач необходимо проводить фармакотерапию в соответствии с современными рекомендациями, основанными на принципах доказательной медицины [3].
Общие принципы ведения больных с хроническими формами ишемической болезни сердца предполагают обязательное проведение мер, направленных на вторичную профилактику ИБС.
Целями вторичной профилактики пациентов с ИБС являются:
Направления вторичной профилактики ИБС
Медикаментозные методы лечения необходимо сочетать с мерами немедикаментозного воздействия на факторы риска развития атеросклероза, который в подавляющем большинстве случаев является морфологическим субстратом поражения коронарных артерий при ИБС.
Основные направления воздействий на факторы риска ИБС:
Подходы к фармакотерапии стабильной ИБС
В терапии стабильной ИБС выделяют два основных направления: влияние на прогноз и уменьшение симптомов. К первой группе относят препараты и вмешательства, которые по данным крупных исследований оказали влияние на «жесткие» конечные точки («hard» end-points): общую и сердечно-сосудистую смертность, острые сердечно-сосудистые катастрофы. К таким вмешательствам относится назначение всем больным препаратов (при отсутствии противопоказаний), доказанно улучшающих прогноз и увеличивающих продолжительность жизни (снижающие риск инфаркта миокарда (ИМ) и внезапной смерти), антитромбоцитарные препараты, статины (при непереносимости статинов или при недостижении целевых уровней липидов другие гиполипидемические препараты в монотерапии или в комбинации со статинами), ингибиторы АПФ.
Больным с приступами стенокардии или при выявлении эпизодов ишемии миокарда с помощью инструментальных методов назначают антиангинальную (антиишемическую) терапию. К препаратам антиангинального действия относят: бета-адреноблокаторы (БАБ), блокаторы кальциевых каналов (БКК), нитраты и нитратоподобные препараты, ивабрадин, никорандил, миокардиальные цитопротекторы (триметазидин, ранолазин), которые используют как в виде монотерапии, но чаще — в различных комбинациях.
Алгоритм оптимальной медикаментозной терапии больных стабильной ИБС изложен в рисунке. Он был внедрен в клиническую практику после проведенного исследования, показавшего конкурентоспособность фармакотерапии по сравнению с инвазивными методами (коронарная ангиопластика) лечения больных ИБС в плане прогноза.
Перечень антиангинальных препаратов значительно расширился и включает 2 группы. К 1-й группе относятся препараты, оказывающие влияние на развитие ишемии через показатели гемодинамики: БАБ, БКК, ингибиторы If-каналов (ивабрадин), нитраты и нитратоподобные средства. Активаторы калиевых каналов, триметазидин, ранолазин относятся к антиангинальным препаратам 2-й группы, не оказывающим существенного влияния на гемодинамические показатели. Сравнительная характеристика антиангинальных препаратов по механизму действия представлена в табл. 1, по гемодинамическим эффектам — в табл. 2.
Как видно из таблицы, наибольшим числом показаний обладают бета-адреноблокаторы и антагонисты кальция, с другой стороны — довольно быстро расширяются и доказательная база, и терапевтическая ниша для применения относительно новых молекул — в частности, ивабрадина. Во многом это объясняется тем, что одним из основных направлений антиишемической терапии является контроль частоты сердечных сокращений (ЧСС).
В клинической практике на сегодняшний день применяются три группы лекарственных средств, обладающих брадикардитическим действием: бета-адреноблокаторы, недигидропиридиновые антагонисты кальция и ингибитор If-каналов.
Бета-адреноблокаторы. Одни из самых изученных при лечении стабильной стенокардии, как препараты, влияющие на заболеваемость и смертность, включены в клинические рекомендации [3–6]. Для пациентов со стабильной ИБС предпочтительно выбирать высокоселективные, длительного действия средства, желательно обладающие плейотропными эффектами (вазодилатирующими, устраняющими эндотелиальную дисфункцию). Этим требованиям соответствуют метопролол сукцинат модифицированного высвобождения, бисопролол и, в наибольшей степени, небиволол.
Недигидропиридиновые антагонисты кальция. На практике используются пролонгированные формы верапамила и дилтиазема — как альтернатива бета-адреноблокаторам при противопоказаниях (например, при бронхиальной астме). С другой стороны, при хронической сердечной недостаточности (ХСН) применение ограничено, так как они ухудшают клиническое течение ХСН и повышают риск развития отека легких.
Стоит отметить, что снижение ЧСС до целевых значений зачастую требует назначения высоких доз бета-адреноблокаторов или антагонистов кальция, что сопряжено с нарастанием числа нежелательных явлений, или дозирование может быть лимитировано состоянием пациента (низкое АД, ухудшение бронхиальной проводимости).
Возможности ивабрадина
Большая часть больных ИБС со стабильной стенокардией напряжения в рутинной клинической практике не получает полноценной антиишемической и антиангинальной терапии в силу объективных трудностей и ограничений в назначении лекарственных средств, в первую очередь БАБ [7].
Ивабрадин — первый и единственный представитель нового терапевтического класса препаратов — ингибиторов If-каналов. Он специфически связывается с If-каналами в синоатриальном узле и избирательно подавляет ионный ток If, играющий ключевую роль в развитии спонтанной диастолической деполяризации; не затрагивает время проведения импульсов по внутрипредсердным, предсердно-желудочковым и внутрижелудочковым проводящим путям, не влияет на сократительную способность миокарда.
Большая доказательная база изучения различных эффектов ивабрадина свидетельствует о том, что области его применения не ограничиваются стабильными формами ИБС, а распространяются и на другие состояния и клинические ситуации. Так, доказано, что целесообразно назначать препарат больным c острым коронарным синдромом [8], после реваскуляризации миокарда [9–11], при острой декомпенсированной сердечной недостаточности [12] и при хронической сердечной недостаточности [13, 14].
Столь широкий спектр возможностей во многом объясняется наличием у препарата дополнительных свойств, таких как способность препарата положительно влиять на биохимические маркеры повреждения сердечно-сосудистой системы и уменьшать выраженность эндотелиальной дисфункции. Несмотря на то, что механизм действия ивабрадина напрямую не предполагает подобных влияний, имеется ряд экспериментальных и клинических работ, свидетельствующих о достаточно широком спектре положительных эффектов данного препарата, таких как обратное развитие ремоделирования ЛЖ, уменьшение фиброза, выраженности активации РААС, САС, улучшение функции эндотелия, положительное влияние на биохимические маркеры, свидетельствующие о повреждении сердечно-сосудистой системы, такие как sP-селектин, активатор плазминогена t-PA и др. [15–18].
Важное практическое значение имеют результаты крупного исследования SIGNIFY, которые позволили сформулировать четкие рекомендации по выбору оптимального режима дозирования ивабрадина у больных со стабильной стенокардией [19]. Эксперты Европейского агентства по контролю за оборотом лекарственных средств считают, что не следует начинать терапию ивабрадином с высоких доз. Стартовая доза препарата у пациентов со стенокардией напряжения II–IV ФК не должна превышать 5 мг 2 раза в день, а максимальная — 7,5 мг 2 раза в сутки.
Также в целях повышения безопасности проводимой комбинированной фармакотерапии следует избегать совместного применения ивабрадина с лекарственными препаратами, влияющими на активность изоферментов системы цитохрома P450. Так, сильными ингибиторами изоферментов системы цитохрома P450 являются противогрибковые средства группы азолов — кетоконазол, итраконазол, антибиотики макролиды (кларитромицин, эритромицин пероральный, джозамицин, телитромицин), ингибиторы ВИЧ-протеаз (нелфинавир, ритонавир), нефазодон, которые повышают средние концентрации ивабрадина в плазме крови в 7–8 раз. Не рекомендовано совместное применение ивабрадина с индукторами CYP3A4: рифампицин, барбитураты, фенитоин, зверобой продырявленный (Hypericum perforatum), грейпфрутовый сок, т. к. они снижают концентрацию ивабрадина в крови и его эффективность. Не следует сочетать ивабрадин с недигидропиридиновым БКК верапамилом, т. к. возрастает риск развития брадикардии и фибрилляции предсердий в результате увеличения концентрации ивабрадина в крови в 2 раза.
Фармакоэкономические исследования различных режимов фармакотерапии свидетельствуют о целесообразности и экономической обоснованности включения ивабрадина в комплексную терапию больных как со стабильными формами ИБС, так и с ХСН [20, 21].
Оригинальные и воспроизведенные лекарственные средства в России — законодательная база
В условиях постоянно расширяющегося рынка лекарственных препаратов (ЛП) практикующий врач постоянно сталкивается с вопросом выбора оригинальных препаратов и их генериков, или, согласно современной терминологии, воспроизведенных лекарственных средств (ЛС).
Согласно приказу Минздрава № 1175н от 20.12.2012 N 1175н (ред. от 30.06.2015) «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения», с июля 2013 года выбор конкретного торгового наименования ЛП не входит в компетенции лечащего врача, который должен выписывать ЛП только по международному непатентованному наименованию (МНН) [22].
Федеральный закон 61-ФЗ «Об обращении лекарственных средств» (ред. от 29.12.2015) содержит следующие определения оригинальных/референтных и воспроизведенных лекарственных средств и способов оценки их эквивалентности.
Оригинальное лекарственное средство — лекарственное средство, содержащее впервые полученную фармацевтическую субстанцию или новую комбинацию фармацевтических субстанций, эффективность и безопасность которых подтверждены результатами доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов.
В действующей редакции 61-ФЗ отсутствует понятие оригинального ЛС, оно заменено на «референтное» — лекарственный препарат, который впервые зарегистрирован в Российской Федерации, качество, эффективность и безопасность которого доказаны на основании результатов доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов, проведенных в соответствии с требованиями федерального законодательства, и который используется для оценки биоэквивалентности или терапевтической эквивалентности, качества, эффективности и безопасности воспроизведенного или биоаналогового (биоподобного) лекарственного препарата [23].
Воспроизведенный лекарственный препарат (дженерик, генерик, «многоисточниковое ЛС») — лекарственный препарат, который имеет такой же качественный состав и количественный состав действующих веществ в такой же лекарственной форме, что и референтный лекарственный препарат, и биоэквивалентность или терапевтическая эквивалентность которого референтному лекарственному препарату подтверждена соответствующими исследованиями.
Таким образом, основными отличиями оригинального препарата являются: инновационность и полный цикл клинических исследований — доклинических и клинических, в которых были продемонстрированы его эффективность и безопасность. Именно на оригинальных препаратах проводятся рандомизированные контролируемые исследования (РКИ), показывающие влияние терапевтического вмешательства на «жесткие» конечные точки. Автоматический перенос данных РКИ на воспроизведенные лекарственные средства не всегда корректен.
В настоящее время на фармацевтическом рынке РФ помимо оригинального ивабрадина (Кораксан «Лаборатории Сервье», Франция) представлены дженерики ивабрадина Бравадин (ивабрадина гидробромид компании ООО «КРКА-РУС»), Раеном (ивабрадина гидробромид компании «Гедеон Рихтер»), некоторые из которых, в отличие от оригинального ивабрадина, представляют собой не гидрохлорид, а гидробромид ивабрадина. В доступной литературе отсутствуют данные о результатах долгосрочных клинических исследований по оценке профиля безопасности препаратов, содержащих соли гидробромида. Учитывая потенциальный риск развития симптомов бромизма, представляется целесообразным в дальнейшем провести исследования безопасность долгосрочного применения препаратов, содержащих гидробромид, у больных с сердечно-сосудистыми заболеваниями.
Также при использовании дженериков ивабрадина следует учитывать тот факт, что несоблюдение дозировки может привести к изменению терапевтической эффективности и переносимости и, как следствие, к развитию неблагоприятных реакций на препарат. Принимая во внимание тот факт, что согласно действующему в настоящее время законодательству в нашей стране для дженериков допускается разница в биоэквивалентности ± 25% по отношению к оригинальному препарату, нельзя исключить повышение риска развития НПР при использовании различных дженериков ивабрадина, для которого существуют очень жесткие рекомендации по режиму дозирования.
Заключение
При выборе препаратов и режимов их дозирования необходимо учитывать множество факторов, определяющих индивидуальные особенности каждого конкретного пациента, наличие коморбидных заболеваний и состояний.
Фармакодинамические эффекты ивабрадина заключаются не только в урежении ЧСС, антиангинальных и антиишемических эффектах. Он также позволяет устранять негативные последствия повышенной ЧСС, в частности, снижать активность биохимических маркеров повреждения сердечно-сосудистой системы, что расширяет возможности его применения.
Включение ивабрадина в комбинированную антиангинальную и антиишемическую терапию больным с ИБС является экономически обоснованным подходом.
Литература
За остальным списком литературы обращайтесь в редакцию.
ФГБОУ ВО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Бравадин® (5 мг) (Ivabradine)
Инструкция
Торговое название
Международное непатентованное название
Лекарственная форма
Таблетки, покрытые пленочной оболочкой, 5 мг и 7,5 мг
Состав
Одна таблетка содержит
активное вещество – ивабрадина гидробромид 5,864 мг или 8,796 мг (эквивалентно ивабрадину 5 мг или 7,5 мг соответственно),
вспомогательные вещества: лактозы моногидрат, целлюлоза микрокристаллическая, повидон, натрия кроскармеллоза, кремния диоксид коллоидный безводный, магния стеарат,
пленочная оболочка: Opadry Orange 03H32599 (состав: гипромеллоза, титана диоксид (Е171), тальк, пропиленгликоль, железа оксид желтый (Е172), железа оксид красный (Е172)
Описание
Таблетки, покрытые пленочной оболочкой бледно оранжевого цвета, овальной формы, двояковыпуклые, с риской на одной стороне (для дозировки 5 мг).
Таблетки, покрытые пленочной оболочкой бледно оранжевого цвета, круглой формы, слегка двояковыпуклые, с фаской (для дозировки 7,5 мг).
Фармакотерапевтическая группа
Препараты для лечения заболеваний сердца. Прочие препараты для лечения заболеваний сердца. Прочие кардиотонические препараты. Ивабрадин
Фармакологические свойства
Фармакокинетика
Абсорбция и биодоступность
После перорального приема ивабрадин быстро и почти полностью абсорбируется в желудочно-кишечном тракте. Пик концентрации препарата в плазме (Сmax) при приеме натощак достигается примерно через 1 час. Абсолютная биодоступность составляет около 40% вследствие эффекта первого прохождения через кишечник и печень. Прием пищи замедляет абсорбцию приблизительно на 1 час и увеличивает экспозицию в плазме на 20-30%. Прием таблеток во время еды позволяет снизить колебания экспозиции.
Ивабрадин приблизительно на 70% связывается с белками плазмы, объем распределения близок к 100 л. Максимальная концентрация (Cmax) в плазме при постоянном приеме дозы 5 мг 2 раза в день составляет 22 нг/мл (коэффициент вариации (СV) = 29%). Средняя концентрация в плазме составляет 10 нг/л (коэффициент вариации (СV) = 38%) в стационарном состоянии.
Ивабрадин в значительной степени метаболизируется в печени и кишечнике путем окисления цитохромом Р450 3А4 (СYР3А4). Основным метаболитом является N-деметилированный метаболит (S 18982), его экспозиция составляет приблизительно 40% от исходного соединения. В метаболизме этого активного метаболита также участвует СYР3А4. Ивабрадин имеет низкое сродство к CYP3A4, не проявляет клинически значимого индуцирования или ингибирования CYP3A4, и, следовательно, влияние на метаболизм или концентрацию субстрата CYP3A4 в плазме крови маловероятно. И наоборот, сильные ингибиторы и индукторы могут существенно влиять на концентрацию ивабрадина в плазме крови.
Основной период полувыведения (Т1/2) ивабрадина из плазмы составляет 2 часа (70-75% от площади под фармакокинетической кривой (АUС)), а окончательный период полувыведения – 11 часов. Общий клиренс составляет приблизительно 400мл/мин, почечный клиренс – около 70мл/мин. Экскреция метаболитов происходит в одинаковой степени с мочой и калом. Около 4% от пероральной дозы выводится с мочой в неизмененном виде.
Кинетика ивабрадина для дозировок от 0,5 до 24 мг является линейной.
Особые группы пациентов
Пожилые пациенты: фармакокинетических различий (АUС и Cmax) между пациентами ≥60лет и ≥75лет и популяцией в целом не наблюдалось.
Нарушение функции печени: у пациентов с легкой степенью печеночной недостаточности (до 7 баллов по шкале Чайлд-Пью) АUС несвязанного ивабрадина и основного активного метаболита приблизительно на 20% выше, чем у лиц с функцией печени в норме.
Данные по применении ивабрадина у пациентов с умеренной печеночной недостаточностью (7-9 баллов по шкале Чайлд-Пью) ограничены и не позволяют сделать вывод об особенностях фармакокинетики ивабрадина у данной группы пациентов, а у пациентов с печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью) отсутствуют
Взаимосвязь между фармакокинетическими и фармакодинамическими свойствами (ФК/ФД взаимосвязь)
Анализ ФК/ФД взаимосвязи показал, что частота сердечных сокращений снижается почти линейно с увеличением концентрации ивабрадина и концентрации S 18982 в плазме крови для доз до 15-20 мг два раза в день. При более высоких дозах препарата снижение частоты сердечных сокращений уже не пропорционально концентрации ивабрадина в плазме крови и имеет тенденцию к достижению эффекта «плато». Высокие концентрации ивабрадина в плазме крови, которые можно достичь при одновременном применении ивабрадина с сильными ингибиторами CYP3A4, могут привести к чрезмерному снижению частоты сердечных сокращений, однако этот риск снижается при одновременном применении с умеренными ингибиторами CYP3A4.
Фармакодинамика
Бравадин – брадикардический препарат, избирательно и специфически ингибирующий канал If водителя сердечного ритма, который играет основную роль при спонтанной диастолической деполяризации клеток синусно-предсердного узла и регулирует частоту сердечных сокращений. Воздействие на сердце заключается в специфическом действии на синусный узел.
Ивабрадин может также взаимодействовать с каналом Ih сетчатки, который во многом сходен с каналом If. Он участвует во временной разрешающей способности зрительной системы, так как сокращает реакцию сетчатки на стимулирование ярким светом. В провоцирующих условиях (например, резкое изменение яркости освещенности) ивабрадин частично ингибирует Ih каналы, что приводит к преходящим изменениям яркости в ограниченной области зрительного поля (фосфены).
Основным фармакодинамическим свойством ивабрадина является специфическое дозозависимое снижение частоты сердечных сокращений (ЧСС). Анализ снижения сердечного ритма от дозы ивабрадина до 20 мг два раза в сутки показал тенденцию к достижению эффекта «плато», когда не происходит нарастания терапевтического эффекта при дальнейшем увеличении дозы, что снижает риск развития тяжелой брадикардии ниже 40 ударов в минуту.
В рекомендуемых дозах снижение ЧСС составляет приблизительно 10 ударов в минуту в покое и при физической нагрузке. Это приводит к снижению нагрузки на миокард в связи с уменьшением потребности миокарда в кислороде. Ивабрадин не влияет внутрисердечную проводимость, сократительную способность миокарда (отсутствие отрицательного инотропного действия) или реполяризацию желудочка:
— в электрофизиологических исследованиях, ивабрадин не оказывал влияния на время проведения импульсов по предсердно-желудочковым или внутрижелудочковым путям, а также на скорректированный интервал QT;
— у пациентов с дисфункцией левого желудочка (фракция выброса левого желудочка (ФВЛЖ) между 30 и 45%), ивабрадин не оказывал негативного влияния на ФВЛЖ.
Клиническая эффективность и безопасность
Эффективность препарата в дозе 5 мг 2 раза в день проявляется в течение 3-4 недель после начала лечения. При самой низкой активности препарата общая продолжительность физической нагрузки увеличивается примерно на 1 минуту после одного месяца приема дозировки 5 мг 2 раза в день; последующее увеличение почти на 25 секунд происходит после дополнительного трехмесячного периода с форсированным титрованием до 7,5 мг 2 раза в день. Эффективность дозировок 5 мг и 7,5 мг при приеме 2 раза в день наблюдается по параметрам тестирования с физической нагрузкой (общая продолжительность нагрузки, время до наступления ограниченной стенокардии, время до наступления стенокардии и время до появления депрессии сегмента ST на 1 мм) и сопровождается снижением частоты приступов стенокардии приблизительно на 70%. При приеме препарата 2 раза в день обеспечивается равномерная эффективность действия в течение 24 часов.
При приеме препарата Бравадин в комбинации с атенололом 50 мг 1 раз в день отмечается дополнительный эффект на параметры теста переносимости физической нагрузки при минимальной активности препарата (через 12 часов после перорального приема).
Бравадин полностью сохраняет свою эффективность в течение 3-4 месячных курсов лечения. Признаков развития фармакологической толерантности во время лечения или синдрома отмены при внезапном прекращении лечения не наблюдется.
Дозозависимое снижение ЧСС и значимое уменьшение так называемого двойного произведения (ЧСС помноженное на систолическое артериальное давление (САД)) в состоянии покоя и при физической нагрузке обуславливает противоангинальное и противоишемическое действие препарата Бравадин. Влияние препарата на артериальное давление (АД) и периферическое сопротивление сосудов ничтожно мало. У пациентов с сахарным диабетом противоангинальная и противоишемическая эффективность сохраняется, профиль безопасности при этом аналогичен профилю безопасности у пациентов, не страдающих сахарным диабетом.
Продолжительное снижение ЧСС наблюдается при приеме препарата в течение не менее 1 года. Влияния на метаболизм глюкозы и жиров не происходит.
Достоверно доказано снижение частоты госпитализаций по поводу фатального и нефатального инфаркта миокарда на 36% (р=0,001), частоты необходимости коронарной реваскуляризации на 30% (р=0,016), снижение частоты сердечно-сосудистой смертности у пациентов со стабильной стенокардией на 24% (р=0,05) и значительное снижение уровня госпитализации по поводу острого инфаркта миокарда на 42% (р=0,021). Данное снижение риска госпитализации по поводу острого фатального и нефатального инфаркта миокарда было еще больше (73%, р=0,002) у пациентов со стенокардией и ЧСС >70 ударов/мин.
Так же достоверно доказано, что у пациентов с умеренными и тяжелыми симптомами хронической и сердечной недостаточности, со сниженной фракцией выброса левого желудочка (ФВЛЖ ≤35%), получавших стандартную терапию (β-блокаторы, ингибиторы АКФ и/или антагонисты рецепторов ангиотензина II, диуретики антиальдостероновые препараты) при добавлении ивабрадина наблюдается статически значимое снижение относительного риска сердечно-сосудистой смертности и госпитализации по поводу обострения сердечной недостаточности на 18% (отношение рисков ивабрадин/плацебо: 0,82, ДИ 95% [0.75;0.90] – р

.gif)
_575.gif)
_575.gif)