большая неврологическая панель что это
Генетическая панель «Нейродегенеративные заболевания»
Нейродегенеративные заболевания представляют собой широкий спектр различных по своей природе болезней, обусловленных постепенной гибелью отдельных групп нервных клеток и характеризующихся неуклонно прогрессирующим неврологическим дефицитом, включая двигательные расстройства, психоэмоциональные и когнитивные (вплоть до деменции) нарушения и эпилептические приступы. Необходимо отметить, что нейродегенеративные заболевания могут манифестировать как во взрослом, так и в детском возрасте.
Эпидемиология
Более 40 млн людей по всему миру страдают различными нейродегенеративными заболеваниями, из них порядка 10 млн — это пациенты с болезнью Паркинсона. В раннем возрасте распространённость нейродегенеративных заболеваний составляет около 1:1500.
Механизмы развития нейродегенеративных заболеваний
Патофизиологические механизмы нейродегенеративных заболеваний включают в себя синтез и агрегацию белков с патологической конформацией, что, в свою очередь, запускает каскад иммунных и метаболических нарушений, накопление металлов в центральной нервной системе, нарушение энергетического обмена клеток, дефицит ферментов и т.д. При этом, большая роль в развитии нейродегенеративного процесса принадлежит генетическим факторам. Выделяют как моногенные нейродегенеративные заболевания(например, болезнь Гентингтона, спинальные амиотрофии, ряд вариантов спиноцеребеллярных атаксий, болезнь Вильсона, моногенные варианты болезни Паркинсона, спастические параплегии, пароксизмальные дискинезии и пр.), так и болезни, развивающиеся вследствие нарушений функционирования целых ансамблей генов в сочетании с действием неблагоприятных факторов внешней среды (идиопатическая болезнь Паркинсона, атипичный паркинсонизм, болезнь Альцгеймера, боковой амиотрофический склероз, лобно-височная деменция и пр.). При этом, важно помнить, что отсутствие отягощённого семейного анамнеза по нейродегенеративному заболеванию не исключает наличие генетической предрасположенности к его развитию.
Диагностика
Диагностика нейродегенеративных заболеваний складывается из комплексной оценки клинической картины, характера дебюта и прогрессирования заболевания, лабораторно-инструментальных исследований и данных нейровизуализации. Отдельное место занимают в диагностическом процессе методы генетического тестирования. Учитывая сложные взаимоотношения генотипа и фенотипа заболевания, очень часто генетическое тестирование не ограничивается анализом одного-двух генов. В трудных диагностических случаях для удешевления и повышения эффективности диагностического поиска широко применяется метод высокопроизводительного секвенирования, позволяющего анализировать сразу до нескольких сотен генов.
Основные представители нейродегенеративных заболеваний
— Деменции (болезнь Альцгеймера, лобно-височная деменция, наследственные прионные заболевания).
— Паркинсонизм (болезнь Паркинсона, мультисистемная атрофия, кортикобазальная дегенерация, болезнь диффузных телец Леви, прогрессирующий надъядерный паралич).
— Наследственные мышечные дистонии.
— Пароксизмальные двигательные расстройства (пароксизмальные дискинезии).
— Нейродегенерация, ассоциированная с накоплением металлов (болезнь Вильсона, нейродегенерации с накоплением железа, синдром Фара, накопление марганца).
— Атаксии (спиноцеребеллярные атаксии, не связанные с экспансией нуклеотидных повторов).
— Наследственные моторно-сенсорные нейропатии (болезнь Шарко-Мари-Тута).
— Нейрометаболические заболеваний (нейрональный цероидный липофусциноз, лизосомные болезни накопления, сфинголипидозы).
— Спастические параплегии (болезнь Штрюмпеля, в т.ч. осложнённые формы).
— Болезни мотонейрона (боковой амиотрофический склероз, спинальные мышечные атрофии).
— Болезни белого вещества (синдром исчезающего белого вещества, прогрессирующие лейкодистрофии).
— Редкие моногенные синдромы, сопровождающиеся нейродегенерацией (болезнь Айкарди-Гутьерес, синдром Жубер, синдром Кноблоха).
— Митохондриальные заболевания вследствие мутаций в ядерных генах.
Что даёт генетическое исследование?
Описание и возможности метода
Исследование проводится с помощью метода высокопроизводительного секвенирования (NGS) на секвенаторе нового поколения со средним покрытием не менее 70-100х. В панель «Нейродегенеративные заболевания» входят 723 гена, мутации в которых могут приводить к развитию нейродегенеративных заболеваний. Не стоит забывать, что некоторые заболевания из группы наследственных НДЗ обусловлены экспансией нуклеотидных повторов или хромосомными перестройками, что является ограничением данного метода.
Анализ проходит быстро и безболезненно. Всё, что требуется для анализа – это образец крови.
Исследуемые гены: AARS, AARS2, ABCB7, ABCD1, ABHD12, ACAD9, ACADM, ACADS, ACADVL, ACO2, ACTB, ACTG1, ADAMTSL2, ADAR, ADCK3, ADCY5, ADGRG1, AFG3L2, AGA, AGK, AHI1, AIFM1, AIMP1, AIRE, AKT3, ALAS2, ALDH18A1, ALDH3A2, ALG1, ALG11, ALG12, ALG3, ALG6, ALG8, ALS2, AMACR, AMPD1, AMPD2, ANG, ANO10, ANO3, ANTXR2, AP1S2, AP4B1, AP4E1, AP4M1, AP4S1, AP5Z1, APOE, APP, APTX, ARFGEF2, ARG1, ARL13B, ARL6IP1, ARSA, ARSB, ARX, ASAH1, ASCL1, ASPA, ASPM, ATCAY, ATL1, ATM, ATN1, ATP13A2, ATP1A3, ATP5E, ATP6AP2, ATP7A, ATP7B, ATP8A2, ATPAF2, ATR, ATRX, ATXN1, ATXN10, ATXN2, ATXN3, ATXN7, AUH, B3GALNT2, B4GALNT1, B4GAT1, B9D1, B9D2, BCAP31, BCS1L, BDNF, BEAN1, BEST1, BICD2, BOLA3, BRAF, BSCL2, BTD, BUB1B, C10orf2, C12orf65, C19orf12, C5orf42, C9orf72, CA2, CA8, CACNA1A, CACNA1B, CACNB4, CASC5, CASK, CC2D2A, CCDC88C, CCM2, CCT5, CDK5RAP2, CDON, CENPJ, CEP135, CEP152, CEP290, CEP41, CEP63, CHCHD10, CHKB, CHMP1A, CHMP2B, CISD2, CLCN2, CLN3, CLN5, CLN6, CLN8, COA5, COASY, COL11A2, COL18A1, COL2A1, COL4A1, COL6A3, COMT, COQ2, COQ6, COQ9, COX10, COX14, COX15, COX20, COX4I2, COX6B1, CP, CPT1A, CPT1C, CPT2, CRAT, CSF1R, CSPP1, CSTB, CTNS, CTSA, CTSC, CTSD, CTSF, CTSK, CYP27A1, CYP2U1, CYP7B1, D2HGDH, DARS, DARS2, DCAF17, DCHS1, DCTN1, DCX, DDB2, DDHD1, DDHD2, DGUOK, DHCR24, DHCR7, DLAT, DLD, DNAJB2, DNAJC19, DNAJC5, DNAJC6, DNM1L, DNMT1, DPAGT1, DYM, DYNC1H1, DYRK1A, EARS2, ECE1, EDN3, EEF2, EFTUD2, EIF2AK3, EIF2B1, EIF2B2, EIF2B3, EIF2B4, EIF2B5, EIF4G1, ELOVL4, ELOVL5, EMX2, ENTPD1, EPM2A, ERBB4, ERCC2, ERCC3, ERCC4, ERCC5, ERCC6, ERCC8, ERLIN2, ETFA, ETFB, ETFDH, ETHE1, EXOSC3, EZH2, FA2H, FAM126A, FAM134B, FARS2, FASTKD2, FAT4, FBXO38, FBXO7, FGF14, FGF8, FGFR3, FH, FIG4, FKRP, FKTN, FLNA, FLVCR1, FOLR1, FOXRED1, FTL, FUCA1, FUS, FXN, GAA, GAD1, GALC, GALNS, GAN, GARS, GATA3, GBA, GBA2, GBE1, GCDH, GCH1, GCLC, GDAP1, GDNF, GFAP, GFER, GFM1, GJB1, GJC2, GLA, GLB1, GLI2, GLI3, GM2A, GMPPB, GNAL, GNAQ, GNE, GNPTAB, GNPTG, GNS, GOSR2, GPC3, GRID2, GRN, GUSB, HADH, HARS2, HEPACAM, HEXA, HEXB, HGSNAT, HNRNPA1, HNRNPA2B1, HPRT1, HRAS, HSD17B4, HSPB1, HSPB3, HSPB8, HSPD1, HTRA1, HTRA2, HTT, HYAL1, IBA57, IDS, IDUA, IER3IP1, IFIH1, IGHMBP2, INPP5E, ISCU, ISPD, ITM2B, ITPR1, JPH3, KANK1, KARS, KCNA1, KCNC3, KCND3, KCNJ10, KCNMA1, KCTD17, KCTD7, KIAA0196, RUBCN, KIF11, KIF1A, KIF1C, KIF2A, KIF5A, KIF5C, KIF7, KMT2D, KRIT1, L1CAM, L2HGDH, LAMA2, LAMC3, LAMP2, LARGE, LIAS, LIPA, LMNB1, LRPPRC, LRRK2, LYST, MAG, MAN2B1, MANBA, MAPT, MARS, MARS2, MATR3, MBD5, MCOLN1, MCPH1, MECP2, MED12, MED17, MEF2C, MFN2, MFSD8, MGAT2, MGME1, MKS1, MLC1, MPI, MPV17, MRE11A, MRPS16, MRPS22, MSMO1, MTFMT, MTHFR, MTO1, MTPAP, MTTP, NAGA, NAGLU, NDE1, NDUFA1, NDUFA10, NDUFA11, NDUFA12, NDUFA13, NDUFA2, NDUFA9, NDUFAF1, NDUFAF2, NDUFAF3, NDUFAF4, NDUFAF5, NDUFAF6, NDUFB3, NDUFB9, NDUFS1, NDUFS2, NDUFS3, NDUFS4, NDUFS6, NDUFS7, NDUFS8, NDUFV1, NDUFV2, NEFH, NEU1, NFIX, NFU1, NHEJ1, NHLRC1, NIN, NIPA1, NKX2-1, NOP56, NOTCH3, NPC1, NPC2, NPHP1, NPHP3, NSD1, NT5C2, NUBPL, OCLN, OFD1, OPA1, OPA3, OPHN1, OPTN, PAFAH1B1, PANK2, PARK2, PARK7, PAX6, PC, PCNT, PDCD10, PDGFB, PDGFRB, PDHA1, PDHB, PDHX, PDP1, PDSS1, PDSS2, PDYN, PEX1, PEX10, PEX11B, PEX12, PEX13, PEX14, PEX16, PEX19, PEX2, PEX26, PEX3, PEX5, PEX6, PEX7, PFN1, PGAP1, PHOX2A, PHOX2B, PHYH, PIGA, PIGN, PIK3CA, PIK3R2, PIK3R5, PINK1, PLA2G6, PLEKHG5, PLP1, PMM2, PNKD, PNKP, PNPLA6, PNPT1, POLG, POLG2, POLH, POLR3A, POLR3B, POMGNT1, POMGNT2, POMK, POMT1, POMT2, PPP2R2B, PPT1, PQBP1, PRICKLE1, PRKCG, PRKRA, PRNP, PRPH, PRPH2, PRRT2, PSAP, PSEN1, PSEN2, PTCH1, PTEN, PTPN11, PUS1, QDPR, RAB18, RAB3GAP1, RAB3GAP2, RAF1, RAI1, RARS2, RBBP8, REEP1, REEP2, RELN, RET, RFT1, RMND1, RNASEH2A, RNASEH2B, RNASEH2C, RNASET2, RPGRIP1L, RRM2B, RTN2, RTTN, SACS, SAMHD1, SARS2, SCARB2, SCO1, SCO2, SCP2, SDHA, SDHAF1, SDHAF2, SDHB, SDHC, SDHD, SEPSECS, SERAC1, SETX, SGCE, SGSH, SHH, SIGMAR1, SIL1, SIX3, SLC16A2, SLC17A5, SLC19A2, SLC19A3, SLC1A3, SLC20A2, SLC22A5, SLC25A12, SLC25A15, SLC25A19, SLC25A20, SLC25A3, SLC25A38, SLC25A4, SLC2A1, SLC30A10, SLC33A1, SLC5A2, SLC5A7, SLC6A3, SLC6A8, SMPD1, SNAP29, SNCA, SOD1, SORL1, SOX10, SPAST, SPG11, SPG20, SPG21, SPG7, ALDH18A1, SPR, SPTBN2, SQSTM1, SRD5A3, SRPX2, STAMBP, STIL, STUB1, SUCLA2, SUCLG1, SUMF1, SURF1, SYNE1, SYNJ1, SYT14, TACO1, TAF1, TARDBP, TAZ, TBC1D20, TBP, TCF4, TCTN1, TCTN2, TDP1, TECPR2, TFG, TGIF1, TGM6, TH, THAP1, TIMM8A, TK2, TMEM126A, TMEM138, TMEM165, TMEM216, TMEM231, TMEM237, TMEM5, TMEM67, TMEM70, TOR1A, TPK1, TPP1, TREM2, TREX1, TRMU, TRPV4, TSC1, TSC2, TSEN2, TSEN34, TSEN54, TSFM, TTBK2, TTC19, TTC21B, TTPA, TUBA1A, TUBA8, TUBB2B, TUBB3, TUBB4A, TUBG1, TUBGCP6, TUFM, TUSC3, TYMP, TYROBP, UBA1, UBE3A, UBQLN2, UQCRB, UQCRC2, UQCRQ, VAMP1, VAPB, VCP, VEGFA, VLDLR, VPS13A, VPS13B, VPS35, VPS37A, VRK1, WDR45, WDR62, WFS1, WWOX, XK, XPA, XPC, XPNPEP3, YARS2, ZEB2, ZFYVE26, ZFYVE27, ZIC2, ZNF335, ZNF423
Материал для исследования: Венозная кровь с ЭДТА 2 мл.
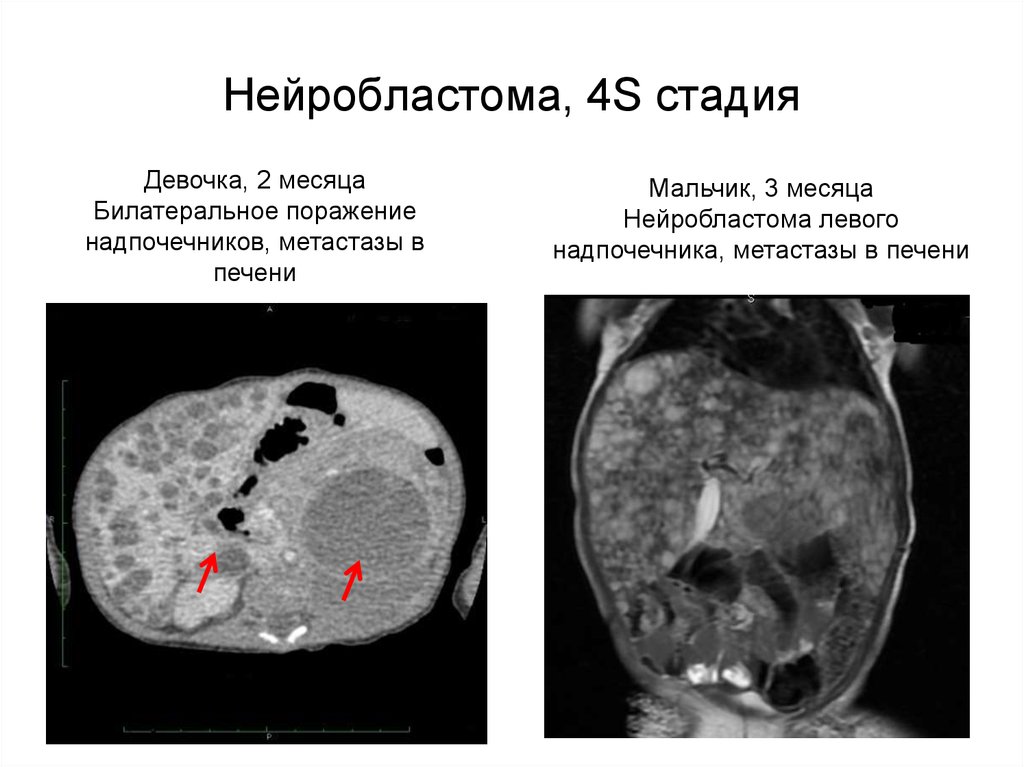
Нейробластома: причины, симптомы и лечение и диагностика нейробластом
Это злокачественная опухоль, формирующаяся из эмбриональных нейробластов симпатической нервной системы. Она занимает 14 % среди всех раковых заболеваний у детей, в 90 % случаев выявляется в возрасте до 5 лет. Опухоль может быть и врожденной, часто встречается на фоне пороков развития. У взрослых нейробластомы за редким исключением не развиваются.
В качестве основной причины возникновения опухоли считаются приобретенные мутации, появляющиеся под влиянием неблагоприятных факторов. Присутствует корреляция между наличием нейробластомы и аномалиями развития, врожденными патологиями иммунитета.
Опухоль имеет наследственную природу в 1-2 % случаев, наследуется по аутосомно-доминантному типу. В случае семейной формы рака типично раннее начало болезни (обычно 8 месяцев).
При нейробластоме присутствует такой патогномоничный генетический дефект, как потеря участка короткого плеча первой хромосомы. У 30 % больных в клетках опухоли обнаруживаются амплификация или экспрессия N-myc онкогена.
Классификация нейробластомы
Выделяют такие стадии развития опухоли:
I: одиночный узел до 5 см величиной, метастазов нет.
II: одиночное образование 5-10 см, отсутствуют признаки поражения лимфоузлов и отдаленных органов.
III: опухоль до 10 см с вовлечением в онкологический процесс региональных лимфоузлов, но без поражения отдаленных органов.
IV A: образование любого размера с отдаленными метастазами.
IV B: множественные опухоли с синхронным ростом. Невозможно установить наличие метастазов.
Симптомы нейробластомы
Клиническая картина зависит от локализации опухоли, наличия метастазов, количества продуцируемых образованием вазоактивных веществ. Чаще всего нейробластомы встречаются в надпочечниках, могут обнаруживаться в забрюшинном пространстве, средостении, в области таза и в районе шеи.
Основными признаками заболевания считаются:
Метастазирование может сопровождаться быстрым увеличением печени в размерах, образованием на коже грубых узлов, болями в костях, увеличением лимфатических узлов, анемией, кровоизлияниями.
Диагностика нейробластомы
Исследование включает в себя гистологический анализ опухоли и метастазов. Диагноз ставят с учетом вовлечения в онкологический процесс костного мозга, на основе данных о повышенном уровне катехоламинов или их производных.
Диагностика нейробластомы также включает в себя:
Терапия нейробластомы
Противоопухолевое лечение предусматривает:
На I-II стадии проводят операцию, которой предшествует химиотерапия. На III стадии опухоль, как правило, неоперабельна, что делает химиотерапию обязательной. На IV стадии показана высокодозовая химиотерапия, операция и пересадка костного мозга.
Обычно нейробластому обнаруживают на IV стадии, при которой 5-летняя выживаемость больных составляет 20 %. Наиболее благоприятен прогноз у детей раннего возраста в отсутствии метастазов в костях. В целом выживаемость составляет около 50 %.
Оценить риск развития нейробластомы и подобрать оптимальную противоопухолевую терапию позволяют молекулярно-генетические тесты. Их можно пройти в медико-генетическом центре «Геномед».
Инсульт
Заболевание обусловлено нарушением кровоснабжения отдельного участка головного мозга, ведущим к необратимым повреждениям и гибели клеток. Инсульт занимает четвертое место в мире среди заболеваний с летальным исходом. Около 75 % случаев приходится на людей старше 65 лет.
Генетика и инсульт
Классификация инсультов
Острое нарушение мозгового кровообращения может быть:
Причины и факторы риска инсульта
Чаще всего острое нарушение кровообращения в головном мозге происходит вследствие:
Симптоматическая картина инсульта
Основными признаками острого нарушения кровообращения в мозгу является головная боль. Она возникает внезапно, имеет высокую интенсивность, усиливается при изменении положения тела, при наклоне, повороте. Помимо головной боли при инсульте человек страдает от таких проявлений:
Диагностика инсульта
Крайне важно обратиться за медицинской помощью при первых признаках острого нарушения кровообращения в мозгу. Это позволит купировать его как можно раньше и повысит шансы на выздоровление.
Для диагностики используются такие методы:
Особенности лечения инсульта
Крайне важно правильно оказать человеку первую помощь:
Лечение ишемического инсульта включает в себя медикаментозную терапию, медицинские процедуры для удаления тромба или устранения стеноза сосуда (механическое удаление тромба, интраартериальный тромболиз, каротидная эндартерэктомия, ангиопластика и стентирование).
В случае геморрагической формы нарушения мозгового кровообращения проводят медикаментозное лечение и оказывают хирургическую помощь (клипирование сосуда, эндоваскулярная эмболизация, удаление артериовенозных мальформаций).
Восстановление после инсульта включает в себя комплекс таких мероприятий:
Около 10 % пациентов полностью восстанавливаются после инсульта, 25 % — имеют незначительные нарушения. У 40 % пострадавших сохраняются умеренные и тяжелые нарушения, вследствие чего они нуждаются в посторонней помощи. Около 10 % больных впоследствии требуют постоянного ухода в спецучреждениях, 15 % умирают.
Профилактика инсульта сводится к рационализации режима труда и отдыха, правильному питанию, нормализации сна, сокращению соли в рационе, своевременному лечению сердечно-сосудистых патологий.
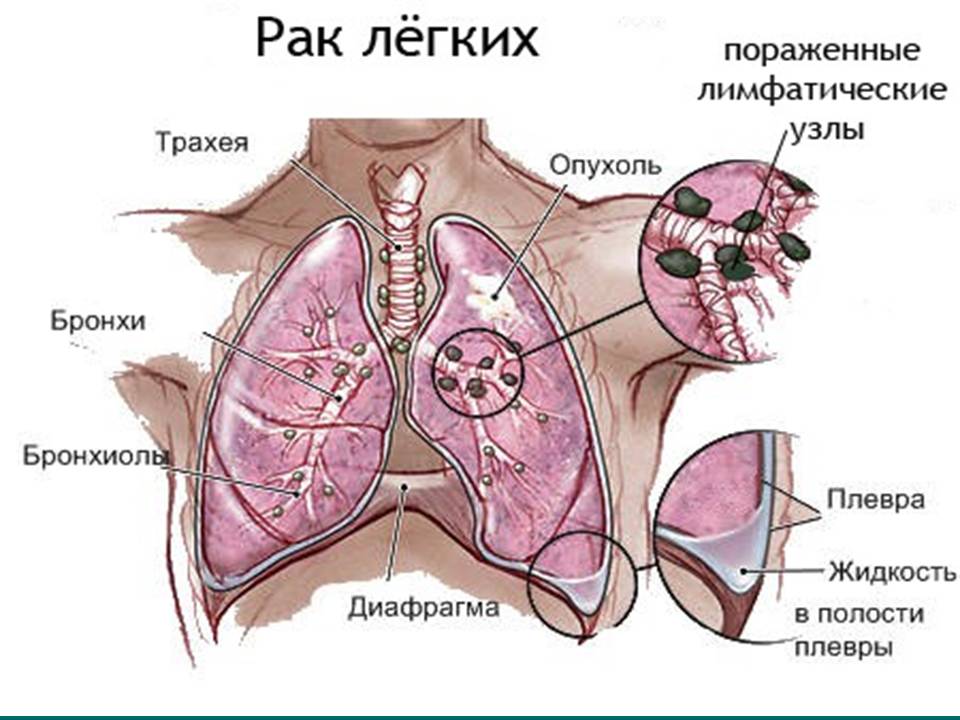
Рак легкого
Болезнь представляет собой злокачественное образование, которое формируется из эпителиальной ткани бронхов различного калибра. В развитых странах рак легкого является наиболее часто встречающейся онкопатологией. В нашей стране он стоит на первом месте среди раковых заболеваний. Каждая четвертая опухоль встречается у мужчин.
Причины рака легкого
Курение является основной причиной этого заболевания. Также рак легкого может быть связан с действием канцерогенов (асбест, радон), пылевых частиц, ионизирующего излучения, а также вирусными инфекциями. Эти факторы вызывают кумулятивные изменения в ДНК-клеток, выстилающих ткани бронхов. Чем больше повреждены эти ткани, тем выше риск онкопатологии.
Отечественная медицина выделяет такие стадии рака:
По гистологической картине опухоль может иметь форму:
Клиническая картина
Типичные симптомы рака легкого:
Клиническая картина может меняться в зависимости от локализации опухоли:
Диагностика рака легкого
Проводят клиническое обследование пациента, рентгенологическое исследование, бронхоскопию, трансторакальную биопсию, УЗИ, анализы на онкомаркеры, а также оценку мутационного статуса рецептора эпидермального фактора роста.
Диагностика рака легкого проводится на основании таких онкомаркеров, как CEA, CYFRA 21-1, TPA, Ca 15-3, NSE, CgA, EA и Cyfra 21-1, ERCC1. Прогностическую ценность имеют DUSP6, MMD, STAT1, ERBB3, LCK. Для оценки прогноза и ответа на терапию исследуются гены BRAC1, EGFR, RRM1.
Лечение рака легкого
Терапия онкозаболевания может включать:
В отсутствие лечения рака легкого смертность достигает 87 % в течение 2 лет. После операции выживаемость составляет 30 % в течение следующих 5 лет. Раннее обнаружение заболевания повышает шансы выздоровление до 80 %.
Профилактика сводится к отказу от курения, исключению действия канцерогенных факторов и вредностей, регулярному прохождению ФОКГ, своевременному лечению болезней легких.
Пройти генетическое тестирование и исследование на онкомаркеры можно в медико-генетическом центре «Геномед».
Причины, формы и диагностика анеуплоидии
Анеуплоидией называют изменение кариотипа, когда число хромосом некратно гаплоидному набору. Это приводит к нарушению эмбрионального развития, является частой причиной самопроизвольных выкидышей, может вызывать некоторые наследственные синдромы.
Причины анеуплоидии
Изменение кариотипа вызывают нарушения сегрегации хромосом в митозе или мейозе. В случае если гомологичные хромосомы одной или нескольких пар в анафазе I мейоза не расходятся, то развивается врожденная анеуплоидия.
Если половая клетка с лишней или недостающей хромосомой сливается с нормальной гаплоидной гаметой, то образовавшаяся зигота несет клетки с нечетным количеством хромосом. Зигота, имеющая число хромосом, меньше нормального диплоидного набора, обычно не развивается. Плодное яйцо с лишними хромосомами способно к развитию, но в большинстве случаев развитие сопровождается серьезными аномалиями.
По типу вовлеченных хромосом различают анеуплоидию половых хромосом и аутосомную. Первая характеризуется более мягкими фенотипическими проявлениями.
Выделяют также такие формы, как моносомия — отсутствие в диплоидном организме одной хромосомы, нуллисомия — отсутствие двух гомологичных хромосом, трисомия — наличие дополнительной хромосомы. Нарушения в сфере половых хромосом могут иметь формы тетрасомии и пентасомии (встречаются крайне редко).
Синдромы, связанные с анеуплоидией
Моносомия по Х-хромосоме является причиной синдрома Шерешевского-Тернера. Таким нарушением страдают исключительно женщины. Они имеют нормальное интеллектуальное развитие и ведут полноценный образ жизни, однако для больных характерны бесплодие, пороки развития внутренних органов и другие внешние признаки хромосомной патологии.
Жизнеспособная форма трисомии возможна только по хромосоме 21, однако она приводит к развитию синдрома Дауна. Трисомия по хромосоме 13 является причиной синдрома Патау, по хромосоме 18 — синдрома Эдвардса. Они характеризуются ранней постнатальной смертностью.
Трисомии половых хромосом встречаются чаще. Одной из форм подобного типа анеуплоидии является синдром Клайнфельтера. Для него характерно наличие мужской Y-хромосомы при одной или двух лишних Х-хромосомах. Страдающие синдромом Клайнфельтера вследствие анеуплоидии — мужчины, имеющие некоторые женские вторичные половые признаки. Обычно они бесплодны и имеют низкий уровень интеллектуального развития.
Синдром трипло-X является такой формой анеуплоидии, при которой у женщины присутствует лишняя Х-хромосома. В основном больные имеют нормальное физическое и психическое развитие, хромосомные аномалии у них выявляются, как правило, случайно. При синдроме трипло-X анеуплоидия не приводит к аномалиям полового развития, однако повышен риск спонтанных выкидышей и хромосомных патологий у потомства. Лишь у некоторых женщин присутствуют нарушения репродуктивной функции.
Лишняя Y-хромосома у мужчин является синдромом, при котором анеуплоидия развивается вследствие слияния нормальной яйцеклетки со сперматозоидом, являющимся носителем второй Y-хромосомы. Патология выявляется случайно, обычно носители не знают о ее наличии. Для таких мужчин характерен более высокий рост, небольшие нарушения координации движений, у половины из них имеются трудности с обучением, нарушения речи и письма.
Диагностика анеуплоидий
Риск рождения ребенка с хромосомной аномалией даже у полностью здоровых родителей составляет 5 %. Поэтому так важно выявить возможные аномалии, в т. ч. анеуплоидии, вызывающие наследственные синдромы, на раннем сроке беременности.
Заранее оценить риски помогают скрининговые тесты и УЗИ. Они не дают точной информации о наличии хромосомной патологии, но позволяют выявить беременных группы риска. Наиболее точный диагноз помогает установить неинвазивный пренатальный тест (НИПТ).
В медико-генетическом центре «Геномед» вы можете пройти такое исследование. НИПТ позволяет диагностировать анеуплоидии, в т. ч. трисомии, моносомии, численные аномалии половых хромосом. Точность исследования достигает 99 %. Благодаря тесту можно исключить наличие у будущего ребенка таких заболеваний, как синдромы Дауна, Эдвардса, Патау, Тернера и т. д.
Для того чтобы провести НИПТ и обнаружить/исключить анеуплоидии, достаточно 15 мл венозной крови будущей матери. Это позволяет избежать инвазивных методов пренатальной диагностики, которые грозят осложнениями.
НИПТ в медико-генетическом центре «Геномед» с высокой достоверностью определяет анеуплоидии, поскольку основан на особом алгоритме обработки сигналов. Он позволяет сравнивать и обнаруживать отличия материнской ДНК, присутствующие в плазме/лейкомассе, с ДНК плода, находящейся только в плазме.